银杏酸纯化、结构修饰及活性研究进展*
杨兆麒,徐佳元,陈 旺,2,冯自立,2,3
(1 陕西理工大学,陕西 汉中 723000;2 陕西省天然活性产物产业化工程技术研究中心,陕西 汉中 723000;3 秦巴生物资源与生态环境省部共建重点实验室,陕西 汉中 723000)
银杏叶中除了黄酮、内酯等活性成分外,还含有具有毒副作用的烷基酚酸类化合物,包括一系列漆酚酸类银杏酸(Ginkgolic acid,GA),由于其具有致敏毒性[1],2020年国家药典规定银杏酸在银杏叶提取物中的含量不得超过5 mg/L,通常在银杏叶提取物生产加工过程中需要专门工艺脱除。
银杏酸是6烷基水杨酸或6烯基水杨酸的衍生物,主要由5种酚酸组成[2],它们的差异主要在于烷基上侧链的不同,即侧链R为C13H27、C15H31、C15H29、C17H33和C17H31,即C13:0、C15:0、C15:1、C17:1和C17:2,结构式见图1。
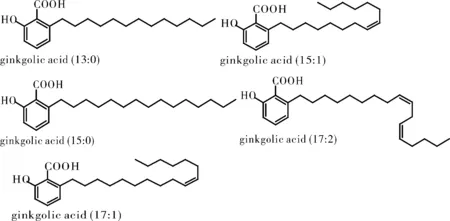
图1 银杏酸的结构Fig.1 The structure of ginkgolic acid
银杏酸具有强烈的杀虫、抑菌、杀菌的作用[3]。近年来发现其具有抗肿瘤、抗病毒、抗炎和抗氧化[4]等多种药理活性,在应用于治疗阿尔茨海默病等神经衰退行性疾病方面的前沿上也具有广阔的前景[5-9]。
1 银杏酸的纯化
1.1 银杏果外种皮来源
银杏外种皮中含有丰富的银杏酚酸类物质。沈凤俊等[10]在研究银杏外种皮中银杏酸对真菌的抑制作用时,从银杏外种皮中提取出银杏酸粗品,通过大孔树脂与硅胶纯化后,经HPLC分析得银杏酸纯度达69.18%。在祝娟娟[11]的研究中发现,通过水洗与硅胶层析结合的方法及NaOH萃取法对银杏酸进行纯化,利用HPLC法进行银杏酸含量的检测,得到水洗法结合硅胶层析法的最优工艺,水洗法可将银杏酸的纯度由33.9%提升到47.82%;硅胶层析法可将水洗后的银杏酸纯度提高至67.5%;NaOH溶液萃取法可将银杏酸醇提液的纯度由33.9%提高到62.3%。
唐仕荣等[12]采用大孔树脂和高速逆流色谱联合法,在以DM130为吸附树脂,75%的乙醇溶液动态解吸条件下,银杏酸的纯度达到40.18%,在采用高速逆流色谱技术进一步纯化后,高效液相色谱分析得到谱峰中的3个主要成分C13:0、C15:1和C17:1的面积比值分别达到了81.5%、95.1%和98.3%,研究前景十分广泛。Heng Zhu等[13]的实验研究中,建立了一种高效配位的高速逆流色谱法从银杏种皮中制备分离银杏酸。通过研究了配位剂的类型、浓度和机理,成功地分离了五种主要银杏酸,包括C13:0、C15:0、C15:1、C17:1和C17:2,纯度均大于98%。因此,采用高速逆流色谱法(HSCCC)分离银杏酸具有消除不可逆吸附、高样品回收率、低成本、低成本,样品变性风险低,制备能力大[14-15]等优点。
1.2 银杏提取物副产物回收
近年来高纯度银杏酸在科研研究、生物农药等领域上的应用日益广泛。安晓东等[16]在大孔树脂脱除银杏叶提取物中银杏酸的工艺研究中,通过对比几种大孔树脂对银杏酸静态吸附能力的强弱,最后确定了大孔树脂HDP5000的吸附效果最好,吸附量达60~70 mg/mL,很好的脱除银杏叶提取物中的银杏酸,为银杏提取物副产物的回收提供了很好的指导作用。徐京[17]在溶剂萃取法脱除银杏酸的工艺研究中,确定了最佳的银杏酸脱除可回收的最佳体系,唐霖[18]在超临界CO2流体萃取脱除银杏叶提取物中银杏酸的工艺中,优化了吴向阳等[19]超临界CO2脱除银杏酸的工艺,结果也确实证明了此方法稳定可行。
2 银杏酸母核的结构修饰
对银杏酸的母核结构进行修饰后,会使得其活性或其他的性能变得更具有可研究性,然而目前国内外还尚无有关银杏酸结构修饰的报道,但银杏酸与槚如酸结构很相似,两者母核都为水杨酸,且差异在于银杏酸的侧链碳原子数主要从13~19,且双键数为0~2个,而槚如酸侧链碳原子数为15,双键数为0~3个,两者的母核结构具有相似性,因此使得槚如酸结构修饰的方法对银杏酸母核的结构修饰具有可借鉴性。结构式见图2。因此本文对与银杏酸同母核结构的槚如酸结构修饰作简要综述,以期对银杏酸的研究提供参考。
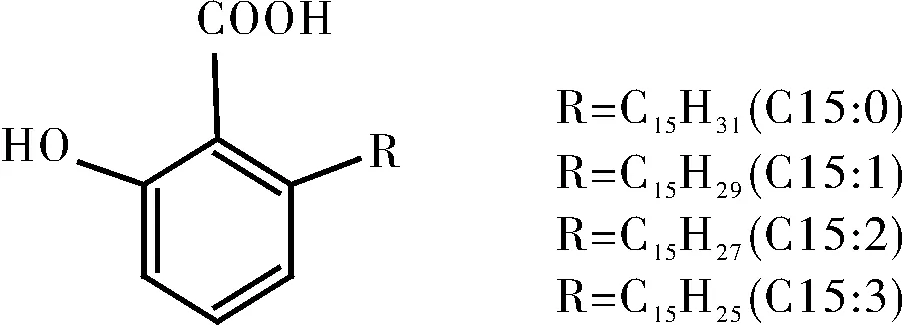
图2 槚如酸的结构Fig.2 Structure of cardanolic acid
2.1 烷基侧链的修饰
与水杨酸相比,槚如酸的抗菌活性可能与侧链烷基的存在有关,因此考虑到烷基侧链的修饰。为清楚了解槚如酸基侧链的结构变化与其活性强弱的关系,Green等[20]合成了一系列槚如酸衍生物,这些衍生物在槚如酸苯环上均含不同的不饱和侧链基团(C-8位有双键)。此外,通过氧化裂解反应,Swamy等[21]将槚如酸上的不饱和侧链转变为醛类化合物,醛基与异烟肼配对得到N-异烟酰基-N’-8-[(2’-羧基-3’-羟基)苯基]辛醛腙,有很好的抗菌活性。见图3。

图3 N-异烟酰基-N’-8-[(2’-羧基-3’-羟基)苯基]辛醛腙Fig.3 N-Isonicotinyl-N’-8-[(2’-carboxyl-3’-hydroxy)phenyl] octylaldehyde hydrazone
2.2 羧基和羟基的修饰
Paramashivappa等[22]以苯环侧链为直链C15H31的槚如酸为原料,通过一系列的反应,最终合成了苯并咪唑/苯并噻吩/苯恶唑的衍生物。如图4所示。为了验证这些衍生物抑制COX-1和COX-2的能力,通过实验,最终了解到化合物6对COX-2的抑制性是对COX-1的384倍,化合物12则高达470倍,有极其明显的选择性抑制作用,有效地缓解且消除了常用NSAIDs类消炎镇痛药的不良反应与症状。

图4 苯并咪唑/苯并噻吩/苯恶唑的衍生物Fig.4 Derivatives of benzimidazole/benzothiophene/benzoxazole
3 银杏酸的活性进展
3.1 抗炎抗菌作用
氧化型低密度脂蛋白(Oxidized low density lipoprotein,ox-LDL)是炎症反应的重要标志物,并且在动脉粥样硬化(Atherosclerosis)的发病机制中起着重要作用。在Juan Zhang、Yan[23]的研究中,观察了银杏酸对ox-LDL诱导的人微血管内皮细胞(HMEC-1)和人外周血单个核细胞(npbmc)抗氧化和抗炎症作用。结果显示,银杏酸处理能提高ox-LDL处理的细胞活力,显著降低细胞内ROS,促炎细胞因子下调等。表明了银杏酸具有抗炎作用。
体外抗菌活性研究结果提示,银杏酸对革兰氏阳性菌(G+)有较强的抑制作用,但对革兰氏阴性菌(G-)并不敏感[24]。对大肠埃希菌、枯草芽孢杆菌和青霉[25]、产紫青霉、沙门柏干酪青霉、黑曲霉均起到抑制的作用,且作用较为明显的是大肠埃希菌、枯草芽孢杆菌、青霉。据文献报道[26],银杏酸抑制细菌、真菌生长效应的药效部位在于C-6位的侧链,并且决定银杏酸抗菌作用强弱的关键在于侧链的长短。抑菌效果最强为C13:0,其次C15:1,下来C15:0,最弱抑菌效果为C17:1,侧链过长过短都起不到良好的抑菌效果。由于银杏酸的化学结构上,含有酚羟基和羧基,此为亲水性基团。但侧链上则村子疏水性基团,因此,侧链上双键的多少,以及侧链的长短,将决定整个分子结构亲酯性/亲水性的强弱。此外,有推测银杏酸分子的亲酯性/亲水性的强弱,与抑菌抗菌作用有关联。
3.2 抑制癌细胞和肿瘤的生长与疾病改善治疗
3.2.1 抑癌作用和抑制肿瘤的生长
在Liang等[27]的研究中发现,银杏酸(GA)在胃癌细胞中诱导生成活性氧ROS的效应十分显著,并抑制Stat3/JAK2通路的激活。此外,GA诱导的细胞凋亡和Stat3/JAK2活性降低很大程度上取决于ROS的产生。在体内,GA显著降低了胃肿瘤的生长。因此,可以认为GA是一种有效的治疗方法,可以防止人胃肿瘤生长。
在Ke Liu,Wang等[28]的研究中发现,使用CCK-8分析以时间和剂量为依赖性的方式评估GA的细胞毒性,发现该化合物具有降低口腔鳞状细胞癌(OSCC)活性的能力。在5 Μm浓度时,用GA处理,发现逆转了转化生长因子b1(TGF-b1)诱导的上皮间质转化细胞(EMT)(10 mg/mL),OSCC细胞系中N-钙粘蛋白和波形纤维蛋白表达的下调及E-钙粘蛋白与a-连环蛋白表达的上调。即GA在5 μM浓度下表现出相当大的抗迁移活性,说明了GA具有低毒性的抗转移活性。此外,10 μM浓度下GA的治疗会导致凋亡细胞的显著积累。
倪学文等[29]研究发现等研究发现宫颈癌Hela细胞可以通过银杏酚酸处理,从而抑制增殖,且持续抑制作用的时间与银杏酚酸药物浓度有关系。当浓度为24 mg/L时,增殖抑制率超过70%。因此,银杏酚酸对抑制肿瘤生长有重要意义,是一种值得深入研究的天然活性抗癌药物。
许素琴和吉民[30]在研究中发现,银杏酸是通过抑制磷脂酰肌醇磷脂酶C(PI-PLC)来阻止肿瘤细胞的增殖,PI-PLC激活后水解肌醇磷脂第三位酯键产生第二信使甘油二酯(DAG)和三磷酸肌醇(IP3),通过激活蛋白激酶C(PKC)对瘤细胞内多种底物蛋白磷酸化和对细胞内Ca2+的影响促进瘤细胞的增殖,因此抑制PI-PLC可以阻止这个进程的发生从而达到抗肿瘤目的。PI-PLC有多种同工酶β1、β2、γ1、γ2、δ1、δ2。其中特别是对γ1亚型的抑制是最能够阻止肿瘤细胞的增生扩散。3种银杏酸单体对PI.PLCγl均存在了抑制作用,其中C17:1毒副作用最小,活性最好。与甲基化银杏酸、乙酰化银杏酸和水杨酸的活性进行对比,并对抑制PI.PLCγl的活性机制进行探讨,最终发现银杏酸的活性,与C-6位不饱和长链与C-2位羟基有重要的关系。C-6位不饱和长链中存在的双键会提高其抗肿瘤活性。且在活性对比下,C17:1最强,C15:1次之C13:0最弱。且不饱和长链的银杏酸C15:1和C17:1(不饱和长链)与含有饱和长链的银杏酸相比较,其具有更小的细胞毒性。此外,存在于银杏酸结构中的酚羟基和羧基,与其抗肿瘤活性的强弱大小存在很大的联系[31]。
以上相关实验研究表明,GA能抑制癌症细胞的增殖、迁移并记过相关酶反应,促使细胞凋亡。因而,银杏酸未来将会会为一种辅助抗癌的药物,用于肿瘤治疗[32]。
3.2.2 疾病改善治疗
Shamini Vijayakumaran与Yasuko Nakamura等[33]以SH-SY5Y神经母细胞瘤细胞和大鼠原代皮层神经元为研究对象。细胞经GA或相关化合物(抗坏血酸)预处理后,α-syn和SUMO-1免疫阳性的胞浆内聚集物明显减少,两种化合物也检测到自噬体的频率增加。去极化后24 h的GA处理也显著减少了α-syn聚集体承载细胞,表明了预先形成的聚集体的清除。自噬抑制剂阻断了α-syn聚集体对GA依赖性清除,但不增加自噬体频率。Western分析表明,GA预处理后α-syn聚合频率的降低并没有伴随SUMO共轭物丰度的显著变化。所以,在目前的研究结果中可以表明,GA能促进α-syn聚集体的自噬依赖性清除,并且,还可能在疾病修饰治疗中具有很大的潜力。
3.3 杀灭钉螺作用
Kubo等[34]发现类似银杏酸的结构的漆酚酸组分具有一定的杀螺活性。毛佐华等[35]证实了银杏酸单体C13:0、C15:0、C15:1、C17:1和C17:2具有灭杀钉螺的能力。受其侧链碳原子数量及双键数目的影响,杀灭钉螺的作用也因而不同,它们活性强弱顺序为:C13:0>C15:1>C15:0>C17:1>C17:2。
进一步的实验研究表明[36],为了查明具有最佳灭螺活性的碳链长度的银杏酸在酰胺化后活性的变化规律,因此分别合成侧链为C-9、C-11和C-13的烷基水杨酸。由于酰胺化在合成中反应的产率太低,因此没有进行更深入的灭螺活性研究。实验表明,C-9表现出较强的灭螺活性,因此在C-9~C-13范围内,烷烃侧链长短与灭螺活性成反比。实验结果为进一步进行结构改造、研发高效低毒的新型的杀螺剂奠定了基础。
3.4 其它活性作用
根据多项研究表明,银杏酸具有多种效用,例如抑制真菌细菌的生长、存在抗肿瘤作用、与青霉素协同作用对耐青霉素金葡菌株有很好的抑制作用[37]、增白皮肤的效果。此外,银杏酸对临床耐青霉素金葡菌株有抑制作用[38]、由于具有杀灭钉螺作用,因而能防治血吸虫病,并在其灭螺浓度范围内对鱼没有毒性[39]。
4 结 语
银杏酸存在于诸多显著的优势,因此在银杏酸的深入研究、开发、应用上均具有广袤的前景。银杏酸绝大部分来源于银杏外种皮,并且是结构上各不相同的一系列混合物,这些混合物的各单体极性相差很小,因而在分离、纯化上存在了问题,银杏酸也因此不适合工业上规模化大批量生产。随着对银杏酸的研究日益加深,现在主要通过高压制备色谱、高速逆流色谱等新的技术进行纯化制取。银杏酸具有许多显著的药理作用,在抗菌消炎、抗氧化、抗肿瘤癌症以及心脑血管方面都有很强的药理作用。所以,银杏酸进一步的研究开发,提供成熟的、完整的、适合大规模工业化生产的路线,提供大量银杏酸单体,并继续在药理作用、构效关系等多种活性机制上进行深入探讨与研究,具有重要的意义,是今后这一领域的重要课题。

