中考化学表格信息的分类
章小锋

一、与化学反应有关的表格数据
表格数据中减量为反应物的质量,增量为生成物的质量,不变量可能为催化剂。容易误解为反应前质量为反应物的,或反应后质量为生成物的,不论反应物还是生成物的质量都应该是表格数据的前后变化量。还应注意变化量的含义。
例题1 (2023年无锡)柠檬酸( C6H8O7)能与碳酸氢钠反应生成二氧化碳。向4份等质量、等浓度的柠檬酸溶液中分别加入一定质量的碳酸氢钠,充分反应,4次实验数据记录见表1。
则实验④中参加反应的碳酸氢钠的质量为( )。
A.0.84g B.1.26g C.1.68g D.2. 10g
解析根据表格信息可知,每次实验加入柠檬酸的质量均为0. 96g,加入的碳酸氢钠质量不同,产生的二氧化碳体积不同,根据二氧化碳的体积可以确定加入的碳酸氢钠的质量。
①中柠檬酸质量为0. 96g,加入碳酸氢钠的质量为m=0.42g,产生二氧化碳体积为112 mL,②中柠檬酸的质量为0. 96g,加入碳酸氢钠的质量为m,g,产生二氧化碳的体积为224 mL,是①中产生二氧化碳的体积的2倍,此时m1= 2m=0.42 9×2 =0. 84g;③中柠檬酸的质量为0.96g,加入碳酸氢钠的质量为m2g,产生二氧化碳的体积为336 mL,此时m2=3m =0.42g×3=1.26g;④柠檬酸的质量为0. 96g,加入碳酸氢钠的质量为m3g,产生二氧化碳的体积也为336 mL,说明加入碳酸氢钠的质量为m2g时,柠檬酸已经反应完全,所以說实验④中参加反应的碳酸氢钠的质量为1.26g。
答案:B。
二、与纯量、过量计算有关的表格数据
与纯量、过量计算有关的表是化学反应中化学方程式所反映的是纯净物参加反应的质量关系,若参加反应有不纯物,须将其换算成纯净量。
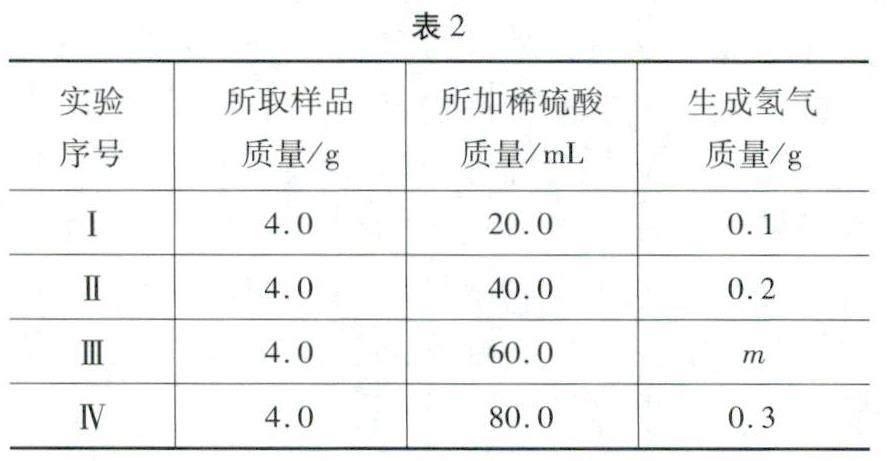
例题2 (2023年娄底)实验室有一包部分变质的镁带,某校兴趣小组同学为分析镁带中镁的质量分数,进行如下探究:
用镁带样品与稀硫酸反应,测定生成氢气质量。实验数据见表2。
(1)表格中m=____。
(2)求这包部分变质的镁带中镁的质量分数。(请写出计算过程)
解析 (1)由表中数据可知,每20.0 mL稀硫酸完全反应生成氢气的质量为0.1g,实验Ⅲ,60.0 mL稀硫酸完全反应生成氢气的质量为0.1g×3 =0.3g,实验Ⅳ,80. 00 mL稀硫酸,生成氢气的质量为0.3g,说明硫酸已过量,所以m=0.3。
(2)设镁带中镁的质量分数为x。
Mg+ H2SO4 =MgSO4+ H2↓
24 2
4. 0xg 0.3g
24:2 =4. 0xg:0.3g
解得x= 90%
答案:(1)0.3;(2)90%。
三、与溶解度相关的表格信息
溶解度相关表格用于溶解性大小的判断以及温度变化所带来的不同物质溶解度的变化情况等。
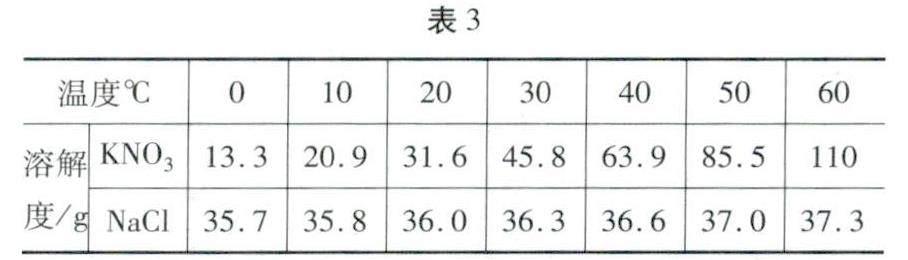
例题3 (2023年襄阳)表3是KNO3和NaCl在不同温度时的溶解度,据表回答问题。
(1) KNO3和NaCl的溶解度随温度升高而____(填“增大”或“减小”)。
(2)20℃时,各取KNO3、NaCl固体3.5g分别加入10g水中,充分溶解后达到饱和状态的是____溶液。
(3)下列说法正确的是____(填序号)。
A.从表中数据可以判断KNO3和NaCl的溶解度相等的温度在20 -30℃
B.KNO3的饱和溶液一定不能再溶解KNO,固体
C.40C时,KNO3溶液的溶质质量分数一定比NaCl溶液的溶质质量分数大
D.若要从KNO3的饱和溶液中获得KNO3晶体,可采用冷却热饱和溶液的方法
解析 (1)由KNO3和NaCl在不同温度时的溶解度数据,KNO3和NaCl的溶解度随温度升高而增大。(2)20℃时,KNO3、NaCl的溶解度分别为31.6g、36.0g,20℃时,各取KNO3、NaCl固体3.5g分别加入10g水中,分别最多能溶解3. 16g、3.6g,充分溶解后达到饱和状态的是KNO3。(3)A.20℃时氯化钠的溶解度大于硝酸钾,30℃时氯化钠的溶解度小于硝酸钾,则KNO3和NaCl的溶解度相等的温度在20-30℃,故A选项说法正确。B.KNO3的饱和溶液也可能再溶解KNO3固体,若升高了温度,硝酸钾的溶解度增大,KNO3的饱和溶液还能再溶解KNO3固体,故B选项说法错误。C.选项说法没有说明溶液是否饱和,则40℃时,KNO3溶液的溶质质量分数不一定比NaCl溶液的溶质质量分数大,故C选项说法错误。D.KNO3和NaCl的溶解度受温度的影响不同,硝酸钾的溶解度受温度影响较大,而氯化钠受温度影响较小,若要从KNO3的饱和溶液中获得KNO3晶体,可采用冷却热饱和溶液的方法,即D选项说法正确。
答案:(1)增大;(2) KNO3;(3)AD。
(收稿日期:2023-10-10)
——饱和溶液与不饱和溶液

