颅脑损伤病人术后继发多重耐药菌肺部感染风险Nomogram模型构建与验证
李晓捷,王宏勤

摘要目的:分析颅脑损伤(TBI)病人接受开颅手术后继发多重耐药菌(MDRO)肺部感染的危险因素。基于筛选出的独立危险因素构建Nomogram模型并进行验证。方法:回顾性分析2020年9月-2022年9月某院神经外科收治的符合入组标准的287例TBI病人的临床资料,作为建模组,分别使用单因素分析及多因素LASSO Logistic回归筛选出TBI病人MDRO肺部感染的独立危险因素,然后根据独立危险因素开发TBI病人接受开颅手术后继发MDRO肺部感染的Nomogram预测模型。选取2020年1月-2020年8月同一所医院符合入组标准的73例接受开颅手术的TBI病人的临床资料作为验证组,对Nomogram模型进行验证。结果:建模组287例TBI术后病人中继发MDRO肺部感染123例,感染率42.86%,非MDRO感染164例。LASSO Logistic回归显示,术前格拉斯哥昏迷评分(GCS)≤8分[OR=3.428,95%CI(1.666,7.196)]、瞳孔散大[OR=2.701,95%CI(1.250,6.012)]、抗生素联合使用[OR=3.874,95%CI(1.961,7.827)]、神经重症监护室(NICU)住院时间≥7 d[OR=4.851,95%CI(1.996,12.195)]是TBI病人接受开颅手术后继发肺部感染MDRO的独立危险因素,根据筛选出的独立危险因素进行Nomogram模型的构建。将验证组的临床数据放入Nomogram模型中进行验证,验证结果显示:建模组与验证组的受试者工作特征曲线(ROC)下面积(AUC)分别为0.897与0.925。采用Hosmer-Lemeshow检验对Nomogram模型进行拟合优度检验,检验结果为P=0.440 1,表明该预测模型与真实结果差异无统计学意义。建模组及验证组的决策分析曲线均表明该模型有较高的临床获益性。结论:基于LASSO Logistic 回归分析开发的Nomogram模型具有较高的预测能力,有利于早期识别有继发MDRO肺部感染风险的TBI术后病人。医护人员应加强对病人的监测,必要时调整用药策略,预防MDRO肺部感染的发生。
关键词颅脑损伤;多重耐药菌;肺部感染;LASSO Logistic回归;列线图
doi:10.12102/j.issn.1672-1349.2024.08.034
颅脑损伤(traumatic brain injury,TBI)占全身部位损伤的20%左右,而且其死亡率和致残率居身体各部位损伤最高[1]。多项动物和临床研究提供了创伤后全身免疫抑制的证据,涉及中枢神经系统(CNS)的损伤可能更容易发生,导致神经创伤后住院感染的风险更高[2-3]。据报道,对于重症TBI病人,医院感染的风险高达50%,二次感染病人的死亡率高达37%[4-5]。TBI病人通常合并细胞免疫系统的损伤和意识障碍,容易导致病原菌在呼吸道繁殖。若病原菌为多重耐药菌(multi-drug resistant organism,MDRO),归因病死率可高达38.9%~60.0%[6]。MDRO指对通常敏感的常用≥3类抗菌药物同时呈现耐药的细菌[7]。MDRO造成的肺部感染会导致病人机械通气时间、重症监护室(ICU)入住时间、住院总体时间的延长,住院费用增加[8]。感染MDRO的风险因素的识别可使临床工作人员能够对高风险TBI病人进行密切的感染监测和及时的护理。本研究分析TBI病人术后继发MDRO肺部感染的独立危险因素,根据筛选出的独立危险因素构建预测模型,帮助临床工作者早期识别有MDRO感染风险的病人。
1资料与方法
1.1研究对象
选取2020年9月—2022年9月某院神经外科收治的287例TBI开颅手术后继发肺部感染的病人为研究对象,作为建模组。病人受伤后24 h内入院,入院后24 h内接受手术治疗,术后均进入神经重症监护病房(neurological intensive care unit, NICU)。对于多次发生MDRO肺部感染的病人,本研究只分析首次感染,将287例TBI开颅手术后继发肺部感染的123例病人为病例组,164例未发生肺部感染的病人为对照组。另选取2020年1月—2020年8月于同一所医院神经外科收治的73例TBI接受开颅手术后继发肺部感染的病人作为验证组。本研究得到了医院伦理委员会的批准。
1.2纳入与排除标准
1.2.1纳入标准
1)TBI病人受伤后24 h内入院,住院时间≥48 h;2)入院后24 h内接受手术治疗;3)入院48 h之后发生MDRO肺部感染;4)病人或者其家属签署知情同意书;5)临床资料完整。
1.2.2排除标准
1)入院前3 d有抗菌药物或抗病毒治疗史的病人;2)患有肺部基礎疾病,如慢性阻塞性肺疾病、支气管扩张症等;3)入院后死亡或放弃治疗自动离院的病人;4)临床资料不完善的病人。
1.3肺部感染诊断标准
胸部CT检查提示肺部有新的浸润影出现或者胸部CT提示浸润影较前进展,并且至少同时存在下述2种表现:体温超过38 ℃、呼吸道有脓性分泌物、白细胞计数增多或减少[9]。
1.4调查方法
通过医院病历系统调查符合标准的病人临床资料,1)年龄、性别、头颅及胸部CT、是否合并高血压及糖尿病;2)吸烟史、术前格拉斯哥昏迷评分(GCS)、术前瞳孔大小、手术时间、住院时长、入院时血清清蛋白检测值;3)激素使用情况、抗菌药物使用情况;4)昏迷的时间、气管插管情况、气管切开情况、机械通气情况、留置胃管情况、中心静脉置管情况、NICU入住时间。分析病人痰标本或肺泡灌洗液标本的病原菌分布情况。
1.5统计学处理
采用回顾性研究的方法,使用SPSS 23.0软件及R4.2.2软件进行统计学分析。单因素分析使用SPSS 23.0进行χ2 检验,以P<0.05为差异有统计学意义。使用R软件中的glmnet包将有统计学意义的因素纳入多因素二分类LASSO Logistic回归分析。筛选出TBI病人术后继发MDRO肺部感染的独立危险因素;将筛选出的独立危险因素导入R软件进行分析,使用R软件中的“rms”包建立MDRO感染发生的Nomogram预测模型和校准图。通过判别和校准来评估Nomogram预测模型的性能。采用Hosmer-Lemeshow方法对Nomogram风险模型进行拟合优度检验,模型的判别能力由受试者工作特征曲线(ROC)下面积(AUC)确定[10]。通过比较MDRO感染发生的预测概率和实际概率的视觉校准图来执行预测模型的校准。此外,对列线图进行了1 000次Bootstrap重复采样,进行验证,以评估其预测准确性。绘制DCA曲线用于评估列线图的获益性和临床实用性[11]。
2结果
2.1MDRO肺部感染、病原菌分布情况
287例TBI开颅手术后继发肺部感染的病人中,有123例发生MDRO肺部感染, MDRO感染发生率为42.86%,非MDRO感染164例。其中MDRO单株感染115例,双株感染8例,共分离MDRO 131株,其中鲍曼不动杆菌87株(66.4%),銅绿假单胞菌19株(14.5%),肺炎克雷伯菌7株(5.3%),大肠埃希菌6株(4.6%),耐甲氧西林金黄色葡萄球菌6株(4.6%),阴沟肠杆菌2株(1.5%),肺炎链球菌2株(1.5%),按蚊伊丽莎白金菌1株(0.8%),霍氏肠杆菌1株(0.8%)。
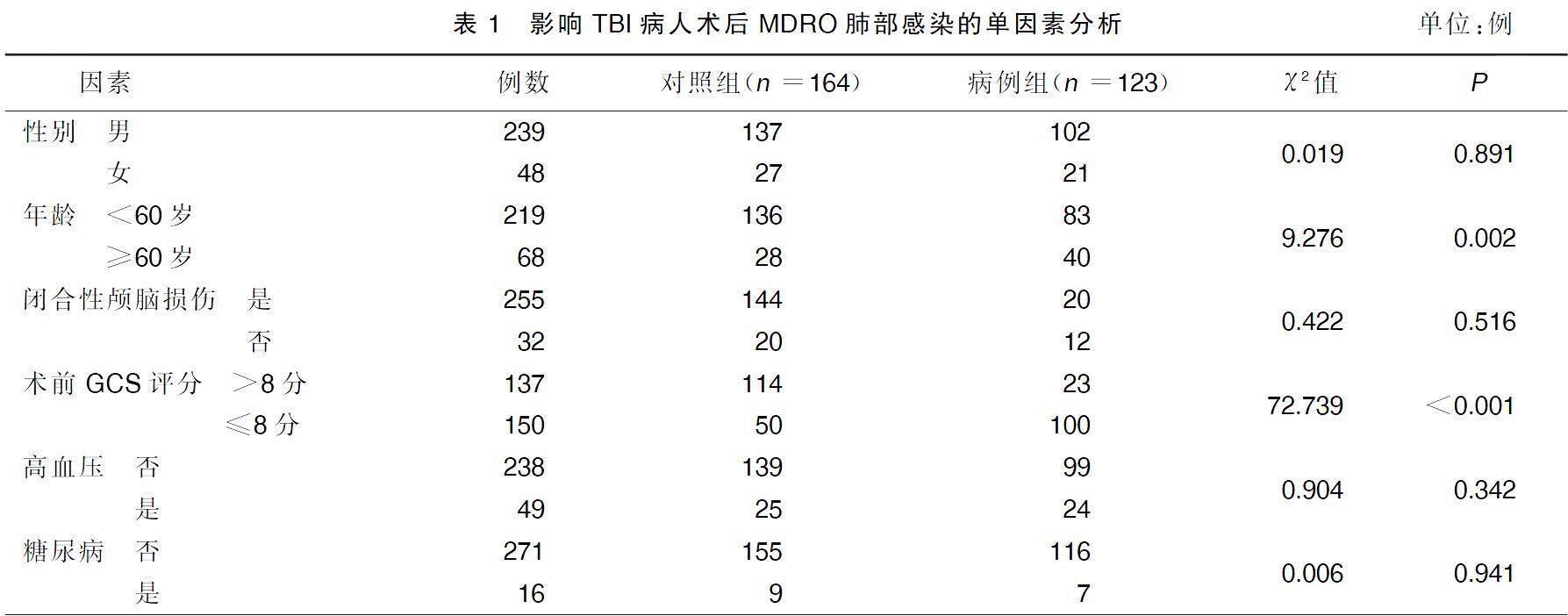
2.2影响TBI病人术后继发MDRO肺部感染的单因素分析
单因素分析结果显示,年龄≥60岁、术前GCS评分≤8分、昏迷时间≥24 h、瞳孔散大、使用抗菌药物时间≥7 d、抗菌药物联合使用、气管插管、气管切开、呼吸机辅助呼吸≥7 d、手术时长≥3 h、中心静脉置管、NICU住院时间≥7 d,对TBI病人术后继发MDRI局部感染有影响(P<0.05)。详见表1。
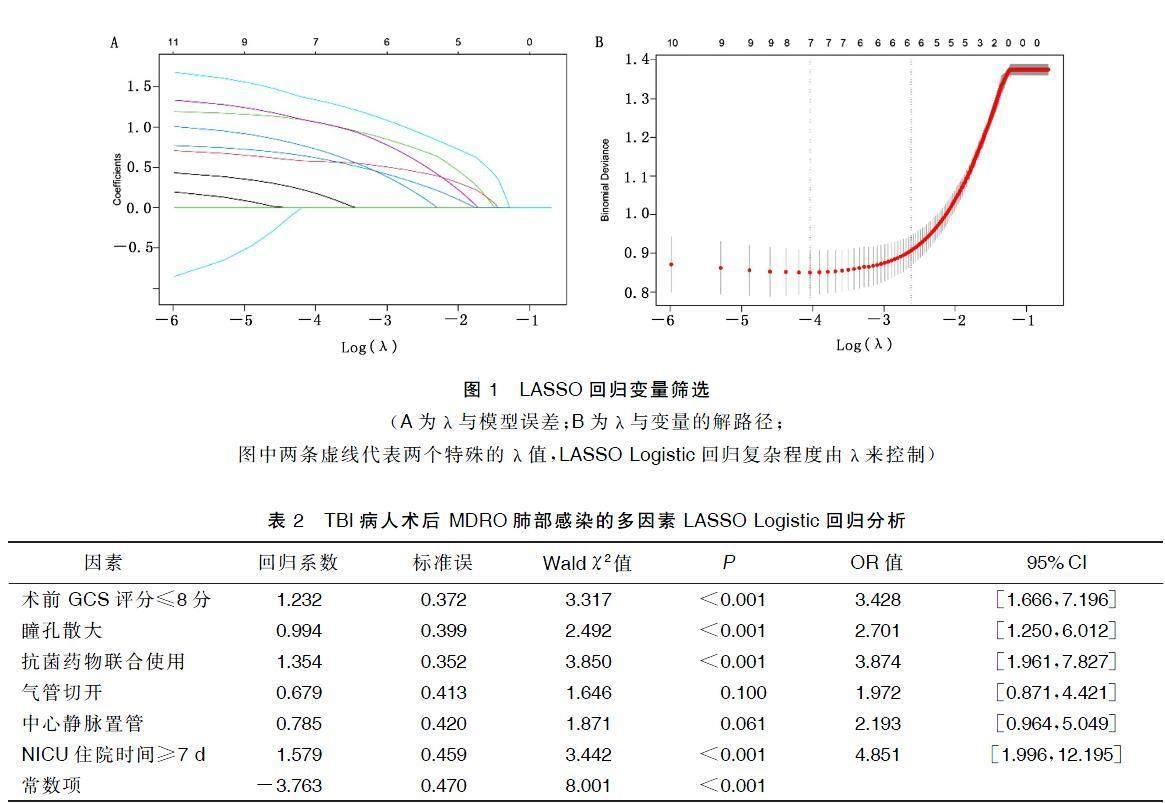
2.3多因素LASSO Logistic回归分析
根据单因素分析有意义的指标建立LASSO Logistic回归,通过交叉验证确定最优λ值(见图1),即lambda.min和lambda.lse,lambda.min是指所有λ值中有最小目标参量均值的λ值,lambda.lse是指在 lambda.min 的一个方差范围之内的可以得到的预测性能最好而且自变量最少的模型的λ值。本研究中,lambda.lse为0.072 864 32。λ值越大,线性模型的惩罚力度也越大,Nomogram模型中自变量会减少,模型选择主变量的能力会增强,从而获得一个变量较少的模型[12]。详见图1。
将单因素分析中差异有统计学意义的因素作为自变量,将TBI病人术后是否发生MDRO肺部感染作为因变量进行LASSO Logistic回归分析。LASSO Logistic回归可以从一组庞大且潜在的多重共线变量中进行主动选择,从而产生一组更相关、更可解释的预测因子。LASSO Logistic回归通过连续性收缩,最小化回归系数,降低过拟合的可能性。LASSO Logistic回归分析的结果显示,术前GCS评分≤8分、瞳孔散大、抗菌药物联合使用、NICU住院时间≥7 d是TBI病人术后继发MDRO肺部感染的独立危险因素(均P<0.05)。详见表2。
2.4MDRO肺部感染的Nomogram模型构建
将LASSO Logistic 回归分析筛选出的独立危险因素进行可视化处理,构建Nomogram风险模型,详见图2。每个独立危险因素对应一个特定的评分,直线向上画到Points轴,然后将独立危险因素的单项得分相加计算总分,对应感染概率轴,可以得到TBI病人术后继发MDRO肺部感染发生的概率。
2.5Nomogram模型的验证
使用Hosmer-Lemeshow方法对构建的Nomogram风险预测模型进行拟合优度检验,检验结果为P=0.440 1,表明该Nomogram预测模型具有较高的校准度。校准曲线显示本研究的Nomogram预测模型一致性尚可。详见图3。建模组和验证组的AUC值分别为0.897[95%CI(0.862,0.931)]与0.925[95%CI(0.863,0.986)],显示出该Nomogram模型具有较高的预测性能。详见图4。建模组及验证组的决策分析曲线(DCA)均表明该模型有较高的临床获益性。详见图5。
3讨论
3.1造成TBI病人术后MDRO肺部感染的病原菌
本研究显示,TBI术后导致MDRO肺部感染的病原菌以革兰阴性菌为主(93.9%),因此,如果没有得到病原体的药物敏感试验结果,在经验性使用抗生素时考虑针对革兰阴性菌。本研究中鲍曼不动杆菌是最主要的病原菌(66.4%),鲍曼不动杆菌在各种环境下具有多种生存机制,增强了医院传播的能力[13]。其耐药机制主要与产生碳青霉烯酶、外膜孔蛋白及外排泵等相关[14]。鲍曼不动杆菌引起的呼吸机相关性肺炎(VAP)仍然是危重病人高死亡率的主要原因[15]。其最常见的定植部位是呼吸道,其次是皮肤定植[16]。鲍曼不动杆菌有3种基本的特性,以适应当前的医疗环境:1)能够定植皮肤、黏膜和设备,并在医院环境中生存;2)表达多种毒力特征;3)通过抗菌药物的酶修饰、靶基因突变、外膜通透性改变和上调多药外排泵等,对抗菌药物产生广泛耐药性。目前,还需要进一步对这种细菌进行研究,未来有望通过新的研究方向更好地了解其机制。
3.2TBI病人术后MDRO肺部感染的危险因素
LASSO Logistic回归避免了各变量之间的多重共线性,本研究通过LASSO Logistic筛选出4项独立危险因素。术前GCS评分≤8分是重型TBI的诊断标准之一,瞳孔散大往往表示病人已经发生脑疝,提示病人死亡率高、预后差、意识障碍重,术前GCS评分低,容易导致呼吸道内的痰液堆积、吞咽困难甚至误吸,此时细菌更容易侵入肺部,引发感染[17]。本研究中抗菌药物联用是发生MRDO感染的独立危险因素,与国内相关报道大致相同[18],但是,也有报道称舒巴坦+美罗培南或舒巴坦+亚胺培南两种联合方案在体外对部分鲍曼不动杆菌产生协同抗菌效应[19],因此,对于临床上MDRO造成的感染,考虑某些抗菌药物的联合使用,完善用药策略,值得进一步的研究;NICU是密闭式病房,是多重耐药菌产生的重灾区,其收治的病人大多为病危、病重的病人,这些病人免疫功能低下,甚至需要面对气管插管、气管切开、腰椎穿刺术、机械通气等侵入性操作,这些操作可破坏人体正常的生理保护屏障,导致病原菌更容易繁殖[20],因此,对于入住NICU的病人,医务工作者应该监测病人的病情变化并及时评估,符合转出NICU标准的病人应及时转入普通病房继续治疗。
3.3本研究的局限性
本研究构建的Nomogram模型表现出较高的预测价值。然而,还存在一些局限性,首先,本研究是单中心研究,样本量相对不足,需要更大样本量、多中心的研究进一步验证模型;其次,出院后发生肺部感染的病人未被纳入研究,限制模型的推广性;最后,本研究为回顾性研究,可能会导致选择偏差。
综上所述,术前GCS评分≤8分、瞳孔散大、抗菌药物联合使用、NICU住院时间≥7 d是TBI病人術后继发MDRO肺部感染的独立危险因素,根据独立危险因素开发的Nomogram模型可以预测TBI病人术后继发MDRO肺部感染的发生,帮助医护人员早期识别高风险病人,必要时采取措施降低MDRO感染的发生率。
参考文献:
[1]刘兆玮,马科,胡景玉,等.892例重症颅脑损伤患者术后继发肺部感染的病原菌分布及危险因素分析[J].中国现代应用药学,2019,36(24):3072-3075.
[2]ALHARFI I M,CHARYK STEWART T,AL HELALI I,et al.Infection rates,fevers,and associated factors in pediatric severe traumatic brain injury[J].J Neurotrauma,2014,31(5):452-458.
[3]BERROUANE Y,DAUDENTHUN I,RIEGEL B,et al.Early onset pneumonia in neurosurgical intensive care unit patients[J].J Hosp Infect,1998,40(4):275-280.
[4]CARDOZO JNIOR L C,SILVA R R.Sepsis in intensive care unit patients with traumatic brain injury:factors associated with higher mortality[J].Rev Bras Ter Intensiva,2014,26(2):148-154.
[5]DZIEDZIC T,SLOWIK A,SZCZUDLIK A.Nosocomial infections and immunity:lesson from brain-injured patients[J].Crit Care,2004,8(4):266-270.
[6]KALIL A C,METERSKY M L,KLOMPAS M,et al.Executive summary:management of adults with hospital-acquired and ventilator-associated pneumonia:2016 clinical practice guidelines by the Infectious Diseases Society of America and the American Thoracic Society[J].Clinical Infectious Diseases,2016,63(5):575-582.
[7]黄勋,邓子德,倪语星,等.多重耐药菌医院感染预防与控制中国专家共识[J].中国感染控制杂志,2015,14(1):1-9.
[8]LI Y,LIU C,XIAO W,SONG T,et al.Incidence,risk factors,and outcomes of ventilator-associated pneumonia in traumatic brain injury:a meta-analysis[J].Neurocrit Care,2020,32(1):272-285.
[9]中华医学会呼吸病学分会感染学组.中国成人医院获得性肺炎与呼吸机相关性肺炎诊断和治疗指南(2018年版)[J].中华结核和呼吸杂志,2018,41(4):255-280.
[10]曾湖,徐立新,陈华,等.动脉瘤性蛛网膜下腔出血患者围手术期内并发医院感染风险列线图模型的构建与验证[J].中国脑血管病杂志,2021,18(10):679-688;723.
[11]VICKERS A J,HOLLAND F.Decision curve analysis to evaluate the clinical benefit of prediction models[J].The Spine Journal:Official Journal,2021,21(10):1643-1648
[12]郭磊磊,秦红英,张尚书,等.骨科创伤患者术后多重耐药菌感染风险Nomogram模型构建与验证[J].中国感染控制杂志,2022,21(6):584-591.
[13]PELEG A Y,SEIFERT H,PATERSON D L.Acinetobacter baumannii:emergence of a successful pathogen[J].Clinical Microbiology Reviews,2008,21(3):538-582.
[14]姚丹玲,朱卫民.耐碳青霉烯鲍曼不动杆菌耐药机制研究进展[J].国外医药(抗生素分册),2020,41(1):11-16.
[15]JARURATANASIRIKUL S,NITCHOT W,WONGPOOWARAK W,et al.Population pharmacokinetics and Monte Carlo simulations of sulbactam to optimize dosage regimens in patients with ventilator-associated pneumonia caused by Acinetobacter baumannii[J].Eur J Pharm Sci,2019,136:104940.
[16]KANAFANI Z A,ZAHREDDINE N,TAYYAR R,et al.Multi-drug resistant Acinetobacter species:a seven-year experience from a tertiary care center in Lebanon[J].Antimicrob Resist Infect Control,2018,7:9.
[17]杨睿,陈腾飞,李占江.重型颅脑损伤患者肺部感染特点、吸烟史、机械通气及基础疾病等影响分析[J].中国卫生检验杂志,2023,33(3):357-360.
[18]程晓增,万大海.神经外科肺炎患者多重耐药菌感染病原学及危险因素分析[J].中国抗生素杂志,2021,46(6):604-610.
[19]王博,磨国鑫,周光,等.鲍曼不动杆菌产碳青霉烯酶对舒巴坦联合碳青霉烯抗生素协同作用的影响[J].解放军医学院学报,2021,42(4):438-443;450.
[20]陈国建,杨洁,邓艾,等.某综合医院常见多重耐药菌感染危险因素logistic回归分析[J].华西医学,2020,35(3):290-295.
(收稿日期:2023-03-20)
(本文编辑王雅洁)

