模拟古代火法炼铜的实验探究和教学
方昊成

摘要: 为提升学生实验探究和解决实际问题的能力,设计以古代火法炼铜为情境,通过文献资料与木炭还原氧化铜实验作对比,引导学生进行实验设计并用于实践。在第一次实验后,引导学生分析实验原理,并作进一步改进,成功完成模拟古代铜的冶炼的第二次实验。通过实验探究和教学,助力学生自主形成“碳与碳的氧化物”的知识网络,提升综合问题的解决能力,发展学科核心素养。
关键词: 模拟火法炼铜; 实验探究; 核心素养
文章编号: 1005-6629(2024)02-0058-04
中图分类号: G633.8
文献标识码: B
在学习初中化学“碳和碳的氧化物”内容的过程中,碳与一氧化碳的可燃性和还原性知识是分开叙述相互独立的,但在真实情境中它们又是相互交织在一起。不少教师提倡的主题式、项目式学习,都偏向于以二氧化碳的性质为核心进行学习和复习,这样便缺失了“碳三角”的重要转化关系,对知识网络的建构不利。新课标强调要以核心素养为导向进行化学教学活动,在真实情境中基于实验事实去解决问题。中国古代铜的冶炼情境既是一个真实情境,也与碳和碳的氧化物教学内容紧密相关。教学设计可以尽量从药品到装置靠近古代炼铜的模拟实验为核心,在真实情境中去解决真实问题。在教学过程中,学生通过两次实验——一次尝试和一次改进,真正形成知识网络结构,提升对复杂问题的解析能力、设计实验的思维水平和实际问题的解决能力,落实化学学科核心素养。
1 实验原理和实验设计思路
不同于课堂上做的“木炭还原氧化铜”实验,在建构真实情境时要从古代史实和文献入手设计实验,并分析其实验原理。
1.1 根据文献进行设计和调整
1.1.1 还原剂的选择:用煤炭代替木炭
课本上的实验通常使用木炭还原氧化铜。中国在西汉时就已经正式用煤冶炼金属[1,2],木炭由于大量消耗森林资源逐渐被淘汰。有诗云:“地下神奇钟石炭,人间货利设煤窑。开山作穴如穿井,引火成炊不采樵”。诗中“石炭”就是煤或煤炭,写的是有了煤炭之后,樵夫就不用砍树烧炭了。因此古代冶炼金属一般用煤炭而不是木炭。且从课下的实验效果来看:煤炭>活性炭=木炭>>纯碳(石墨)。这是因为煤炭在密闭无氧的条件下干馏能够产生许多还原性气体,因而本实验选择更加真实的煤炭粉末代替木炭粉末。
1.1.2 配料比的选择:使用过量的炭
倪慎枢《采铜炼铜记》记载“……用炭八九千斤,不过得铜五六百斤”,计算所使用的炭与氧化铜的质量比,发现炭的物质的量大于氧化铜。一部分原因是因为真实炼铜的过程中需要消耗氧气,碳与氧气发生反应产生热量。学生在第一次模拟实验中使用的是煤炭粉(以单质碳计)与氧化铜物质的量之比为1∶2(质量比1∶13.3)的配料比,实验效果不理想。在增加炭粉的用量后,第二次实验结果大大改善。庄晓松和王祖浩[3]也认为C与CuO的物质的量之比为1∶1.59(质量比1∶10.6)时实验效果最好,也大于理论上的1∶2。因此在设计实验时应该让碳过量,以产生充分的还原气氛。
1.1.3 辅料的选择:碳酸钾的使用
陆容《菽园杂记》记载“……炭七百担,柴一千七百段,雇工八百余。用柴炭装叠烧两次,共六日六夜”,洪咨夔《大冶赋》记载“炭周绕,薪环附。若望而燎,若城而炬”。可以得知,古代炼铜过程中都使用了薪柴。薪柴的作用有三:一是燃烧产生热量;二是燃烧产生的碳酸钾,是碳还原二氧化碳的催化剂[4];三是碳酸钾还是工业炼铜的助熔剂,因此在实验过程中还需要加入一定比例的碳酸钾。
1.1.4 装置的选择:石英坩埚的使用
倪慎枢《采铜炼铜记》记载“其炉长方高耸,外实中空,下宽上窄,高一丈五尺,宽九尺,底深二尺有奇。前为火门,架炭入矿之路也……”。图1为根据考古和文献复原的竖炉炼铜装置[5],因此实验中用石英坩埚代替试管进行模拟实验。相比于瓷质坩埚,石英坩埚是透明的,便于学生观察实验现象。
1.2 实验原理分析
综上所述,模拟古代炼铜的主要化学反应及原理有:
① C+2CuO高温2Cu+CO2↑
② C+CO2碳酸钾高温2CO
③ CO+CuO△Cu+CO2
④ 其他诸如碳的完全燃烧、碳的不完全燃烧、一氧化碳的燃烧等。
⑤ 煤炭干馏得到焦炭、煤焦油、一氧化碳、氢气以及还原产物等。
2 教学过程
2.1 情境引入,提出问题
通过呈现青铜器、铜钱等图片,引发学生对中国古代炼铜的兴趣,随后提出本课的问题——古代炼铜的原理是什么?后面围绕这一问题开展分析、设计、实验、改进、再实验、再分析、总结等一系列问题解决的基本教学流程。
2.2 通过比较,设计模拟实验
(1) 首先呈现《采铜炼铜记》、《菽园杂记》、《大冶赋》、图1的复原图等文献的部分内容,学生将此与学习过的木炭还原氧化铜进行对比,找出其中的异同点。比如,①装置不同;②加入的原料中除了铜矿石、炭之外,还加入了薪柴,薪柴燃烧形成草木灰,即碳酸钾;③更广泛地使用煤炭而不是木炭;④文献中的“装叠”表示原料并不是粉末状的,而课堂实验需要研磨成粉末并充分混合,两者接触面积不同。
(2) 根据②和③初步结论:古代火法炼铜所使用的原料是煤炭、铜矿石(以氧化铜计)、碳酸钾。
(3) 根据①进行问题引导:什么样的化学实验室仪器能够尽可能模拟竖炉法炼铜的装置?此处可以给出一些常见的化学实验仪器供学生对比参考,如蒸发皿、烧杯、坩埚等。从装置复原图的相似性出發,学生会选择坩埚作为实验容器。
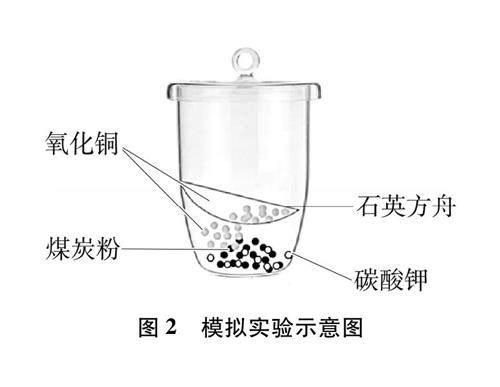
(4) 根据④进行问题引导:矿石是块状的,肯定有矿石内部的氧化铜接触不到炭。实验室的原料是粉末状的,在模拟实验中如何体现一部分氧化铜与炭粉接触,还有一部分氧化铜不与炭粉接触?学生可能会想到要将一部分氧化铜与炭粉分开的设计,经过教师参与改进,最终呈现图2的实验装置。利用一个石英方舟分隔出一部分氧化铜,模拟矿石内部的以及没有与炭充分接触的氧化铜。
(5) 为了使氧化铜能被充分还原,学生根据书写的炭与氧化铜的化学方程式,计算得到炭与氧化铜的质量比为12∶160,即1∶13.3。根据这个质量比在坩埚中投入原料,用酒精喷灯或本生灯进行灼烧,进行第一次实验(在实验前需要做好安全教育,以防烫伤)。煅烧过程中可能有少量有害气体逸出,需要做好教室通风,甚至可在有通风设备的实验室中进行。实验过程中有少量的黄烟产生,大约三分钟后停止煅烧,学生可藉透明的石英坩埚观察到坩埚底部的固体有少量变红,而石英方舟上的氧化铜没有变红。
2.3 通过改进,设计对比实验
第一次实验的结果说明反应没能充分进行,石英坩埚底部的氧化铜只有部分被还原,使学生产生疑问,并萌发继续探究的兴趣。
(1) 从文献“用炭八九千斤(古代1斤是600g,取4800kg),不过得铜五六百斤(取320kg)”。数据的给予不脱离事实,又最大程度方便学生计算。利用铜元素守恒的思想,学生进行计算所使用的炭与氧化铜的质量比为12∶1,其物质的量之比远大于理论值。
(2) 根据计算结果,引导学生思考:多余的炭的作用是什么?学生猜想碳与二氧化碳反应生成一氧化碳,一氧化碳也参与还原氧化铜。
(3) 继续追问,若坩埚中剩余的只有一氧化碳,所需要的原料的质量比是多少?利用几个化学方程式进行计算,学生计算得到参加反应的炭和氧化铜的质量比为1∶6.7,即物质的量之比为1∶1。
(4) 学生设计对比实验,通过成倍提高煤炭的用量(质量比1∶6.7),其他条件均不变。通过第二次分组实验,学生仔细观察坩埚中的变化,记录实验现象。发现实验过程中产生大量的黄烟,大约三分钟后停止煅烧,学生观察到,不仅坩埚底部的固体几乎全部变红,而且石英方舟上的氧化铜也全部变红。与第一次实验的现象形成了鲜明的对照。
2.4 推理和总结实验原理,建构知识网络
(1) 结合两次实验的现象,说明有气体参与了铜的冶炼,过量的碳在容器中发生各种化学反应产生以一氧化碳为主的还原性气体,一定浓度的还原气氛还原了没有与炭接触的氧化铜[6]。一氧化碳是由过量的碳与二氧化碳反应产生,或由碳的不完全燃烧生成。
(2) 进一步分析为何实际炼铜过程需要这么多的炭,结合实验过程需要高温煅烧以及复原装置中需要鼓风的事实,学生分析得知过程中还发生了碳与氧气的燃烧反应产生大量的热,以提供反应进行所需的能量。
(3) 由实验现象中的大量黄烟,引出煤干馏的新知识,可进行后续“化学燃料”的教学。
(4) 通过对实验的分析,梳理了“碳和碳的氧化物”的各种知识,形成了知识网络结构,体会到复杂工艺流程中化学的深度参与,有效提升了化学学科核心素养。还能通过知识的迁移和延伸进一步讲解高炉炼铁、化石燃料等有关内容。
3 实验效果评价
3.1 与传统的木炭还原氧化铜相比,具有更高的成功率
众所周知,木炭还原氧化铜是一个初中阶段较难做成功的演示实验,完成后除石灰水变浑浊现象比较明显外,黑色固体变红现象受到很多因素的影响[7~9]。本改进实验只要求煤炭粉过量即可,没有严格的配比、混合方式等要求。实验操作比较简单,也便于学生观察。第二次实验坩埚中可明显地得到光亮的铜块而不是大多数实验中得到的红褐色铜粉,大大提升了学生对于铜的物理性质的有效认知。
3.2 提供了改进实验的新思路,具有一定的可迁移性
如果将此实验置于“碳的化学性质”的新授课中,可以作以下改变,使课堂更简便高效:(1)改用木炭,看不到黄烟,也能观察到固体红热,黑色固体变红;(2)去掉方舟中氧化铜的对比试验,不处理其中的还原气氛,只完成炭还原氧化铜的反应实验;(3)从课本上的实验装置改变为真实的仿古炼铜装置,保留学生自己动手实验的可能性,也能通过实验达到发展科学思维的目的。
3.3 包含多个化学反应,具有更强的综合性
学生在实验过程中,可以看到炭还原氧化铜、一氧化碳还原氧化铜以及煤的干馏等多个实验,同时蕴含对比思想,提升科学思维,让学生能够在真实情境中综合运用知识来解决问题。实验后总结所出现的化学方程式,可以发现除二氧化碳的制取、一氧化碳的燃烧外,第四单元的化学反应均有涉及,形成了知识结构的网络化。
3.4 实验过程中的一个思考
在探索各种影响因素的过程中发现,使用高纯度碳粉(石墨)是没有任何反应现象的。既不能还原氧化铜,也不能形成还原气氛。这样的现象与石墨的稳定性不无关系。不少教材对此处理模棱两可,学生实验时也非常困惑:为何石墨坩埚不会与空气发生反应?很纯的物质反而缺少反应活性,比如含有杂质的锌与硫酸反应的速度会加快,或者通过掺杂可改变某物质的化学性能等,这是化学材料研发的重要思想,说明在核心素养的培养过程中略微施加一些影响,可使化学内涵更加丰富。
4 教学反思
从铜的冶炼这一主题出发,可以统整其他知识,形成单元学习,以求充分落实核心素养。第一课时复习“碳和碳的氧化物”有关知识。第二课时探究碳酸钾在实验中的催化作用。第三课时对比火法炼铜和湿法炼铜,复习金属的性质,通过比较法探讨两种炼铜方法的差异。先梳理金属的物理性质和化学性质,特别是对湿法炼铜所得溶液的进一步处理,形成完整的流程知识;然后,可以通过跨地理学科,展示中国铜矿分布、煤矿分布(生产煤炭)、含矾物质分布(生产硫酸)的简图,利用综合知识解决哪些地方适合用火法炼铜、哪些地方适合用湿法炼铜。第四课时可以继续由火法炼铜的情境出发,发现火法炼铜残留的气体中可能含有一氧化碳、氢气和二氧化碳;同时在矿石中通常含有结晶水或由于碱式碳酸铜分解,还会有水蒸气等气体,可在这个真实情境中探究如何运用各种气体性质进行气体的检验。
古语有云:“天地为炉,造化为工;阴阳为炭,万物为铜。”也就是说,通过提供一个真实的情境,也就是“炉”;精心设计的学生实践活动,也就是“工”;思维活动就像是“炭”;将它们互相融合,最终得到有价值的“铜”。
参考文献:
[1]吴伟, 李兆友, 姜茂发. 我国古代冶铁燃料问题浅析[C]//中国金属学会. 第七届(2009)中国钢铁年会论文集(补集). 冶金工业出版社, 2009: 42~45.
[2]薛毅. 中国古代炼铜冶铁制陶燃料初探——以先秦秦汉时期的煤炭为例[J]. 湖北理工学院学报(人文社会科学版), 2012, 29(6): 1~6.
[3]庄晓松, 王祖浩. 碳还原氧化铜的最佳实验条件研究[J]. 实验教学与仪器, 2021, 38(5): 14~18.
[4]夏兰茂, 王承宪. 焦炭催化还原二氧化碳制取一氧化碳[J]. 煤炭加工与综合利用, 1987, (4): 45~48,44.
[5]卢本珊, 华觉明. 铜绿山春秋炼铜竖炉的复原研究[J]. 文物, 1981, (8): 6.
[6]张玉珍. 应用气体传感器探究木炭還原氧化铜的气体产物[J]. 化学教学, 2021, (7): 65~66.
[7]陈家宝, 侯涛. 基于文献探究“木炭还原氧化铜”的最佳条件[J]. 实验教学与仪器, 2021, 38(9): 27~29.
[8]刘林青, 丁伟. 活性炭还原氧化铜实验条件探究[J]. 化学教学, 2015, (8): 57~59.
[9]潘宏宜, 陈雪萍. 碳还原氧化铜反应装置改进及实验探究[J]. 化学教学, 2018, (1): 71~73.

