辛麻颗粒对慢性哮喘小鼠呼吸道黏膜免疫功能的影响
宫静, 吕子怡, 吴淼萍, 钟邓萍
(1.广东省第二中医院,广东广州 510095;2.广州中医药大学第五临床医学院,广东广州 510095)
辛麻颗粒为广东省第二中医院院内制剂,由经典名方小青龙汤合射干麻黄汤化裁而成,主要功效为止咳平喘、健脾化痰,临床应用可有效治疗哮喘[1]。课题组前期研究[2]表明,辛麻颗粒可以通过抑制辅助性T 细胞2(Th2)优势的免疫作用,改善哮喘小鼠的气道炎症;但其作用机制尚不完全明确。气道上皮屏障功能异常是2 型炎症发生发展的关键步骤[3]。因此,本研究拟观察辛麻颗粒对哮喘小鼠呼吸道黏膜免疫功能的影响,探讨其干预机制,以期为辛麻颗粒临床应用提供理论依据,现将研究结果报道如下。
1 材料与方法
1.1 实验动物50 只SPF 级雌性BALB/C 小鼠,鼠龄6 ~8 周,体质量17 ~21 g,购自广东省医学实验动物中心,动物生产许可证号:SCXK(粤)2022-0002。于广东省第二中医院实验动物中心饲养,室温22~26 ℃,相对湿度45%~65%,标准饲料喂养,自由进食、饮水。本研究通过广东省第二中医院实验动物伦理委员会审查,审批号:049147。
1.2 药物、试剂与仪器辛麻颗粒(5 g/包),广东省第二中医院院内制剂(批准文号:粤药制字Z20090021),药物组成:炙麻黄、细辛、法半夏、苏子、射干、陈皮、山药、丹参、五味子、补骨脂。地塞米松注射液(天津金耀集团湖北天药药业股份有限公司生产,批号:国药准字H42020019)。卵清白蛋白(ovalbumin,OVA)(美国Sigma 公司);小鼠分泌型免疫球蛋白A(sIgA)酶联免疫吸附分析(ELISA)试剂盒、小鼠免疫球蛋白E(IgE)ELISA试剂盒(美国RD 公司);E 钙黏蛋白(E-cadherin)抗体(美国Cell signalling technology 公司);山羊抗兔IgG H&L(HRP)二抗(英国Abcam 公司)。403H空气式压缩雾化器(中国鱼跃医疗公司);2550 型紫外-可见分光光度计(日本岛津公司);Spectra MAX190 型酶标仪(美国MD 公司);PowerPac 基础电泳仪(美国Bio-Rad 公司);YD62型石腊包埋机、YD-AB 型烤片机(均为浙江金华益迪公司产品);DP2-BSW 型病理图像采集系统(日本Olympus公司)。
1.3 分组、造模与给药将50只小鼠适应性喂养1 周后,随机分为5 组,分别为正常组、模型组,辛麻颗粒低、高剂量组,地塞米松组,每组10只。模型的建立与给药处理:正常组,第1、14 天每只小鼠腹腔注射0.2 mL 生理盐水,以第21 天起雾化吸入生理盐水30 min,3 次/周,持续8 周。模型组,参照文献研究[4]建立慢性哮喘模型,分致敏和激发两步,第1、14 天每只小鼠腹腔注射0.2 mL致敏液(OVA 10 µg,氢氧化铝凝胶100 µg),第21 天起雾化吸入OVA 溶液(25 g/L,Ⅱ级)30 min,3 次/周,持续8 周。造模过程观察小鼠精神状态、皮毛、活动、呼吸、大小便以及进食状态,判断模型成功建立与否主要是从小鼠症状、体征及病理学改变来评估。辛麻颗粒低剂量组,在构建哮喘模型的基础上,从第21 天开始每日2 次灌胃辛麻颗粒水溶液至造模结束,1.3 g/kg(按动物体表面积比率换算等效剂量法)。辛麻颗粒高剂量组处理同辛麻颗粒低剂量组,剂量为2.6 g/kg;地塞米松组,在构建哮喘模型的基础上,第21 天起每次雾化前30 min 腹腔注射10 mg/kg 地塞米松注射液[5],3次/周,持续8周。
1.4 观察指标与检测方法
1.4.1 ELISA 法检测sIgA、IgE 水平 各组小鼠末次激发24 h 后行支气管灌洗。离断颈椎处死小鼠,医用胶布固定小鼠四肢,分离颈部皮肤、肌肉组织,分离气管,结扎右肺,左侧支气管置静脉穿刺套管针,0.9%冰浴生理盐水1 mL 行支气管灌洗,每次气道内注入、回抽3 次,回收液体量>80%。双抗体夹心ELISA 法检测支气管灌洗液中sIgA、IgE 浓度。按ELISA 试剂盒说明书进行操作。应用酶标仪于450 nm 波长处测定吸光度值,计算后得出sIgA、IgE的实际浓度。
1.4.2 HE 染色法观察肺组织病理学改变 切取的小鼠右肺组织用0.9% 生理盐水清洗血渍,10%多聚甲醛固定48 h,常规脱水,透明,石蜡包埋,制作蜡块,横切气管,切成厚度5 µm 薄片,行HE染色。
1.4.3 Western Blot 法检测肺组织E-cadherin表达 取左肺组织剪碎,加入放射免疫沉淀分析(RIPA)裂解液(含蛋白酶和磷酸酶抑制剂),匀浆机匀浆,置于冰上裂解30 min,取上清液进行蛋白定量。将等量蛋白样品进行聚丙烯酰胺凝胶电泳(PAGE)后转至聚偏氟乙烯(PVDF)膜上,脱脂牛奶室温封闭2 h,加入一抗E-cadherin(1∶1 000 稀释),4 ℃孵育过夜,TBST 洗膜。加入山羊抗兔IgG H&L(HRP)二抗(1∶2 000稀释),室温孵育1 h,TBST 洗膜。增强化学发光(ECL)液显影,全自动化学发光成像分析系统成像,用ImageJ 软件对条带进行灰度分析,计算目的蛋白相对表达量(目的蛋白条带灰度值/内参蛋白条带灰度值比值)。
1.5 统计方法采用SPSS 25.0统计学软件进行数据分析,计量资料以均数± 标准差 (±s)表示。多组间比较采用单因素方差分析;多组样本均数两两比较,方差齐者用Bonferroni 检验,方差不齐的多重比较用Dunnett’s T3 法检验。 以P<0.05 表示差异有统计学意义。
2 结果
2.1 各组小鼠一般状态比较正常组小鼠动作灵活,毛发光亮,未见呼吸异常;模型组小鼠出现呼吸急促,点头呼吸,烦躁不安,腹肌抽搐,皮毛暗淡粗糙等表现;辛麻颗粒高、低剂量组及地塞米松组小鼠在雾化刺激后出现呼吸急促、腹肌抽搐等表现,但明显轻于模型组,哮喘样症状有所改善。
2.2 各组小鼠肺组织病理变化比较图1 结果显示:正常组小鼠气管及肺组织结构完整,无炎性细胞浸润;模型组小鼠气道壁、气道平滑肌明显增厚,黏膜下层增宽,皱褶增多,管腔狭窄,气管、支气管周围可见大量炎性细胞浸润;与模型组比较,辛麻颗粒高、低剂量组及地塞米松组小鼠肺组织、气道炎性细胞浸润减少,气道壁及气道平滑肌增厚减轻,其中辛麻颗粒高剂量组、地塞米松组改善更明显。

图1 各组小鼠肺组织病理学改变(HE染色,×200)Figure 1 Histopathological changes in the lungs of mice in each group(HE staining,×200)
2.3 各组小鼠支气管灌洗液sIgA、IgE浓度比较表1结果显示:模型组小鼠支气管灌洗液sIgA 浓度低于正常组(P<0.05);辛麻颗粒高、低剂量组及地塞米松组sIgA 浓度高于模型组(P<0.05);辛麻颗粒高剂量组、地塞米松组支气管灌洗液sIgA 浓度高于辛麻颗粒低剂量组(P<0.05),且2 组比较,差异无统计学意义(P>0.05)。
表1 各组小鼠支气管灌洗液sIgA、IgE 浓度比较Table 1 Comparison of sIgA and IgE concentrations in bronchial lavage fluid of mice among various groups (± s,µg·mL-1)
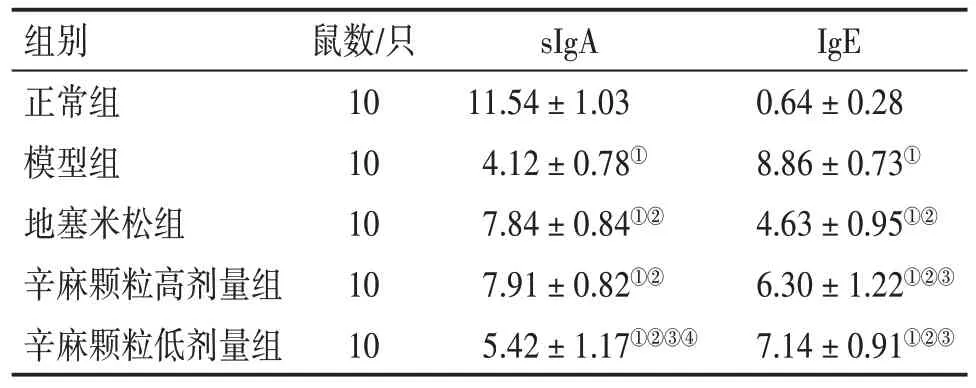
表1 各组小鼠支气管灌洗液sIgA、IgE 浓度比较Table 1 Comparison of sIgA and IgE concentrations in bronchial lavage fluid of mice among various groups (± s,µg·mL-1)
注:①P<0.05,与正常组比较;②P<0.05,与模型组比较;③P<0.05,与地塞米松组比较;④P<0.05,与辛麻颗粒高剂量组比较
?
模型组小鼠支气管灌洗液IgE 浓度高于正常组(P<0.05);辛麻颗粒高、低剂量组及地塞米松组IgE浓度与模型组相比较均有降低(P<0.05);地塞米松组IgE 浓度显著低于辛麻颗粒高、低剂量组(P<0.05);辛麻颗粒高、低剂量组IgE 浓度比较,差异无统计学意义(P>0.05)。
2.4 各组小鼠肺组织E-cadherin表达比较表2、图2结果显示:与正常组比较,模型组小鼠肺组织E-cadherin 蛋白相对表达量显著降低(P<0.05);与模型组比较,辛麻颗粒高、低剂量组及地塞米松组小鼠肺组织中E-cadherin 蛋白相对表达量均升高(P<0.05);辛麻颗粒高剂量组和地塞米松组E-cadherin 蛋白相对表达量高于辛麻颗粒低剂量组(P<0.05),且2 组比较,差异无统计学意义(P>0.05)。
表2 各组小鼠肺组织E-cadherin蛋白相对表达量的比较Table 2 Comparison of relative expression of E-cadherin protein in lung tissues of mice among various groups (± s)
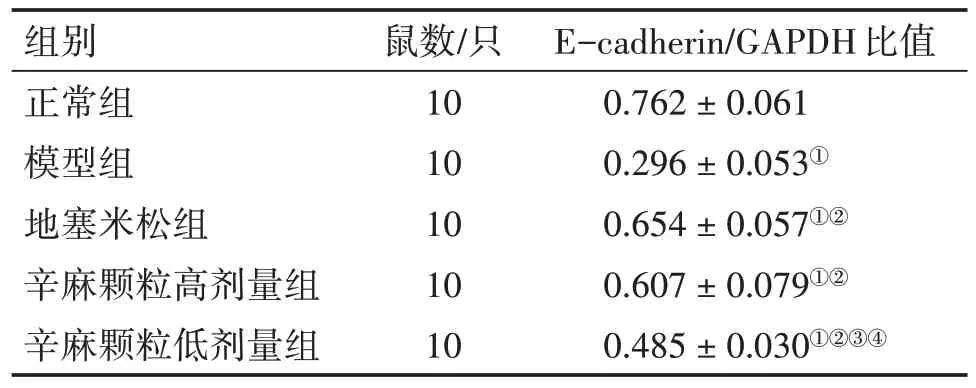
表2 各组小鼠肺组织E-cadherin蛋白相对表达量的比较Table 2 Comparison of relative expression of E-cadherin protein in lung tissues of mice among various groups (± s)
注:①P<0.05,与正常组比较;②P<0.05,与模型组比较;③P<0.05,与地塞米松组比较;④P<0.05,与辛麻颗粒高剂量组比较
?

图2 各组小鼠肺组织中E-cadherin蛋白的Western Blot电泳图Figure 2 Western Blot electrophoresis of E-cadherin protein in lung tissues of various groups of mice
3 讨论
哮喘存在免疫功能紊乱。黏膜免疫系统是独立于细胞与体液免疫系统之外的一种复杂的免疫系统,就像一道屏障保护机体,是机体抵抗病原的第一道防线。气道上皮细胞为气道黏膜的重要构成,在维持机体气道免疫稳态中发挥重要作用[6]。气道上皮细胞作为引起哮喘气道炎症的靶细胞之一,暴露于环境因素和炎症后,易造成气道上皮反复损伤,修复和再生会导致气道黏膜上皮的组织学改变和功能异常[7],诱导免疫系统异常信号传导、气道重塑以及气道高反应性,引起哮喘疾病的发生和发展[8]。
sIgA 是机体黏膜防御系统的主要成分,主要由淋巴细胞归巢到黏膜中的B细胞产生,是黏膜应答过程中的主要效应因子,在呼吸道黏膜免疫反应中发挥关键作用[9]。提高sIgA 水平可增强黏膜免疫功能,预防呼吸道疾病发生,遏制相关疾病的进展。体内sIgA 缺乏或降低容易发生支气管哮喘等疾病[10]。本研究发现,辛麻颗粒能够提高哮喘小鼠呼吸道的sIgA水平,增强黏膜免疫功能。
IgE 由黏膜下淋巴组织中的效应B 细胞合成。哮喘发病中,IgE 可作用于局部组织中肥大细胞和嗜碱性粒细胞的FcεRⅠ受体,促进炎性介质的释放,导致支气管收缩,气道平滑肌痉挛,同时导致杯状细胞大量分泌黏液,气道黏膜水肿,引起气道高反应性[11]。哮喘患者体内往往存在高水平的IgE 并且与哮喘炎症的严重程度相关。本研究发现,辛麻颗粒可降低哮喘小鼠呼吸道的IgE 水平,改善哮喘小鼠的气道炎症。
气道上皮屏障功能是黏膜免疫的重要组成部分。屏障蛋白E-cadherin对于细胞间的黏附起到重要的作用,是上皮细胞重要的生物标记物。E-cadherin 主要表达于上皮细胞膜上,其表达减少使支气管上皮结构失去稳定性和上皮细胞丧失极性, 有利于支气管上皮细胞的移行[12]。研究[13]表明,哮喘发生时E-cadherin的表达明显降低,在哮喘患者中E-cadherin蛋白表达水平越低,屏障功能缺失就越明显,而屏障功能缺失又会进一步促进哮喘的发生与发展。此次研究发现,使用辛麻颗粒干预后,哮喘小鼠肺组织E-cadherin蛋白表达增高,可以保护气道上皮屏障,改善哮喘小鼠呼吸道黏膜免疫功能。
综上所述,辛麻颗粒能够改善气道炎症,降低呼吸道IgE 水平,提高哮喘小鼠呼吸道sIgA 浓度以及气道E-cadherin蛋白表达,进而增强哮喘小鼠呼吸道黏膜免疫功能,且辛麻颗粒高剂量作用效果优于低剂量,与地塞米松作用相当。

