揉拨法调节DHPR/RyR通路对肌筋膜疼痛综合征大鼠的改善作用研究
向超, 何生华, 赵欣, 万骐, 马炽, 胡艳平,2
(1.武汉市中医医院推拿科,湖北武汉 430014;2.湖北中医药大学针灸骨伤学院,湖北武汉 430000)
肌筋膜疼痛综合征(myofascial pain syndromes,MPS)是一种区域性疼痛疾病,好发于每个年龄段的人群,其特征是在肌肉或筋膜内存在激痛点。激痛点即为存在于骨骼肌中的结节,触诊时产生疼痛,主要由过度使用肢体或长时间保持同样姿势引起[1-2]。MPS 的治疗方法主要是定期物理治疗,如针灸、按摩、经皮电刺激和干扰电流治疗等,帮助恢复正常的肌肉松弛和关节活动度,或者在难治性病例中辅以药物或非药物进行干预[3-4]。本课题组前期研究已经证实,痛点揉拨法可以治疗MPS,缓解疼痛,改善肌痉挛;但其作用机制尚不清楚。 研究[5-8]发现, 二氢吡啶受体(dihydropyridine receptor,DHPR)是质膜L 型电压门控钙离子(Ca2+)通道,利若丁受体(ryanodine receptor,RyR)则是肌质网快速Ca2+释放通道,可机械化学偶联促进肌质网Ca2+释放并控制肌肉收缩。因此,本研究构建MPS 大鼠模型,观察揉拨法对MPS 大鼠激痛点组织DHPR/RyR 信号通路的影响,探讨其治疗作用及机制,以期为临床应用揉拨法治疗MPS 提供循证依据,现将研究结果报道如下。
1 材料与方法
1.1 实验动物60只SPF级雄性SD大鼠,7 ~8周龄,体质量(240 ± 20)g,购自湖北贝恩特生物科技有限公司,动物生产许可证号:SCXK(鄂)2021-0027。动物实验在华中科技大学动物实验中心进行,动物使用许可证号:SYXK(鄂)2021-0057。本研究已获得华中科技大学动物实验中心动物伦理委员会批准,审批号:202207023。
1.2 主要试剂与仪器RyR 抑制剂丹曲林(美国MedChemExpress 公司,批号:HY-12542);4%多聚甲醛(上海颖心实验室设备有限公司);钙离子(Ca2+)检测试剂盒(上海泽叶生物科技有限公司);甲基百里香酚蓝(上海易恩化学技术有限公司);兔源一抗DHPRα1(美国Abcam 公司);兔源一抗RyR(美国Santa Cruz 公司);兔源一抗乙酰胆碱酯酶(AChE)、β-actin[爱必信(上海)生物科技有限公司];辣根过氧化物酶(HRP)标记的山羊抗兔IgG二抗(北京鼎国昌盛生物技术有限责任公司)。JZL-Ⅲ软组织张力测定仪(天津明通世纪科技有限公司);肌电装置(上海玉研科学仪器有限公司);SuPer Max 3100 酶标仪(武汉言必行科技股份有限公司);Talos L120C TEM 透射电镜(北京欧波同光学技术有限公司)。
1.3 MPS大鼠模型的构建采用钝性打击结合离心运动法构建MPS 大鼠模型[9]。方法:在每周的第1 天对大鼠进行一次钝性打击,即大鼠麻醉满意后,固定于打击器低端并对左侧股内侧肌进行标记,随后打击器从20 cm 高处垂直下落且打击在大鼠标记处。第2天,在跑台上进行离心运动90 min。剩余5 d正常饲养,不做其他干预。共重复8周。然后,再正常饲养、活动4周作为恢复期。当进行触诊时出现挛缩结节,电极针刺入结节时发生抽搐反应,且肌电图中出现高频自发性电活动,说明MPS大鼠造模成功。
1.4 分组与干预从60 只大鼠中随机抽取12 只作为正常组,其余大鼠构建MPS 模型。将48 只造模成功的MPS 大鼠随机分为模型组、揉拨法组、揉拨法+ 丹曲林组、揉拨法+ 生理盐水组,每组12 只。揉拨法组:将大鼠麻醉并仰卧固定于动物按摩床,备皮,用拇指在结节处进行揉拨手法推拿,经过压力传感器检测,保持揉拨时最大力度在0.7 kg,一共操作3 min。揉拨法+丹曲林组:在进行揉拨推拿后腹膜注射10 mg/kg的丹曲林[10];揉拨法+生理盐水组进行揉拨推拿后腹膜注射等体积生理盐水。上述干预每隔1 d 进行1 次,每次揉拨治疗5 min,总共治疗7 次。同期,模型组和正常组大鼠不做干预处理,正常喂养。
1.5 观察指标与检测方法
1.5.1 von-Frey 法测定大鼠机械性痛阈值 在治疗1、4、7次后,分别测定各组大鼠的机械性痛阈值。将大鼠置于玻璃体中,并放在金属网架上,然后用von-Frey 纤维丝刺激针刺激大鼠的左后肢足底正中部位。当大鼠出现撤足反射时,记录测痛仪上数值,重复刺激5 次,每次间隔5 min,去掉最大值和最小值,计算机械性痛阈值。
1.5.2 软组织张力测定[11]调试软组织张力测定仪,检测头对准MPS 大鼠的激痛点区域,正常组则取相同位置的股内侧肌肌腹,然后垂直均匀地用力按压持续3 s,再均匀撤力,同样需要3 s。最后观察按压或撤力时形成的力量-位移曲线并分析数据。根据仪器的说明书以及预试验结果,将曲线中0.2 kg 及其对应的位移(D0.2kg)作为观察指标,可以更好地反映大鼠的肌肉软组织张力。
1.5.3 肌电图检测 将各组大鼠的左后肢毛发剃掉。在正常组大鼠的左后肢股内侧肌肌腹插入一支电极,在3 ~5 mm 处再插入一支作为参考电极。其余组大鼠通过触诊MPS 部位找到挛缩结节,然后将电极刺入,此时大鼠产生抽搐反应,同样在3 ~5 mm处另插一支电极作为参考。应用肌电装置观察肌电活动。
1.5.4 透射电镜观察MPS 大鼠激痛点组织的超微结构 上述检测完成后,每组随机选出6 只大鼠处死,取出挛缩结节区域(激痛点),正常组则取相同位置的股内侧肌肌腹,用生理盐水洗涤,放入4%多聚甲醛中固定、备用。漂洗、锇酸固定、脱水,然后包埋再切片处理,透射电镜观察超微结构,包括肌原纤维和肌节排列的规则程度、肌节明带和暗带的完整情况与位置关系以及Z线异常率。
1.5. 5 比色法检测MPS 大鼠激痛点组织中Ca2+含量 将各组剩余的6只大鼠处死,按“1.5.4”项取出各组大鼠相应部位的组织,匀浆、低温离心后取上清液,按照试剂盒说明书,采用甲基百里香酚蓝比色法检测Ca2+的含量。
1.5.6 Western Blot法检测MPS大鼠激痛点组织中DHPRα1、RyR、AChE 蛋白表达 将“1.5.5”项中取出的剩余的各组大鼠组织用放射免疫沉淀分析(RIPA)裂解缓冲液裂解并提取总蛋白,测定蛋白质浓度后,上样,进行十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳(PAGE)分离。再将蛋白转移到硝酸纤维素膜上,用5%脱脂奶粉封闭1 h。先后用一抗DHPRα1、RyR、AChE、β-actin(均1∶1 000稀释)4 ℃孵育过夜,二抗室温孵育1 h。最后加入增强化学发光(ECL)溶液可视化蛋白并使用ImageJ 软件对蛋白质进行定量分析,以β-actin 为内参。
1.6 统计方法采用Graph Pad Prism 9.0 统计学软件进行数据处理,计量数据以均数± 标准差(x±s)表示。多组比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 揉拨法对MPS大鼠机械性痛阈值的影响表1结果显示:在治疗前,与正常组比较,模型组、揉拨法组、揉拨法+丹曲林组、揉拨法+生理盐水组大鼠机械性痛阈值显著减小,表明MPS 大鼠模型构建成功(P<0.05)。治疗后,与正常组比较,模型组大鼠机械性痛阈值仍减小(P<0.05);与模型组比较,揉拨法组、揉拨法+生理盐水组机械性痛阈值均增加(P<0.05),且随着治疗次数的增加,机械性痛阈值逐渐升高;揉拨法组与揉拨法+生理盐水组机械性痛阈值比较,差异无统计学意义(P>0.05);与揉拨法组比较,揉拨法+丹曲林组机械性痛阈值下降(P<0.05)。
表1 揉拨法对肌筋膜疼痛综合征(MPS)大鼠机械性痛阈值的影响Table 1 Effect of pressing and rubbing method on mechanical pain threshold in MPS rats (± s)
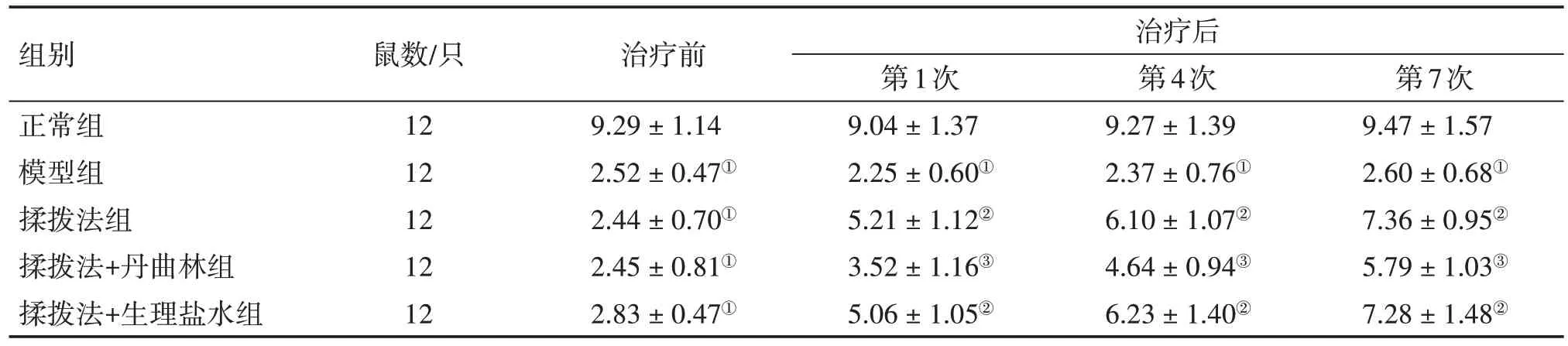
表1 揉拨法对肌筋膜疼痛综合征(MPS)大鼠机械性痛阈值的影响Table 1 Effect of pressing and rubbing method on mechanical pain threshold in MPS rats (± s)
注:①P<0.05,与正常组比较;②P<0.05,与模型组比较;③P<0.05,与揉拨法组比较
?
2.2 揉拨法对MPS 大鼠激痛点软组织张力D0.2kg 的影响表2 结果显示,治疗前,与正常组比较,模型组、揉拨法组、揉拨法+丹曲林组、揉拨法+生理盐水组大鼠激痛点软组织张力D0.2kg显著减小(P<0.05)。在治疗后,与正常组比较,模型组大鼠激痛点软组织张力D0.2kg减小(P<0.05);与模型组比较,揉拨法组、揉拨法+生理盐水组D0.2kg升高(P<0.05);揉拨法组与揉拨法+生理盐水组D0.2kg比较,差异无统计学意义(P>0.05);与揉拨法组比较,揉拨法+丹曲林组D0.2kg下降(P<0.05)。
表2 揉拨法对肌筋膜疼痛综合征(MPS)大鼠激痛点软组织张力D0.2 kg的影响Table 2 Effect of pressing and rubbing method on soft tissue tension D0.2 kg of trigger point in MPS rats (± s)

表2 揉拨法对肌筋膜疼痛综合征(MPS)大鼠激痛点软组织张力D0.2 kg的影响Table 2 Effect of pressing and rubbing method on soft tissue tension D0.2 kg of trigger point in MPS rats (± s)
注:①P<0.05,与正常组比较;②P<0.05,与模型组比较;③P<0.05,与揉拨法组比较
?
2.3 揉拨法对MPS大鼠肌电图的影响图1 结果显示:正常组大鼠肌电图无明显变化,未出现电活动现象;模型组大鼠肌电图发生明显变化,出现振幅较高的峰电位、高频率低幅度的背景电位;揉拨法组与揉拨法+生理盐水组肌电图中的电位变化较模型组明显减少;揉拨法+丹曲林组肌电图则出现明显的电位变化。
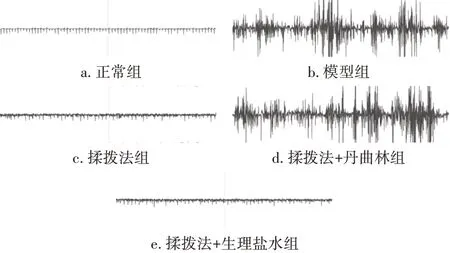
图1 揉拨法对肌筋膜疼痛综合征(MPS)大鼠肌电图的影响Figure 1 Effect of pressing and rubbing method on the electromyogram of MPS rats
2.4 揉拨法对MPS 大鼠激痛点组织超微结构的影响图2结果显示:正常组肌原纤维排列规则且整齐,肌节明带和暗带完整且交界明显、交替规则,Z 线连续且清晰;模型组激痛点组织肌原纤维排列混乱、甚至出现断裂情况,肌节暗带不完整、界线杂乱,Z 线出现断裂;揉拨法组与揉拨法+生理盐水组激痛点组织肌原纤维排列恢复整齐趋势,肌节明带和暗带交界明显,Z 线较连续;揉拨法+丹曲林组激痛点组织肌原纤维排列不规则、出现少许断裂,肌节暗带不完整、混乱,Z线断裂。

图2 揉拨法对肌筋膜疼痛综合征(MPS)大鼠激痛点组织超微结构的影响(透射电镜,×10 000)Figure 2 Effect of pressing and rubbing method on ultrastructure of pain point tissue in MPS rats(under transmission electron microscope,×10 000)
2.5 揉拨法对MPS大鼠激痛点组织Ca2+含量的影响表3结果显示:与正常组比较,模型组大鼠激痛点组织中Ca2+含量增加(P<0.05);与模型组比较,揉拨法组、揉拨法+生理盐水组大鼠激痛点组织中Ca2+含量减少(P<0.05);与揉拨法组比较,揉拨法+丹曲林组大鼠激痛点组织中Ca2+含量增加(P<0.05);而揉拨法组与揉拨法+生理盐水组Ca2+含量比较,差异无统计学意义(P>0.05)。
表3 揉拨法对肌筋膜疼痛综合征(MPS)大鼠激痛点组织Ca2+含量的影响Table 3 Effect of pressing and rubbing method on Ca2+content in trigger point tissue of MPS rats (± s)
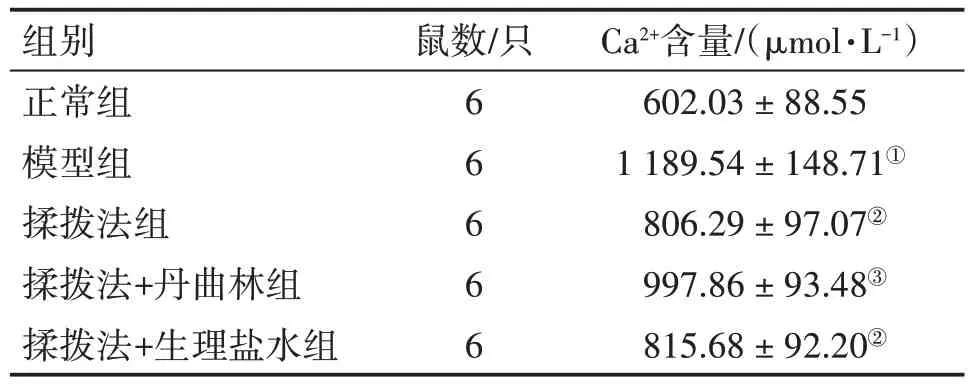
表3 揉拨法对肌筋膜疼痛综合征(MPS)大鼠激痛点组织Ca2+含量的影响Table 3 Effect of pressing and rubbing method on Ca2+content in trigger point tissue of MPS rats (± s)
注:①P<0.05,与正常组比较;②P<0.05,与模型组比较;③P<0.05,与揉拨法组比较
?
2.6 揉拨法对MPS 大鼠激痛点组织DHPR/RyR信号通路相关蛋白表达的影响图3 和表4 结果显示:与正常组比较,模型组DHPRα1、RyR、AChE 蛋白表达水平降低(P<0.05);与模型组比较,揉拨法组、揉拨法+生理盐水组DHPRα1、RyR、AChE 蛋白表达水平升高(P<0.05);与揉拨法组比较,揉拨法+丹曲林组DHPRα1、RyR、AChE蛋白表达水平降低(P<0.05);与揉拨法组比较,揉拨法+生理盐水组以上蛋白表达水平无显著性差异(P>0.05)。

图3 DHPRα1、RyR、AChE蛋白的Western Blot条带Figure 3 Western Blot bands of DHPRα1,RyR and AChE proteins
表4 揉拨法对肌筋膜疼痛综合征(MPS)大鼠激痛点组织DHPRα1、RyR、AChE蛋白相对表达量的影响Table 4 Effect of pressing and rubbing method on the relative protein expressions of DHPRα1,RyR,and AChE in excitatory point tissues of MPS rats (± s)

表4 揉拨法对肌筋膜疼痛综合征(MPS)大鼠激痛点组织DHPRα1、RyR、AChE蛋白相对表达量的影响Table 4 Effect of pressing and rubbing method on the relative protein expressions of DHPRα1,RyR,and AChE in excitatory point tissues of MPS rats (± s)
注:①P<0.05,与正常组比较;②P<0.05,与模型组比较;③P<0.05,与揉拨法组比较
?
3 讨论
揉拨法属汉派经穴推拿,是经穴疏导痛点揉拨推拿手法中的一种复合治疗手法。本研究中使用的揉拨法是由本院推拿科主任高扬教授研读中医著作并师承中医名师闻庆汉教授,经过不断的总结、提炼、传承和发展而形成的特色荆楚推拿疗法中的痛点揉拨法。本法融合了荆楚名医的学术思想及实践经验,将整体和局部相结合,遵循局部辨证推拿和整体经穴疏导的原则。本课题组应用痛点揉拨法治疗肌筋膜疼痛综合征(MPS),有明显疗效,阐明其治疗作用及机制对临床治疗具有重要的研究意义。
本研究采用钝性打击和离心运动方法构建大鼠MPS 模型,结果显示MPS 大鼠机械性痛阈值和激痛点软组织张力D0.2kg显著降低,表明大鼠MPS造模成功。MPS 大鼠激痛点组织中Ca2+含量增多、肌电图显示自发肌电活动增多、激痛点部位组织结构受到破坏,均表明MPS 大鼠正常肌电活动异常、激痛点组织受损。揉拨法治疗后的MPS 大鼠机械性痛阈值、激痛点软组织张力D0.2kg升高,激痛点组织中Ca2+含量减少并趋于正常水平,肌电图监测发现自发肌电活动减少,激痛点组织结构较规则且排列整齐、界限清晰,表明揉拨法可以改善MPS 引发的大鼠疼痛以及抽搐反应,修复激痛点组织损伤。
DHPR、RyR 在骨骼肌兴奋-收缩耦合中发挥调节Ca2+通道的作用。DHPR 存在于骨骼肌横小管的特殊内陷肌膜中,是电压门控L 型Ca2+通道,当通过DHPR 内流的Ca2+与RyR2 通道的足结构域结合后,以Ca2+触发Ca2+释放方式使RyR 开放。RyR与肌浆网Ca2+释放通道相关,可以控制Ca2+从肌浆网释放到肌质中,进而调节肌肉细胞的收缩[12-13]。有研究[14-15]表明,DHPR/RyR 轴对于细胞膜活动及其与细胞内的连接至关重要,可以影响胞内和胞外的Ca2+平衡,介导肌肉收缩。本研究结果显示,MPS 大鼠激痛点组织中DHPRα1、RyR、AChE 蛋白表达降低,揉拨法治疗后DHPRα1、RyR、AChE 蛋白表达升高。推测揉拨法可能通过促进DHPR/RyR 轴DHPRα1、RyR 表达的增加,减轻MPS 大鼠激痛点组织超微结构损伤。进一步应用RyR抑制剂丹曲林进行验证,结果显示,在揉拨法处理后注射丹曲林减弱了揉拨法对MPS 大鼠的改善作用,再次证明揉拨法可能通过激活DHPR/RyR轴改善肌肉张力,减轻MPS大鼠症状。
综上所述,揉拨法可有效改善大鼠MPS,其机制可能与激活DHPR/RyR 轴有关。但揉拨法与DHPR/RyR 轴更加深入的作用机制还需要进一步的探究。

