基于NLRP3信号通路探究天麻素注射液联合神经节苷脂辅助治疗脊髓损伤的可能机制
王超, 段浩, 毕航川, 王志华
(昆明医科大学第一附属医院创伤医学中心,云南昆明 650031)
脊髓损伤(spinal cord injury,SCI)是指在外伤等因素作用下,脊髓出现受压、缺血及坏死,通常伴随脊柱损伤的发生[1-2]。SCI一旦发生,往往会遗留不同程度的运动与感觉功能障碍、膀胱功能障碍以及自主神经系统功能障碍,严重者甚至终身残疾,给患者个人、家庭及社会带来极大的负担[3-4]。神经节苷脂目前已广泛应用于SCI 治疗中,可有效改善神经功能,但单纯应用具有一定局限性,临床多联合其他药物应用[5-6]。近年来的研究表明,中成药治疗SCI具有标本兼治的优势,已逐渐受到临床医师的重视。另有基础研究[7]显示,天麻素注射液可发挥抗炎、抗氧化作用,以抑制脊髓神经元的进一步损伤,同时还可影响雪旺细胞代谢,促进神经轴突生长,从而达到治疗SCI的目的。研究指出,神经炎症是SCI后继发损伤的关键所在,而NOD 样受体热蛋白结构域相关蛋白3(NLRP3)的激活又反馈性引发神经炎症[8-9]。相关基础研究[10]证实,NLRP3 信号通路在SCI模型大鼠中呈过度激活状态,但关于其是否参与天麻素注射液联合神经节苷脂辅助治疗SCI的作用过程,仍有待验证。基于此,本研究尝试基于NLRP3 信号通路探究天麻素注射液联合神经节苷脂辅助治疗SCI的可能机制,现将研究结果报道如下。
1 对象与方法
1.1 研究对象及分组选取2021 年6 月~2023 年3 月昆明医科大学第一附属医院创伤医学中心收治的108 例SCI 患者为研究对象,根据就诊先后顺序,采用随机数字表法将患者随机分为观察组和对照组,每组各54 例。本研究符合医学伦理学要求并通过昆明医科大学第一附属医院医学伦理委员会的审核批准,批准号:2021011。
1.2 纳入标准①均符合美国脊柱损伤协会(American Spinal Injury Association,ASIA)的SCI诊断标准[11],并经影像学检查确诊;②均接受椎管减压、植骨融合术治疗;③本人或其家属对本研究内容知情,并签署了相关知情同意书的患者。
1.3 排除标准①合并血液、神经及免疫系统疾病的患者;②伴有严重器质性疾病的患者;③受伤前有脊柱疾病或其他严重创伤的患者;④合并有心脑血管疾病的患者;⑤存在精神或认知障碍,不能配合本研究的患者;⑥妊娠期或哺乳期女性;⑦对神经节苷脂、天麻素注射液存在过敏反应的患者;⑧治疗期间因严重不良反应终止治疗或私自增减药物的患者。
1.4 治疗方法
1.4.1 常规康复训练 2 组患者均给予常规康复训练干预,包括关节、运动和日常生活康复训练以及肛门和膀胱括约肌训练。
1.4.2 对照组 给予神经节苷脂治疗。用法:单唾液酸四己糖神经节苷脂钠注射液(西南药业股份有限公司生产,批准文号:国药准字H20093712)60 mg + 生理盐水100 mL,静脉滴注,每天1 次。连续治疗20 d,停药10 d。30 d 为1 个疗程,连续治疗2个疗程。
1.4.3 观察组 在对照组的基础上联合天麻素注射液治疗。用法:天麻素注射液(海南惠普森医药生物技术有限公司生产,批准文号:国药准字H20058309)600 mg+生理盐水250 mL,静脉滴注,每天1 次。连续治疗20 d,停药10 d。30 d 为1 个疗程,连续治疗2个疗程。
1.5 观察指标及疗效评价标准(1)疗效评价标准:参考《临床脊柱外科学》[12]拟定疗效评价标准,分为临床治愈、显效、好转及无效4 级。其中,脊髓损伤症状完全消失,感觉功能完全恢复为临床治愈;脊髓损伤症状明显改善且病情得到有效控制为显效;脊髓损伤症状较治疗前有所减轻为好转;脊髓损伤症状未改善甚至加重为无效。总有效率(%)=(临床治愈例数+显效例数+好转例数)/总病例数× 100%。(2)康复效果指标观察:统计2组患者的肌力恢复正常时间、可下地行走时间及留院观察时间。(3)ASIA 评分:参考ASIA 中关于SCI 功能恢复评价标准[11],具体包含痛觉、运动及触觉3 个方面。评分越高,表示功能恢复越好。(4)相关实验室指标测定:分别于治疗前、治疗1 个疗程和2 个疗程后,采集2 组患者的空腹外周静脉血5 mL,离心(转速为3 000 r/min,半径为8 cm,时间为10 min)分离血清,采用上海哈灵生物科技有限公司提供的酶联免疫吸附(ELISA)试剂盒测定脑源性神经生长因子(BDNF)、中枢神经特异性蛋白(S-100β)、白细胞介素(IL)-1β、IL-18 及NLRP3、半胱氨酸蛋白酶1(Caspase-1)、凋亡相关斑点样蛋白(ACS)水平。(5)安全性评价:观察2组患者治疗过程中的不良反应发生情况,评价2组治疗方案的安全性。
1.6 统计方法应用SPSS 22.0统计学软件进行数据的统计分析。计量资料用均数±标准差 (±s)表示,不同时间点组间比较采用重复测量方差分析,两两比较采用t检验;计数资料用率或构成比表示,组间比较采用χ2检验。均采用双侧检验,以P<0.05表示差异有统计学意义。
2 结果
2.1 2 组患者基线资料比较表1 结果显示:2 组患者的性别、年龄、病程、受损部位、ASIA 分级等基线资料比较,差异均无统计学意义(P>0.05),表明2 组患者的基线资料均衡性良好,具有可比性。
表1 2组脊髓损伤(SCI)患者基线资料比较Table 1 Comparison of baseline data between the two groups of spinal cord injury(SCI)patients (± s)
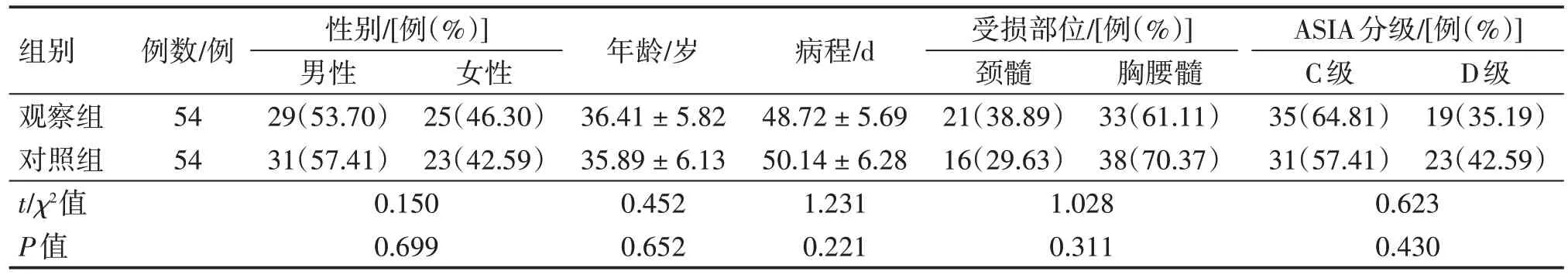
表1 2组脊髓损伤(SCI)患者基线资料比较Table 1 Comparison of baseline data between the two groups of spinal cord injury(SCI)patients (± s)
注:ASIA:美国脊柱损伤协会
?
2.2 2组患者临床疗效比较表2结果显示:治疗2 个疗程后,观察组的总有效率为83.33%(45/54),对照组为66.67%(36/54);组间比较(χ2检验),观察组的疗效明显优于对照组,差异有统计学意义(P<0.05)。
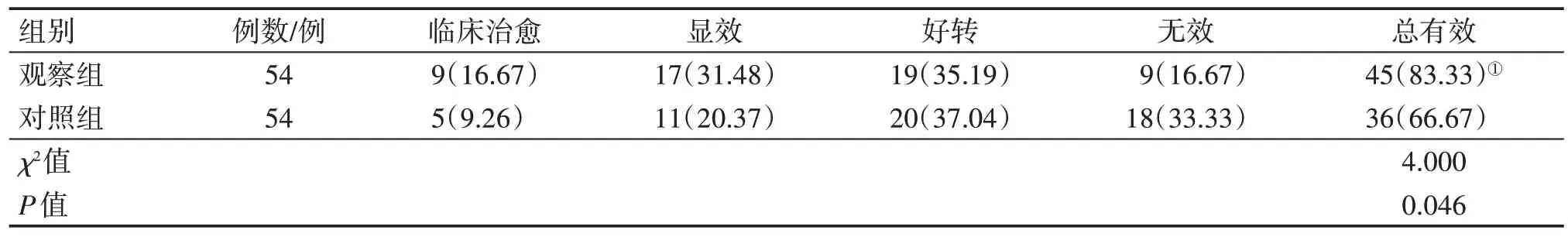
表2 2组脊髓损伤(SCI)患者临床疗效比较Table 2 Comparison of clinical efficacy between the two groups of spinal cord injury(SCI)patients[例(%)]
2.3 2组患者治疗后的康复效果指标比较表3结果显示:治疗后,观察组的肌力恢复正常时间、可下地行走时间及留院观察时间均较对照组明显缩短,差异均有统计学意义(P<0.01)。
表3 2组脊髓损伤(SCI)患者治疗后的康复效果指标比较Table 3 Comparison of rehabilitation effect indicators between the two groups of spinal cord injury(SCI)patients (± s,d)

表3 2组脊髓损伤(SCI)患者治疗后的康复效果指标比较Table 3 Comparison of rehabilitation effect indicators between the two groups of spinal cord injury(SCI)patients (± s,d)
注:①P<0.01,与对照组比较
?
2.4 2 组患者治疗前后ASIA评分比较表4 结果显示:经重复测量方差分析,2 组患者治疗前后ASIA 各项评分均存在组间效应、时间效应和交互效应(P<0.001)。具体表现为:治疗前,2 组患者ASIA 的痛觉、运动、触觉评分比较,差异均无统计学意义(P>0.05)。治疗1 个和2 个疗程后,2 组患者ASIA 的痛觉、运动、触觉评分均较治疗前明显升高(P<0.05),且治疗2 个疗程后又均较治疗1 个疗程后升高(P<0.05);组间比较,观察组在治疗1 个和2 个疗程后对ASIA 的痛觉、运动、触觉评分的升高幅度均明显优于对照组,差异均有统计学意义(P<0.05)。
表4 2组脊髓损伤(SCI)患者治疗前后美国脊柱损伤协会(ASIA)评分比较Table 4 Comparison of American Spinal Injury Association(ASIA)scores between the two groups of spinal cord injury(SCI)patients before and after treatment (± s,分)
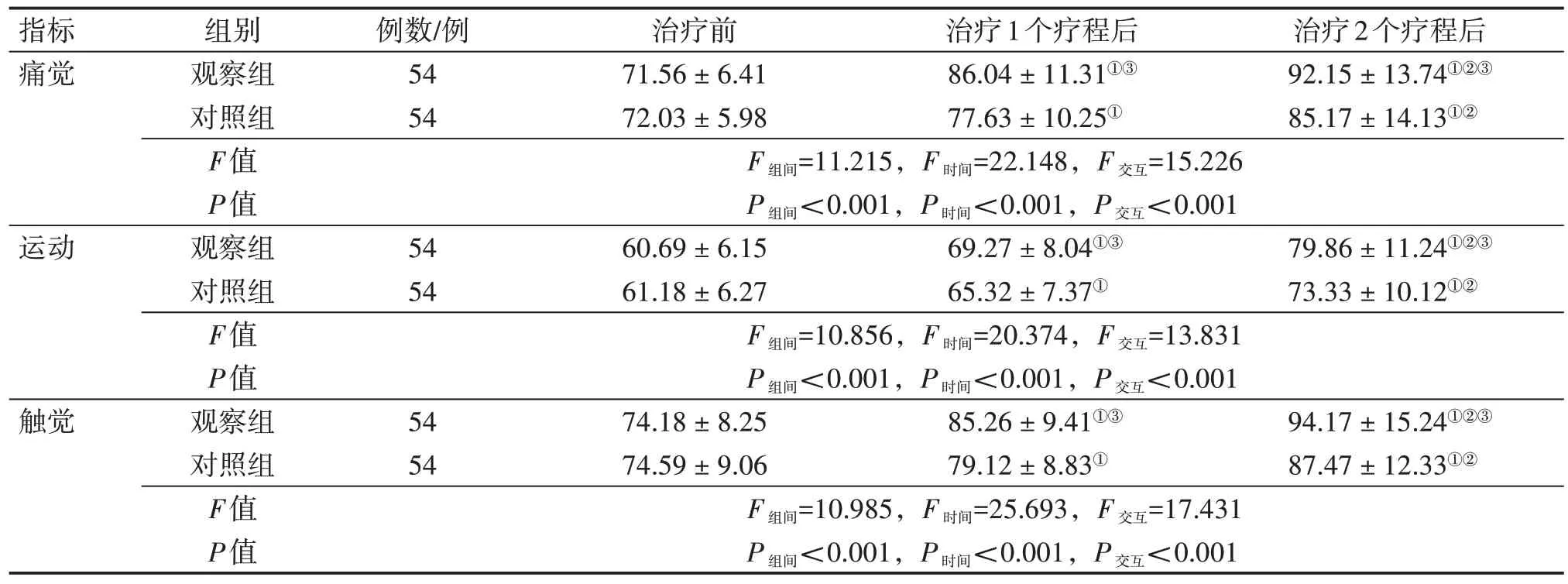
表4 2组脊髓损伤(SCI)患者治疗前后美国脊柱损伤协会(ASIA)评分比较Table 4 Comparison of American Spinal Injury Association(ASIA)scores between the two groups of spinal cord injury(SCI)patients before and after treatment (± s,分)
注:①P<0.05,与治疗前比较;②P<0.05,与治疗1个疗程后比较;③P<0.05,与对照组同期比较
?
2.5 2 组患者治疗前后血清BDNF、S-100β 水平比较表5 结果显示:经重复测量方差分析,2 组患者治疗前后血清BDNF、S-100β 水平均存在组间效应、时间效应和交互效应(P<0.001)。具体表现为:治疗前,2 组患者血清BDNF、S-100β 水平比较,差异均无统计学意义(P>0.05)。治疗1 个和2 个疗程后,2 组患者的血清BDNF 水平均较治疗前升高(P<0.05),S-100β 水平均较治疗前下降(P<0.05),且治疗2个疗程后血清BDNF水平又均较治疗1 个疗程后升高(P<0.05),血清S-100β 水平又均较治疗1 个疗程后下降(P<0.05);组间比较,观察组在治疗1 个和2 个疗程后对血清BDNF水平的升高幅度及对血清S-100β 水平的下降幅度均明显优于对照组,差异均有统计学意义(P<0.05)。
表5 2组脊髓损伤(SCI)患者治疗前后血清BDNF、S-100β水平比较Table 5 Comparison of serum BDNF and S-100β levels between the two groups of spinal cord injury(SCI)patients before and after treatment[± s,(µg·L-1)]
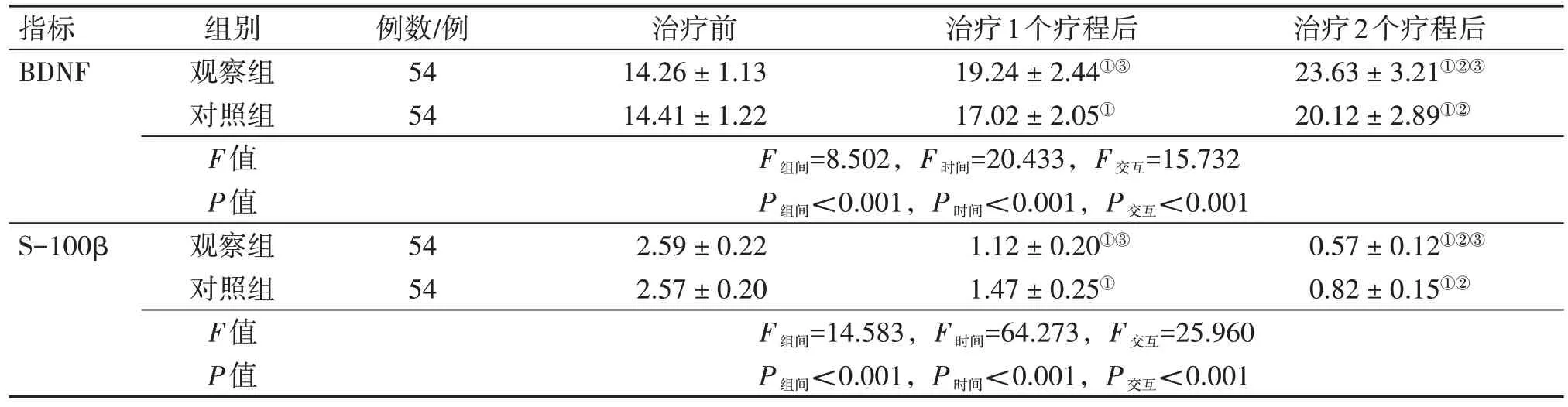
表5 2组脊髓损伤(SCI)患者治疗前后血清BDNF、S-100β水平比较Table 5 Comparison of serum BDNF and S-100β levels between the two groups of spinal cord injury(SCI)patients before and after treatment[± s,(µg·L-1)]
注:BDNF:脑源性神经生长因子;S-100β:中枢神经特异性蛋白。①P<0.05,与治疗前比较;②P<0.05,与治疗1个疗程后比较;③P<0.05,与对照组同期比较
?
2.6 2 组患者治疗前后NLRP3 信号通路相关蛋白表达及因子水平比较表6结果显示:经重复测量方差分析,2组患者治疗前后NLRP3信号通路的相关蛋白表达及因子水平均存在组间效应、时间效应和交互效应(P<0.001)。具体表现为:治疗前,2 组患者的NLRP3、ACS、Caspase-1 蛋白及血清IL-1β、IL-18 水平比较,差异均无统计学意义(P>0.05)。治疗1 个和2 个疗程后,2 组患者的NLRP3、ACS、Caspase-1蛋白及血清IL-1β、IL-18水平均较治疗前明显下降(P<0.05),且治疗2 个疗程后又均较治疗1 个疗程后下降(P<0.05);组间比较,观察组在治疗1 个和2 个疗程后对NLRP3、ACS、Caspase-1蛋白及血清IL-1β、IL-18水平的下降幅度均明显优于对照组,差异均有统计学意义(P<0.05)。
表6 2组脊髓损伤(SCI)患者治疗前后NLRP3信号通路相关蛋白及因子水平比较Table 6 Comparison of the levels of NLRP3 signaling pathway-related proteins and factors between the two groups of spinal cord injury(SCI)patients before and after treatment (± s)
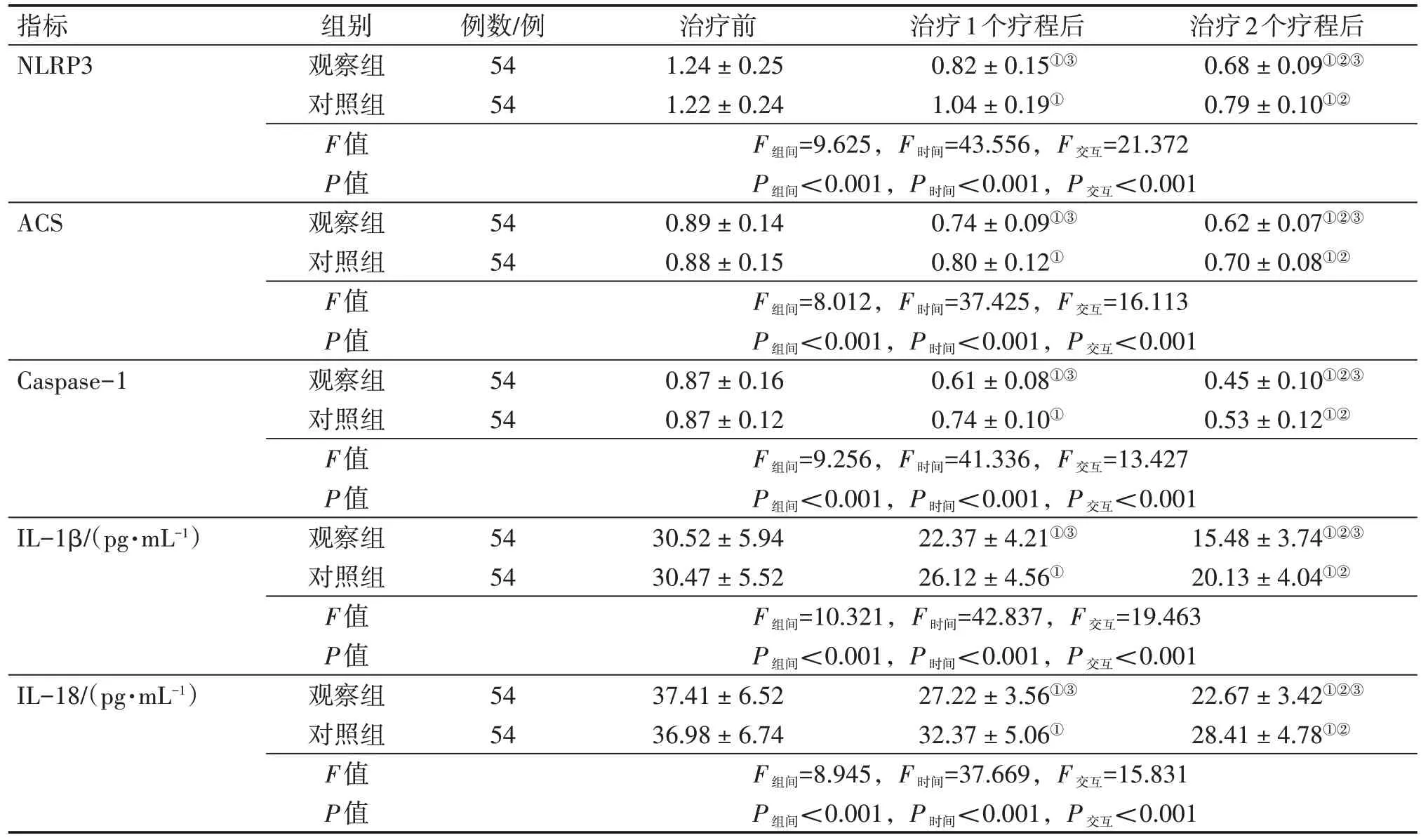
表6 2组脊髓损伤(SCI)患者治疗前后NLRP3信号通路相关蛋白及因子水平比较Table 6 Comparison of the levels of NLRP3 signaling pathway-related proteins and factors between the two groups of spinal cord injury(SCI)patients before and after treatment (± s)
注:NLRP3:NOD 样受体热蛋白结构域相关蛋白3;ACS:凋亡相关斑点样蛋白;Caspase-1:半胱氨酸蛋白酶1;IL-1β:白细胞介素1β;IL-18:白细胞介素18。①P<0.05,与治疗前比较;②P<0.05,与治疗1 个疗程后比较;③P<0.05,与对照组同期比较
?
2.7 安全性评价治疗过程中,2 组患者均未出现药物相关不良反应,具有较高的安全性。
3 讨论
近年来,随着经济的快速发展、交通工具的逐渐普及,各类工业及交通事故发生率逐年升高,致使脊髓损伤(SCI)患病人数不断攀升[13-14]。SCI患者术后2~6 个月为神经功能的最佳恢复时期,此时进行康复训练,可加速神经功能重建、重组,促使神经功能康复[15]。随着临床研究的不断深入,发现对于因炎症等因素造成的继发性脊髓损害,单纯系统康复训练治疗具有一定局限性,仍需配合药物辅助治疗[16]。
神经节苷脂作为一种细胞膜构成成分,是中枢神经组织内含量较为丰富的神经发育必要物质。研究[17]指出,神经节苷脂可加速神经细胞分化,促进轴突再生,保护细胞膜,有利于神经功能可塑性恢复。天麻素注射液的主要成分天麻素进入人体后,可水解成为天麻苷元,进入血脑屏障,可用于治疗神经衰弱、偏头痛、坐骨神经痛等多种神经系统疾病。现代药理学研究[18]证实,天麻素具有抑制神经胶质细胞活性、抗细胞凋亡、减轻炎症反应及抗氧化等作用,在神经损伤后的病理生理过程中的多个环节发挥保护作用,其可改善微环境,启动神经生长相关基因表达,同时还可对神经元凋亡发挥抑制作用,进而促进神经元恢复。本研究结果显示:在临床疗效方面,对于观察组的SCI患者,予以神经节苷脂联合天麻素注射液治疗,患者的临床总有效率为83.33%(45/54),明显高于对照组的66.67%(36/54),且观察组的肌力恢复正常时间、可下地行走时间及留院观察时间均较对照组明显缩短,治疗1 个和2 个疗程后美国脊柱损伤学会(ASIA)的痛觉、运动、触觉评分均较对照组明显升高,差异均有统计学意义(P<0.05或P<0.01)。充分说明天麻素注射液联合神经节苷脂辅助治疗SCI可促进患者功能恢复,缩短康复进程,效果更为显著。
SCI 继发性损伤造成的持久、弥漫性损伤,可破坏胶质细胞与神经细胞,并引起进行性神经变性及迟发性细胞死亡,最终导致损伤部位扩大,甚至造成脊髓更高节段的损伤。炎症作为中枢神经系统先天免疫反应之一,在组织损伤后的中枢神经系统病理生理中发挥重要作用,在SCI继发损伤中扮演重要角色[19]。炎症反应的启动与炎症小体NLRP3 信号通路密切相关[20]。NOD 样受体热蛋白结构域相关蛋白3(NLRP3)炎症小体作为一种多蛋白活性复合物,其组成成分中NLRP3 作为细胞内传感器,半胱氨酸蛋白酶1(Caspase-1)作为效应体,而凋亡相关斑点样蛋白(ACS)则为接头蛋白,其炎症小体可经活化Caspase-1,致使白细胞介素(IL)1β、IL-18 前体裂解为成熟的IL-1β、IL-18,进而引起一系列炎症反应[21]。已有研究[22-23]证实,炎症小体NLRP3 信号通路的激活可通过调节神经炎症反应,参与SCI后继发性损伤。为探究天麻素注射液联合神经节苷脂治疗SCI的作用机制,本研究进一步检测SCI患者NLRP3信号通路相关蛋白表达及因子水平,结果显示:治疗1 个及2 个疗程后,2组患者的NLRP3、ACS、Caspase-1 蛋白及血清IL-1β、IL-18 水平均较治疗前显著下降,且观察组的下降幅度均明显优于对照组,差异均有统计学意义(P<0.05),充分说明天麻素注射液联合神经节苷脂辅助治疗SCI,可显著减轻患者神经炎症反应。此外,在本研究中,观察组治疗1个及2 个疗程后的血清脑源性神经生长因子(BDNF)水平明显低于对照组,血清中枢神经特异性蛋白(S-100β)水平明显高于对照组,差异均有统计学意义(P<0.05),这亦从血清层面进一步证实天麻素注射液联合神经节苷脂辅助治疗SCI可促进患者神经功能恢复。综合上述结果,本研究认为天麻素注射液联合神经节苷脂可通过调控炎症小体NLRP3 信号通路,减轻神经炎症反应,促进神经功能恢复。其原因分析如下:(1)神经节苷脂可促进脊髓神经轴突再生,促进神经元再生,反馈性调节神经炎症[24];(2)天麻素注射液可使损伤区域外周血管阻力下降,动脉血管顺应性增加,抑制早期炎性渗出,拮抗兴奋性氨基酸神经毒性,从而干预神经损伤的多个环节,改善脑微环境,减少细胞凋亡,减缓损伤后神经元死亡速度,促进神经功能恢复[25]。
综上所述,天麻素注射液联合神经节苷脂治疗SCI患者疗效确切,可通过调控炎症小体NLRP3信号通路,减轻神经炎症反应,促进神经功能恢复,其疗效优于单纯神经节苷脂治疗。但由于人力资源及科研经费不足等原因,本研究尚未开展相关基础研究,因此,确切的结论有待今后进一步的研究证实。

