红茶菌发酵液宏基因组分析
赵平 刘庆静 杨光 郭莹莹 邹积宏

摘要 对3个发酵批次的红茶菌发酵液进行宏基因组序列分析,采用数据库进行比对,发现红茶菌发酵液中存在短乳杆菌、植物乳杆菌、食窦魏斯氏菌、发酵乳杆菌、戊糖乳杆菌、融合魏斯氏菌、罗伊氏乳杆菌、柠檬明串珠菌、类植物乳杆、副干酪乳杆菌、乳酸片球菌等具有益生功能的细菌。宏基因组注释到的功能基因共有76 512个,其中与代谢过程注释到的功能基因数最多,且这些代谢途径上注释得到的菌株多数是益生菌株,主要参与了与碳水化合物代谢相关的三羧酸循环、柠檬酸循环、磷酸戊糖途径、糖酵解等;与氨基酸代谢相关主要有丙氨酸、天冬氨酸和谷氨酸代谢途径、甘氨酸、丝氨酸和苏氨酸等代谢途径。
关键词 红茶菌;益生菌;宏基因组;分析
中图分类号 TS272.7 文献标识码 A 文章编号 0517-6611(2024)09-0071-08
doi:10.3969/j.issn.0517-6611.2024.09.016
开放科学(资源服务)标识码(OSID):
Metagenomic Analysis of Kombucha Fermentation Broth
ZHAO Ping1,LIU Qing-jing2, YANG Guang3 et al
(1.Heilongjiang Green Food Science Research Institute, Harbin, Heilongjiang 150028;2.Heilongjiang University, Harbin, Heilongjiang 150008;3.Quality Supervision and Testing Institute of Heilongjiang Province, Harbin, Heilongjiang 150028)
Abstract The metagenomic sequence analysis of the fermentation broth of three fermentation batches of kombucha was carried out, and the database was used for comparison. It was found that there were mainly Lactobacillus brevis, Lactobacillus plantarum, Weisseria sinusosus, Lactobacillus fermentatum, Lactobacillus pentosus, Weisseria fused, Lactobacillus reuteri, Nebulococci citronicum, Lactobacillus paracasei, Lococci lactate and other bacteria with probiotic function in the fermentation broth of tea fungus. A total of 76 512 functional genes were annotated by metagenomes, among which the most functional genes were annotated by metabolic processes. Most of the strains annotated by these metabolic pathways were probiotic strains, which were mainly involved in the tricarboxylic acid cycle, citric acid cycle, pentose phosphate pathway, glycolysis and so on related to carbohydrate metabolism. The metabolic pathways of alanine, aspartate and glutamate, glycine, serine and threonine are mainly related to amino acid metabolism.
Key words Kombucha;Probiotics;Metagenome;Analysis
基金项目 国家市场监督管理总局技术保障专项项目(2020YJ010);黑龙江省财政支持项目。
作者简介 赵平(1985—),男,黑龙江哈尔滨人,副研究员,从事生物产品开发、食品微生物检测研究。
*通信作者,教授,从事食品和药物物质功能的挖掘及开发研究。
收稿日期 2023-06-02;修回日期 2023-07-08
红茶菌是民间用茶糖水与微生物培育菌苔或菌液而成,因多用红茶,菌液呈红色而得名。由于自然发酵过程而产生对人体有益的活性物质,不仅留有红茶本身的饮用价值,而且还具有独特的保健作用,曾风靡一时作为饮品流行至今[1]。红茶菌液发酵一定时间后,会形成苔状似海蜇皮,又称“海宝”[2]、“红茶菇”等[3-4]。红茶菌最早发现于约公元前220年,因具有解毒提神、助消化、抑菌、抗氧化、护肝、防癌、抗癌、降血糖、降血脂、調节血压、分解有毒物质等药用价值被视为珍宝,称为“胃宝”[5-24]。
红茶菌的菌群结构、发酵产物和化学成分随着现代分子生物学技术的快速发展而被逐步深入研究。目前研究表明,红茶菌是由多年来人工培养驯化多种共生益生菌组成,其中包括细菌和真菌[25]。在我国红茶菌虽然有很长的饮用历史,但仍停留在作坊式阶段,易染杂菌、风味变化大等问题导致无市场竞争力[26]。因此,探索红茶菌发酵液中微生物的群落结构,从基因层面解释微生物与发酵液风味及安全性之间的联系十分重要。近年来,宏基因组(Metagenome)测序广泛应用于奶酪、普洱茶、可可豆、发酵香肠、酒、酱油、食醋等发酵食品,且取得了一系列的研究成果,这对研究菌群结构及挖掘其功能基因至关重要[27]。
笔者利用宏基因组学,对红茶菌发酵液中微生物进行测序,对结果序列进行优化、组装、去冗余后注释物种,对微生物的群落结构、功能基因、代谢通路进行探索,从基因层面探讨微生物与红茶菌发酵液中的碳水化合物、氨基酸等代谢通路,阐明微生物在风味物质产生与形成过程中的作用。
1 材料与方法
1.1 主要材料
红茶菌,黑龙江质量监督检测研究院微生物与分子生物学检测研究中心保藏。
1.2 主要仪器和设备
AOEA580型HiSeq 2 500 高通量测序系统,美国 Illumina 公司;2266型洁净工作台,上海拜艾斯净化设备有限公司。
1.3 试验方法
1.3.1 样品检测。
分别取3批次实验室发酵7 d所得的红茶菌发酵液,进行宏基因组测序。
1.3.2 测序数据预处理及质量评估。
测序数据预处理后将符合要求的产物用 Illumina HiSeq 高通量测序平台进行测序。筛查下机的原始数据质量,去除非目的序列,获得高质量可用于宏基因组分析的数据集(Clean data),再对筛查出的Clean data拼接、校正与组装,构建宏基因组叠连群(Contigs)序列集,进行去冗余基因预测,获得非冗余氨基酸序列集,用于后续分析。
1.3.3 红茶菌微生物多样性分析。
物种α分析时首先对全体样本种水平的组成谱,在最低测序深度下进行随机重抽样,从而校正测序深度引起的多样性差异。随后,利用QIIME软件计算每个样本上述4种多样性指数(Chao1、ACE、Shannon、Simpson),对各样本在不同测序深度下的种水平丰度分布随机抽样,以各深度下抽取到的序列数与其对应的物种数绘制稀疏曲线。β多样性分析法,主要采用主成分分析法,通过QIIME和R软件对样本进行PCA分析,并描述样本间的差异分布特征。根据各样本在种水平的组成谱,使用R软件可计算共有、独有物种的数量,并通过Venn图直观地呈现各样本所共有和独有的物种数量。
1.3.4 红茶菌微生物功能基因分析。
1.3.4.1 红茶菌eggNOG数据库注释。
将预测得到的蛋白序列集与EggNOG数据库(http://eggnog.embl.de/version_5.0/,v5.0)的参考蛋白序列进行比对。比对软件使用MMseqs2,设置灵敏度参数为5.7,选择alignment得分最高的参考蛋白序列作为比对结果。通过eggnog-mapper将比对结果映射到EggNOG的数据库中,提取其分类信息及后续的GO注释结果。将注释得到的eggNOG结果及基因的丰度矩阵整合,可以获取各蛋白对应的eggNOG直系同源基因簇的丰度。再根据每个直系同源基因簇所属的分类就能统计不同水平的EggNOG功能类群丰度。
1.3.4.2 红茶菌KEGG代谢通路注释。
将预测得到的蛋白序列集与KOBAS软件的蛋白数据库(v2020_10_20)进行相似比对,比对软件使用MMseqs2,设置灵敏度参数为5.7,选择alignment得分最高的参考蛋白序列作为比对结果。KOBAS参考序列带有KO注释,通过将蛋白序列与之比对,即可获得蛋白序列的KO信息。将注释得到的KO结果及基因的丰度矩阵整合,可以获取各蛋白对应的KO丰度。最后再使用MinPath推断存在的代谢通路(KEGG pathway),并统计其丰度。
1.3.4.3 红茶菌GO功能注释。
蛋白编码基因的GO注释采用eggnog-mapper软件完成,得到的GO编号通过map2slim得到GOSlim注释结果,这一注释过程参考了记录GO信息的go-basic.obo文件(http://purl.obolibrary.org/obo/go/go-basic.obo)。将注释得到的GO结果及基因丰度矩阵整合,可以获取各蛋白对应的GO丰度。再根据每个GO所属的分类,可以统计不同水平的GO功能类群丰度。
1.3.4.4 红茶菌CAZy功能注释。
将预测得到的蛋白序列集与dbCAN(DataBase for automated Carbohydrate-active enzyme Annotation)中的参考蛋白序列(v2021_09_24)进行相似比对。比对软件使用MMseqs2,设置灵敏度参数为5.7,选择alignment得分最高的参考蛋白序列作为比对结果。将注释得到的CAZy功能类群结果及基因的丰度矩阵整合,可以获取各蛋白对应的CAZy酶家族的丰度。再依据酶所属的功能模块统计不同模块的CAZy酶家族丰度。
2 结果与分析
2.1 红茶菌微生物物种丰度及多样性
2.1.1 物种丰度。
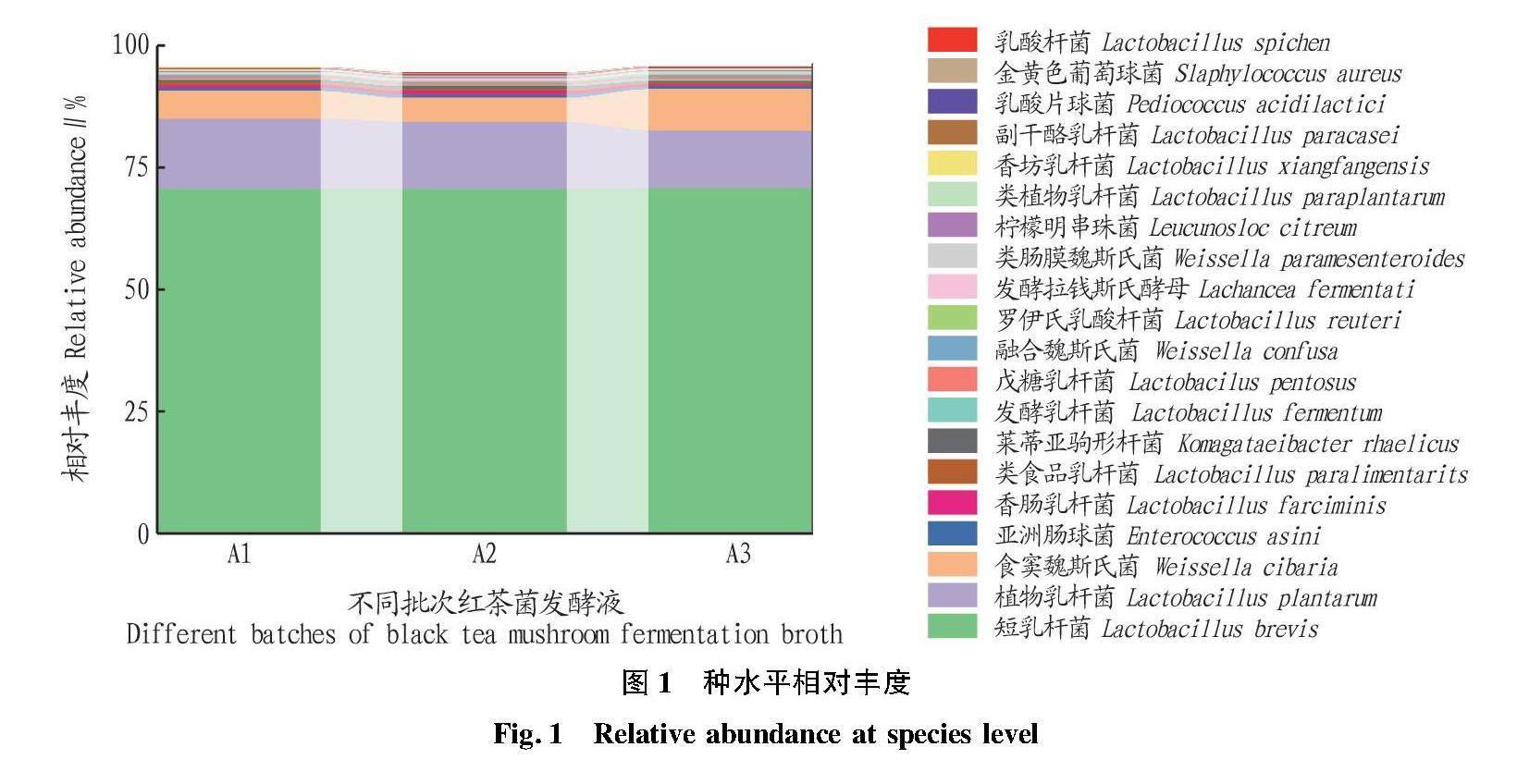
图1为选取种水平上的相对丰度柱状图,可直观反映出A1、A2、A3种水平上丰度排名前20的物种及比例。由图1可知,3个样品主要包括短乳杆菌、植物乳杆菌、食窦魏斯氏菌、亚洲肠球菌、香肠乳杆菌等。其中,短乳杆菌丰度最高,占总菌数的70.46%,A1、A2、A3中短乳杆菌分别占70.48%、70.34%、70.57%,说明发酵不同批次的短乳杆菌丰度差异较小,也再次证明了红茶菌发酵工艺的稳定性。红茶菌发酵液中还包含植物乳杆菌、食窦魏斯氏菌、亚洲肠球菌,分别占总菌数的13.34%、3.19%、0.65%,除此之外還有香肠乳杆菌、类食品乳杆菌、莱蒂亚驹形杆菌等。表1为对应图1整理出的相对丰度前十并被世界公认的益生菌。益生菌是一类对人体有益,可在肠道定殖并在肠道具有益生功能的一类微生物。由表1可知,红茶菌中的益生菌主要集中在短乳杆菌、植物乳杆菌、类植物乳杆菌、发酵乳杆菌,在人体中主要起抑菌、降胆固醇、调节机体免疫、维持肠道菌群等作用;食窦魏斯氏菌、副干酪乳杆菌、乳酸片球菌主要起抗氧化作用;戊糖乳杆菌可降血脂血糖、降尿酸,罗伊氏乳杆菌也可防溃疡、缓解过敏等症状。
2.1.2 Alpha 多样性。
为比较3个发酵批次红茶菌发酵液的多样性与丰富度,对Alpha多样性指数进行比较分析,结果见表2和图2。由表2和图2可知,3个样本中,A3样本菌群中实际存在的物种数最多,菌群丰度和多样性指数相对较高,A2的Simpson指数最高,这说明红茶菌菌种稳定,发酵条件控制较好。
2.1.3 Beta 多样性。
β多样性分析主要用于从菌群功能以及物种组成2个层面考察样本之间的差异。对宏基因组样本在数据库中注释得到的种水平的组成谱分别进行PCA分析。PCA分析将原始的高维数据通过线性变换组合,投影到维度较低的空间坐标系(即主成分)中,从而达到降维、简化数据结构的目的,展现样本的自然分布,样品的组成越
近,在PCA图中反映的距离就越近(图3)。前2个主成分
贡献率分别是96.11%、3.89%,符合主成分分析要求。图中3个点之间距离较近,表明2个样本的物种组差异较小,有较高相似度。Venn图显示,3个样本之间存在组间差异,但差异较小。
2.2 红茶菌发酵液微生物功能基因
2.2.1 eggNOG数据库功能注释。
为了探索红茶菌发酵液微生物群落的遗传组成和功能,利用eggNOG数据库序列对宏基因组学鉴定的基因进行了分析,由图4可知,共有19 390个基因被注释。从图4中可观察到代谢功能较为丰富,说明发酵液中微生物代谢较为旺盛,是与发酵液风味形成最直接的功能分类,共有5 607条基因被注释,其中氨基酸运输和代谢(1 351个基因,6.97%)、能量生产和转化(920个基因,4.74%)和碳水化合物运输和代谢(1 638个基因,8.45%)是前三大功能分类,说明氨基酸代谢与碳水化合物代谢均是发酵的重要过程,功能不明为 4 770条,占 24.60%。
2.2.2 KEGG数据库功能注释。
将KEGG 代谢通路与蛋白序列利用数据库进行比对,可以对预测得到的基因进行代谢通路注释分类,具体信息如图5所示。从图5可知,红茶菌发酵液在糖代谢(carbohydrate metabolism)、氨基酸代谢(amino acid metabolism)和核苷酸代谢(nucleotide metabolism)中发挥重要作用,并且碳水化合物相关的基因数目最多,高达2 971条。注释到翻译(translation)和复制和修复(replication and repair)的基因占遗传信息分类基因比例高达80.69%。发酵液中在 KEGG 代谢通路注释信息统计结果见表3。由表3可知,与新陈代谢相关的基因数高达10 087条,其次为遗传信息传递(2 211)、环境信息处理(1 800)、人类疾病(925)、细胞过程(878)、生物体系统(512),表明在发酵过程中发酵液中的微生物具有代谢活动旺盛的特点。
2.2.3 GO数据库功能注释。
基于GO数据库对发酵液样品功能统计结果如圖6所示,注释到53个功能类别共有38 309个基因。其中,生物学途径(biological process)包括26个分支,代谢过程(metabolic process)、细胞过程(cellular process)、发育(growth)注释到的基因数目排名前3,分别为4 055(28.13%)、3 996(27.72%)、1 034(7.17%)个;细胞组件(cellular component)包括17个功能类别,细胞(cell)和细胞部分(cell part)共注释到11 971条基因,占该部分的83.06%;催化活性(catalytic activity)在分子功能(molecular function)中注释到3 160条基因。
2.2.4 CAZy 蛋白功能注释。
图7为CAZy 数据库的具体注释信息。由图7可知,CAZy 数据库将这些碳水化合物活性酶分为六大蛋白功能模块:辅助氧化还原酶(AA)、碳水化合物酯酶(CE)、糖苷水解酶(GH)、糖基转移酶(GT)、多糖裂解酶(PL)以及碳水化合物结合模块(CBM)。碳水化合物活性酶中GH的占比最高,其次为GT。GH可以分解碳水化合物分子之间的糖苷键,在生物体中多糖的水解和合成中发挥重要作用。GT则能够催化活化的糖连接到蛋白、核酸、寡糖等不同的受体分子上产生具有很多生物学功能的糖基化产物。
2.3 营养风味物质代谢通路
2.3.1 碳水化合物相关代谢通路及途径。
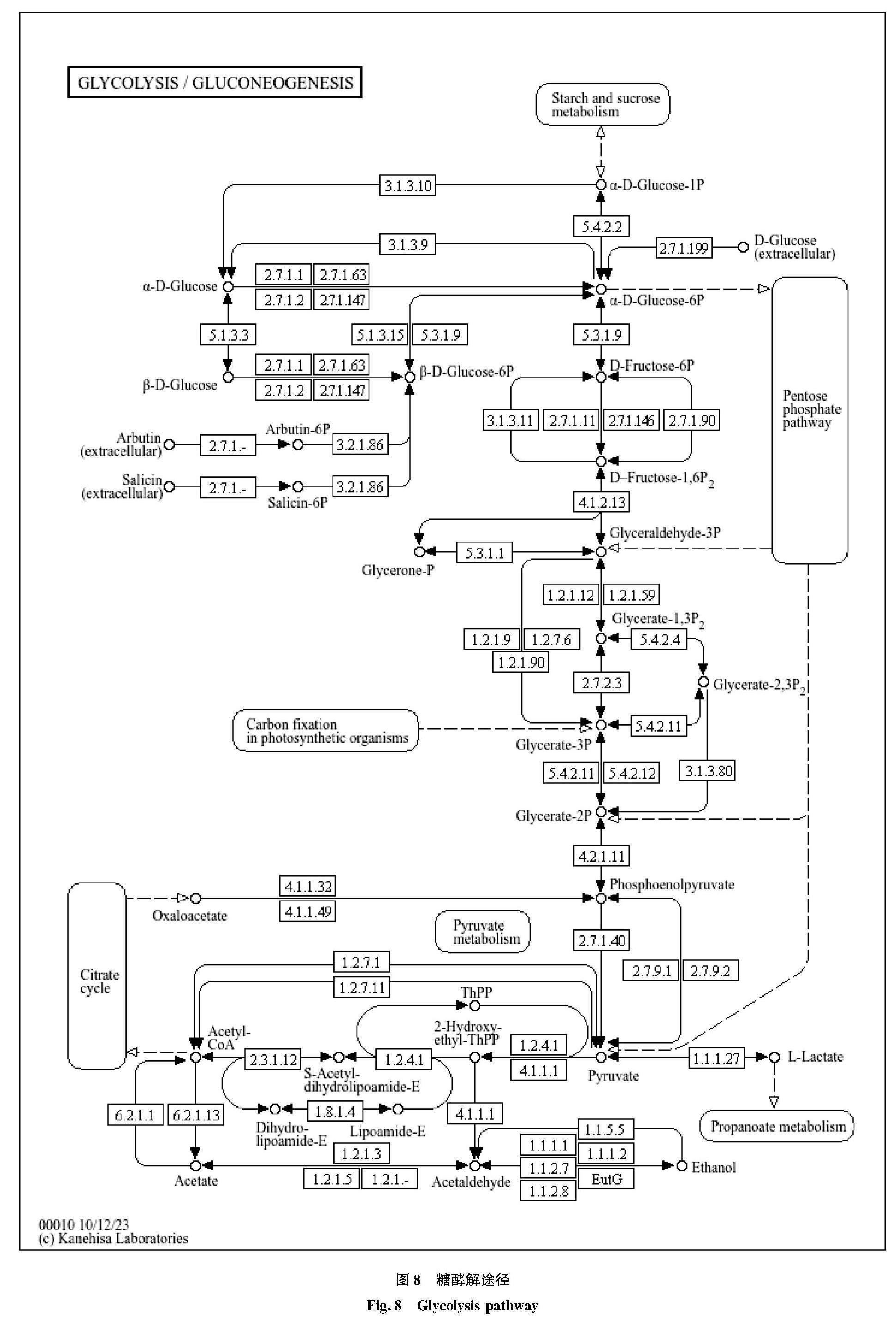
通过KEGG注释结果可知,注释到碳水化合物代谢相关基因高达2 971条,碳水化合物是发酵液中发挥营养作用的主要物质。表4中序号从大到小所注释到的基因数越来越少,注释到糖酵解/糖异生的基因数在碳水化合物代谢途径中最丰富,因为红茶菌发酵液中都含有糖类物质,分解为葡萄糖后通过糖酵解途径生成发酵中产物乳酸(如图8所示),乳酸对许多发酵食品的风味形成有重要影响,除乳酸外,甲酸、乙醇乙酸和二氧化碳等也是糖酵解途径的主要产物。此外,4-磷酸赤鲜糖和磷酸烯醇式丙酮酸也能参与芳香族氨基酸的合成。 另外,柠檬酸循环也是碳水化合物代谢中的主要途径。研究表明,某些微生物能通过柠檬酸水解酶将柠檬酸转化为草酰乙酸和乙酸酯,进而产生乙酸等风味物质。此外,柠檬酸代谢中间产物也能够参与氨基酸代谢途径合成氨基酸等风味物质。
2.3.2 氨基酸代谢相关代谢通路及途径。
氨基酸代谢是风味形成途径中最关键的途径之一。KEGG 代谢通路注释到的氨基酸代谢途径见表5。在红茶菌发酵过程中,代谢较为活跃的是天冬氨酸、谷氨酸和丙氨酸。由图9可知,天冬氨酸、谷氨酸和丙氨酸之间能够互相转化,谷氨酸与草酰乙酸在天冬氨酸转氨酶催化下转氨基可形成天冬氨酸。而在氨基酸合成中,都是以天冬氨酸为前体。另外,谷氨酸在丙氨酸转氨酶的催化作用下可与丙酮酸形成 α-酮戊二酸和丙氨酸,而乙偶姻和双乙酰等物质可经丙氨酸或天冬氨酸进一步分解代谢生成,而且谷氨酸经脱羧后能形成一种抑制性神经递质——γ-氨基丁酸。 其次是丝氨酸、苏氨酸和甘氨酸代谢,其中苏氨酸和丝氨酸可参与合成蛋氨酸和甘氨酸,而甘氨酸会形成丙酮酸,从而促进产生乙醇与乙酸等风味物质。红茶菌发酵过程中,异亮氨酸、亮氨酸和缬氨酸等支链氨基酸降解途径的相对丰度逐渐降低,色氨酸、酪氨酸和苯丙氨酸等芳香氨基酸代谢途径的相对丰度也逐渐降低。研究表明,支链氨基酸经脱羧与转氨后,可还原为 2-甲基丁醇、异丁醇和乙酸异戊酯等风味物质。而苯香草醛、苯乙酸、乙醛和苯乳酸等风味物质的前体物质主要为苯丙氨酸,酪氨酸降解可形成苯酚。
3 结论
通过对红茶菌发酵液微生物功能基因注释结果可知,新陈代谢被注释的基因数最多,且新陈代谢决定着红茶菌发酵液的风味和营养。该研究与 KEGG数据库进行比对,找出红茶菌发酵液中主要营养成分及风味物质的代谢通路,并对关键代谢通路中的酶、基因、微生物等进行分析,从基因层面,揭示发酵液风味与微生物及安全性之间的联系,为红茶菌发酵液风味物质的形成机制提供参考。另外,发酵液中还发现了少量的真菌与噬菌体病毒,大多为发酵液中常见的微生物,如接合酵母菌属(Zygosaccharomyces)添加到酱油酿造过程中,显著提高酱油的风味物质成分;片球菌属(Pediococcus)具有产生多种胞外多糖酶,提高抗氧化等作用。
通过对发酵液中微生物 KEGG 注释的功能基因进行分析得知,注释功能最多的是代谢方面,其中参与碳水化合物代谢途径相关的基因含量最多,氨基酸次之,得到相关代谢通路的具体信息,发现发酵乳杆菌、植物乳杆菌、短乳杆菌、食窦魏斯氏菌是红茶菌发酵液中风味物质的关键菌种,说明该代谢通路微生物活动最为旺盛,这也是构成红茶菌发酵液风味物质的主要成分。试验结果表明,通过 KEGG 代谢通路,注释到的功能基因在Nr 数据库中能够匹配到相应的菌种,但在发酵液中未找到该菌种,说明在菌种鉴定领域宏基因组数据库存在着局限性。在基因组测序研究中还需更完善的数据库及测序技术来完成研究。
参考文献
[1] 徐家豪,林静嫦,张舒宁,等.柑橘红茶菌饮料发酵工艺的优化[J].现代食品科技,2022,38(4):106-113,274.
[2] 赵平,郭莹莹,杨光,等.红茶菌研究现状[J].现代食品,2020(21):1-4.
[3] 吕晴.以藜麦为基料的红茶菌发酵工艺及抗氧化活性研究[D].天津:天津农学院,2020.
[4] LAUREYS D,BRITTON S J,DE CLIPPELEER J.Kombucha tea fermentation:A review[J].Journal of the American society of brewing chemists,2020,78(3):165-174.
[5] 王國增,林娟,叶秀云,等.“红茶菌”的抑菌作用及抗氧化性[J].中国食品学报,2015,15(9):173-179.
[6] BHATTACHARYA D,GHOSH D,BHATTACHARYA S,et al.Antibacterial activity of polyphenolic fraction of Kombucha against Vibrio cholerae:Targeting cell membrane[J].Lett Appl Microbiol,2018,66(2):145-152.
[7] 申瑞瑞,李亚柯,王伯华.红茶菌发酵液抑菌活性的研究[J].湖南文理学院学报(自然科学版),2013,25(4):29-32.
[8] 王恩智,缪汉强,周新辉,等.茶多酚对金黄色葡萄球菌的抑制作用[J].中国药师,2010,13(5):740-742.
[9] WATAWANA M I,JAYAWARDENA N,GUNAWARDHANA C B,et al.Health,wellness,and safety aspects of the consumption of Kombucha[J].J Chem,2015,2015:1-11.
[10] CHOW R,BRUERA E,CHIU L,et al.Enteral and parenteral nutrition in cancer patients:A systematic review and meta-analysis[J].Ann Palliat Med,2016,5(1):30-41.
[11] 俸毅,张伟敏,蒋盛军,等.红茶菌饮料澄清度与抗氧化性能力的研究[J].茶叶科学,2009,29(6):426-429.
[12] JAYABALAN R,MALINI K,SATHISHKUMAR M,et al.Biochemical characteristics of tea fungus produced during Kombucha fermentation[J].Food Sci Biotechnol,2010,19(3):843-847.
[13] MARSH A J,OSULLIVAN O,HILL C,et al.Sequence-based analysis of the bacterial and fungal compositions of multiple Kombucha(tea fungus)samples[J].Food Microbiol,2014,38:171-178.
[14] WANG Y,JI B P,WU W,et al.Hepatoprotective effects of Kombucha tea:Identification of functional strains and quantification of functional components[J].J Sci Food Agric,2014,94(2):265-272.
[15] WATAWANA M I,JAYAWARDENA N,CHOO C,et al.RETRACTED:Application of the Kombucha ‘tea fungus for the enhancement of antioxidant and starch hydrolase inhibitory properties of ten herbal teas”[J].Food Chem,2016,194:304-311.
[16] 唐思颉,涂传海,胡文秀,等.红茶菌发酵黄浆水的体外抗氧化活性[J].食品科学,2019,40(17):1-6.
[17] S·RIHARI T,KARTHIKESAN K,ASHOKKUMAR N,et al.Antihyperglycaemic efficacy of kombucha in streptozotocin-induced rats[J].J Funct Food,2013,5(4):1794-1802.
[18] SHENOY C.Hypoglycemic activity of bio-tea in mice[J].Indian J Exp Biol,2000,38(3):278-279.
[19] BHATTACHARYA S,GACHHUI R,SIL P C.Effect of Kombucha,a fermented black tea in attenuating oxidative stress mediated tissue damage in alloxan induced diabetic rats[J].Food Chem Toxicol,2013,60:328-340.
[20] KALLEL L,DESSEAUX V,HAMDI M,et al.Insights into the fermentation biochemistry of Kombucha teas and potential impacts of Kombucha drinking on starch digestion[J].Food Res Int,2012,49(1):226-232.
[21] YANG Z W,JI B P,ZHOU F,et al.Hypocholesterolaemic and antioxidant effects of kombucha tea in high-cholesterol fed mice[J].J Sci Food Agric,2009,89(1):150-156.
[22] SOARES M G,DE LIMA M,REOLON SCHMIDT V C.Technological aspects of kombucha,its applications and the symbiotic culture(SCOBY),and extraction of compounds of interest:A literature review[J].Trends Food Sci Technol,2021,110:539-550.
[23] KIM Y,WEST G A,RAY G,et al.Layilin is critical for mediating hyaluronan 35kDa-induced intestinal epithelial tight junction protein ZO-1 in vitro and in vivo[J].Matrix Biol,2018,66:93-109.
[24] 張虎成,范海涛,杨国伟,等.红茶菌发酵液抑菌活性研究[J].安徽农业科学,2012,40(9):5340-5342.
[25] TRAN T,VERDIER F,MARTIN A,et al.Oxygen management during kombucha production:Roles of the matrix,microbial activity,and process parameters[J].Food Microbiol,2022,105:1-11.
[26] BORTOLOMEDI B M,PAGLARINI C S,BROD F C A.Bioactive compounds in kombucha:A review of substrate effect and fermentation conditions[J].Food Chem,2022,385:1-16.
[27] XIE M X,WU J,AN F,et al.An integrated metagenomic/metaproteomic investigation of microbiota in dajiang-meju,a traditional fermented soybean product in Northeast China[J].Food Res Int,2019,115:414-424.

