不同产地半夏主要药理作用分析
李超 申国玺 项丽玲 贾琦 张愈甜 黄显章

摘要 [目的]比較不同产地半夏主要药理作用,为半夏的质量评价和临床用药提供试验依据。[方法]分别对国内6个主产区(湖北天门、江苏南通、河南唐河、四川蓬溪、河北安国、贵州赫章)半夏进行主要药效研究,采用气管酚红排泌法、浓氨水引咳法、冰醋酸致小鼠扭体、二甲苯致小鼠耳肿胀试验方法建立痰液分泌模型、咳嗽模型、镇痛模型及炎症模型,探讨不同产地半夏的祛痰、镇咳、镇痛及抗炎作用的差异。[结果]在止咳祛痰作用方面,贵州赫章、江苏南通、四川蓬溪3个产区半夏能够明显增加小鼠气管酚红排泌量,显著减少小鼠咳嗽次数及延长咳嗽潜伏期(P<0.01);在镇痛抗炎作用方面,四川蓬溪、湖北天门、河南唐河3个产区半夏均能够明显延长疼痛潜伏期及减少扭体次数,显著降低小鼠耳肿胀度(P<0.01);贵州赫章、河北安国产半夏镇痛抗炎作用次之,江苏南通产半夏镇痛抗炎作用弱于其他产地。[结论]6个产区半夏均有不同程度的祛痰、镇咳、镇痛、抗炎作用,其中贵州赫章、江苏南通、四川蓬溪3个产区半夏在止咳祛痰作用明显优于湖北天门、河南唐河、河北安国;在镇痛抗炎作用方面,四川蓬溪、湖北天门所产半夏强于其他产地。
关键词 半夏;不同产地;祛痰;镇咳;镇痛;抗炎
中图分类号 R285 文献标识码 A 文章编号 0517-6611(2024)09-0147-05
doi:10.3969/j.issn.0517-6611.2024.09.033
开放科学(资源服务)标识码(OSID):
Analysis on the Main Pharmacological Effects of Pinellia ternata from Different Origins
LI Chao1, SHEN Guo-xi2, XIANG Li-ling1 et al
(1. Henan Key Laboratory of Zhang Zhongjing Formulae and Herbs for Immunoregulation, Nanyang Institute of Technology, Nanyang,Henan 473000;2.Henan Jinfangyuan Pharmaceutical Co. Ltd., Nanyang,Henan 473000)
Abstract [Objective]To compare the main pharmacological effects of Pinellia ternata from different origins, and provide experimental basis for the quality evaluation and clinical use of P. ternata. [Method]The main pharmacological effects of P. ternata from six major production areas in China (Tianmen City, Hubei Province;Nantong City, Jiangsu Province;Tanghe City, Henan Province;Pengxi City, Sichuan Province;Anguo City, Hebei Province and Hezhang City, Guizhou Province) were studied. The models of sputum secretion induced by guaifenesin, cough induced by concentrated ammonia solution, twisting body induced by acetic acid in mice, and ear swelling induced by xylene were established to investigate the differences in expectorant, antitussive, analgesic, and anti-inflammatory effects of P. ternata from different origins. [Result]In terms of antitussive and expectorant effects, P. ternata from Hezhang City, Nantong City and Pengxi City showed significant increased in the secretion of guaifenesin in mice, significantly reduced the number of coughs, and prolonged the cough latency period (P<0.01). In terms of analgesic and anti-inflammatory effects, the P. ternata produced in the Pengxi City, Tianmen City and Tanghe City could significantly prolong the pain latency period, reduced the number of body twists, and significantly reduced the ear swelling (P<0.01). The analgesic and anti-inflammatory effects of P. ternata produced in Hezhang City and Anguo City were secondary, while those produced in Nantong City had weaker analgesic and anti-inflammatory effects compared to other production areas. [Conclusion]All six production areas of P. ternata had varying degrees of expectorant, antitussive, analgesicand anti-inflammatory effects. Among them, P. ternata produced in Hezhang City, Nantong City and Pengxi City had significantly better antitussive and expectorant effects compared to P. ternata produced in Tianmen City, Tanghe City and Anguo City. In terms of analgesic and anti-inflammatory effects, P. ternata produced in Pengxi City and Tianmen City were superior to those produced in other regions.
Key words Pinellia ternata;Different origins;Phlegm elimination;Cough suppression;Pain relief;Anti-inflammatory
基金項目 河南省科技攻关项目(212102310349);国家现代农业产业技术体系建设专项(CARS-21)。
作者简介 李超(1987—),男,河南南阳人,副教授,博士,从事中药资源开发与利用研究。
*通信作者,教授,博士,硕士生导师,从事中药材品质评价研究。
收稿日期 2023-09-23
半夏为天南星科植物半夏[Pinellia ternate(Thunb.)Breit.]的干燥块茎,性温、味辛,归脾、胃、肺经,具有燥湿化痰、降逆止呕、消痞散结的功效,临床常用于咳喘痰多、痰饮眩悸、风痰眩晕、痰厥头痛、呕吐反胃等症[1]。半夏用药历史悠久,入药记载可追溯至战国时期的医方著作《五十二病方》,半夏亦为经方“扶阳派”十大帅药之一,在东汉张仲景《伤寒杂病论》所载的113首方剂中,含有半夏的方剂有44首,可见半夏在方剂配伍和临床应用中的重要作用。现代研究表明,半夏中含有生物碱、氨基酸、甾醇、有机酸等有效成分[2-3],具有镇咳、祛痰、抗炎、镇痛、止吐等药理活性[4-5]。近年来,半夏野生资源急剧减少,药材资源主要依赖于人工栽培,尤其是道地优质产区所出产的半夏,市场需求量早已供不应求。前人研究表明,不同主产区半夏的药材品质差异显著[6-8],这可能对其生物活性积累和临床疗效有一定影响。基于以上考虑,该研究以国内6个主产区的半夏药材为试验材料,分别建立痰液分泌模型、咳嗽模型、镇痛模型、炎症模型,探讨半夏在不同产地间祛痰、镇咳、镇痛、抗炎作用的差异,以期为半夏的种植适宜性区划及临床应用选择提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 药材。不同产地半夏药材样品于2022年10月至11月在贵州赫章、江苏南通、四川蓬溪、河南唐河、湖北天门、河北安国等地采集,经南阳理工学院黄显章教授鉴定为天南星科植物半夏[Pinellia ternate(Thunb.)Breit.]的干燥块茎,将不同产地的半夏样品去杂、挑选、干燥、粉碎、混匀后备用。
1.1.2 试验试剂。复方甘草片(内蒙古亿利制药有限公司,批号20210513);酚红(天津市天新精细化工开发中心,批号130516);碳酸氢钠(天津市风船化学试剂科技有限公司,批号2021100979);冰醋酸(国药集团化学试剂有限公司,批号20210921);浓氨水(天茂化工有限公司,批号20211223);生理盐水(四川科伦药业股份有限公司,批号20211020);二甲苯(天津市大茂化学试剂厂,批号20211015)。
1.1.3 仪器设备。
AUW220D型电子分析天平(日本SHIMADZU公司);UV-1601型紫外可见分光光度计(北京普析通用仪器有限公司);SB-52001OTS型超声波清洗器(深圳市欣开达电子有限公司);DHG-203A型电热恒温鼓风干燥箱(上海精宏实验设备有限公司)。
1.1.4 实验动物。SPF级KM小鼠购自河南省动物实验中心,体质量为20~22 g,共432只,实验动物生产许可证号为SCXK(豫)2017-0001。饲养于南阳理工学院医学实验动物中心,使用许可证号为SYXK(豫)2020-0013。温度22~24 ℃、湿度40%~60%条件下适应性喂养3 d。
1.2 试验方法
1.2.1
姜半夏炮制品制备。将6个产地的半夏样品按照2020版《中国药典》所要求的姜矾水煮制法进行规范炮制,即将净半夏在水中浸泡至内完全无干心时与生姜煎煮,另加白矾与半夏一起煎煮,彻底煮透,取出晾干,随即将其切成薄片,烘干后即得姜半夏炮制品,密封,装袋备用。
1.2.2 半夏水提液制备。取已烘干的不同产地姜半夏炮制品,粉碎后浸泡1 h,使其全部浸透,大火煮沸,后小火煮30 min,8层纱布过滤,滤渣加8倍量水,大火煮沸30 min,2次过滤,合并滤液。减压真空浓缩,浓缩至0.3 g/mL(含生药量为 0.3 g/mL)后保存于4 ℃ 冰箱中备用。
1.2.3 祛痰试验。
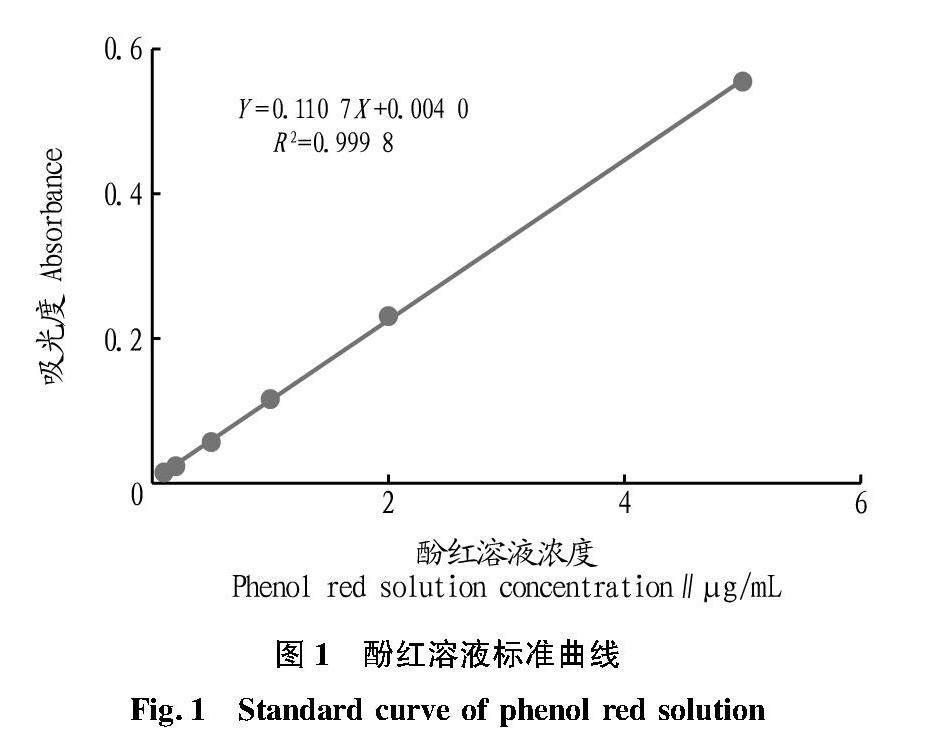
1.2.3.1 酚红标准曲线的绘制。精密称取5 mg酚红于容量瓶中,加入5% NaHCO3溶液50 mL,定容,制成100 μg/mL酚红母液。分别精密吸取酚红母液500、200、100、50、20、10 μL于10 mL容量瓶中,5% NaHCO3溶液定容,即得5.0、2.0、1.0、0.5、0.2、0.1 μg/mL的酚红稀释液。使用紫外分光光度计分别测量各浓度的吸光度(OD值),以酚红溶液浓度为横坐标、吸光度为纵坐标绘制标准曲线,得标准曲线方程Y=0.110 7X+0.004 0(R2=0.999 8)。
1.2.3.2
动物分组及给药方法。取健康雄性小鼠112只,随机分为14组,分别为空白对照组、复方甘草片阳性对照组(剂量为3.6 g/kg)、贵州赫章半夏高和低剂量组、江苏南通半夏高和低剂量组、四川蓬溪半夏高和低剂量组、河北安国半夏高和低剂量组、湖北天门半夏高和低剂量组、河南唐河半夏高和低剂量组,每组8只。各产地半夏高、低剂量分别是3.0和1.5 g/kg,给药体积为0.01 mL/g,空白对照组给予同体积蒸馏水,连续灌胃3 d,每天1次。
1.2.3.3
痰液分泌模型。末次灌胃前12 h禁食不禁水。末次给药30 min后每组小鼠腹腔注射2.5%酚红溶液0.02 mL/g。腹腔注射30 min后处死,剥去气管周围肌肉组织,暴露甲状软骨至气管分支处约12 mm,取喉咙以下至锁骨以上的一段气管,吸去多余血渍,迅速放入装有3 mL 5% NaHCO3溶液试管中,超声振摇10 min,静置1 h。弃去气管,将样品溶液置于比色皿中,另以5% NaHCO3溶液作为空白对照(参比液),在546 nm波长下测量OD值。
祛痰指数=给药组OD值空白对照组OD值
酚红增加率=(给药组排泌量-空白对照组排泌量)/空白对照组排泌量×100%
1.2.4 镇咳试验。取健康雄性小鼠112只,动物分组与给药方法参照“1.2.3.2”,末次给药1 h后进行氨水引咳试验。将小鼠放置于倒置的烧杯中,吸取25% NH3·H2O溶液3 mL至医用脱脂棉球上,快速放于装有小鼠的烧杯中,计时并观察小鼠活动状况。观察和记录小鼠咳嗽潜伏期及3 min内咳嗽次数,并计算其咳嗽潜伏期延长率和止咳率[9]。
咳嗽潜伏期延长率=(给药组咳嗽潜伏期-空白对照组咳嗽潜伏期)/空白对照组咳嗽潜伏期×100%
咳嗽止咳率=(空白对照组咳嗽次數-给药组咳嗽次数)/空白对照组咳嗽次数×100%
1.2.5 镇痛试验。取健康雄性小鼠104只,随机分为13组,分别为空白对照组、贵州赫章高和低剂量组、江苏南通高和低剂量组、四川蓬溪高和低剂量组、河北安国高和低剂量组、湖北天门高和低剂量组、河南唐河高和低剂量组,每组8只。各产地半夏水提液高、低剂量分别是3.0、1.5 g/kg,给药体积0.01 mL/g,空白对照组给予等体积的蒸馏水,连续给药7 d,每天1次。末次给药1 h后腹腔注射0.8%冰醋酸溶液(0.01 mL/g),观察和记录小鼠反应潜伏期以及在15 min内扭体次数[10]。扭体反应以小鼠躯干伸长、腹部内陷、臀部抬高等症状为依据,并计算扭体抑制率。
扭体抑制率=(空白对照组平均扭体次数-给药组平均扭体次数)/空白对照组平均扭体次数×100%
1.2.6 抗炎试验。取健康雄性小鼠104只,动物分组与给药方法参照“1.2.3.2”,末次给药1 h后将小鼠右耳正反两面擦净擦干,并涂抹二甲苯20 μL,30 min后将小鼠处死,剪下双耳,用打孔器(直径8 mm)在双耳相同部位打孔,称重和计算肿胀度及肿胀抑制率[11]。
肿胀度=右耳片重量-左耳片重量
肿胀抑制率=(空白对照组平均肿胀度-给药组平均肿胀度)/空白对照组平均肿胀度×100%
1.3 统计学方法 采用SPSS 19.0软件进行数据分析,计量资料以±s表示,多组间比较采用单因素方差分析,组间两两比较采用 LSD-t 检验,以P<0.05表示有统计学意义。
2 结果与分析
2.1 祛痰试验
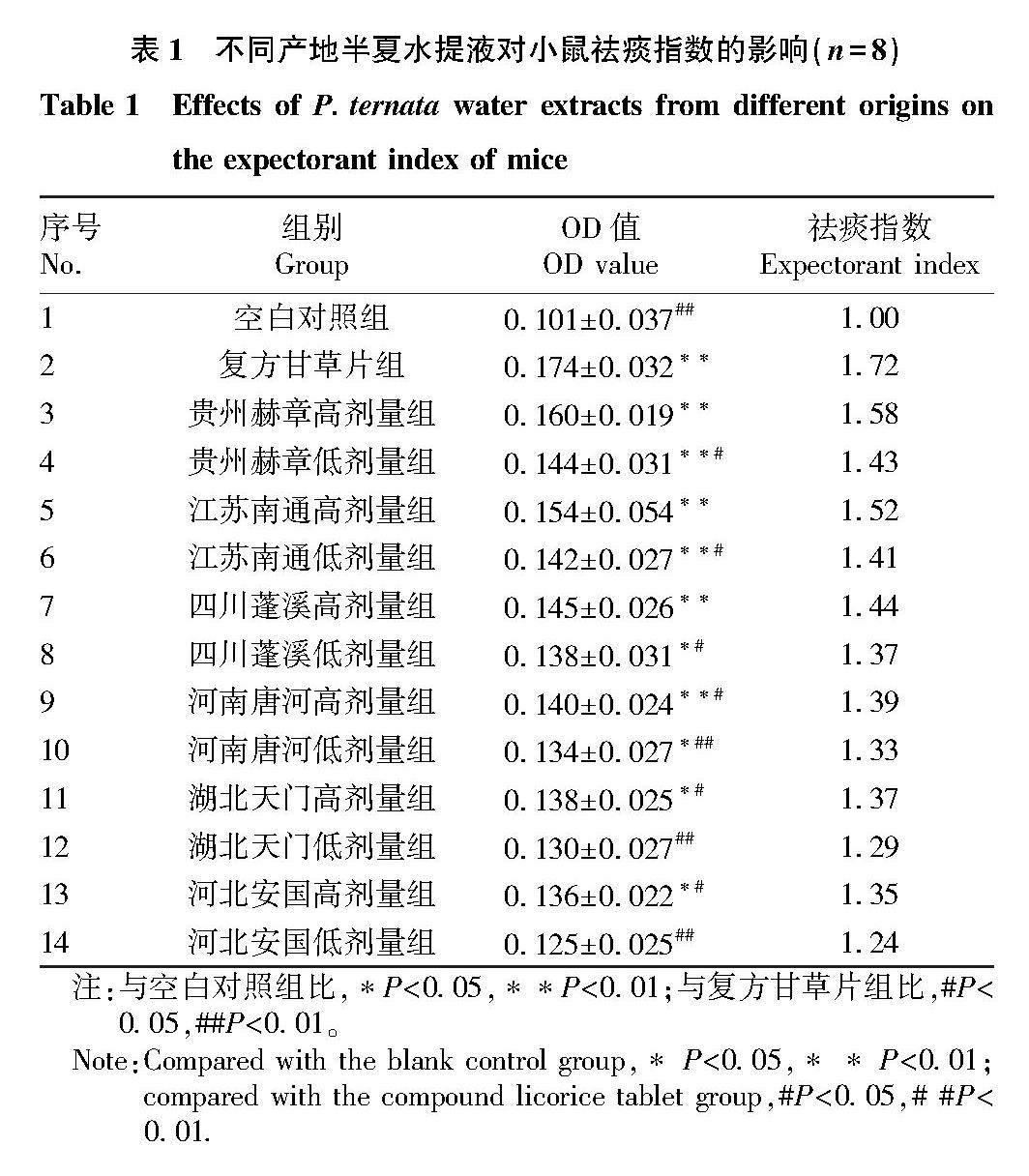
由表1可知,与空白对照组相比,不同产地半夏水提液均能显著提高小鼠祛痰指数,祛痰指数在1.24~1.58,表明不同产地半夏均具有不同程度的祛痰作用;其中,贵州赫章组、江苏南通组、四川蓬溪组的小鼠明显表现出比其他给药组更高的OD值和祛痰指数,表明其祛痰作用明显优于其他3个地区。与阳性药(复方甘草片组)相比,贵州赫章组、江苏南通组、四川蓬溪组的高剂量组无显著差异(P>0.05),表明这3组的祛痰作用与复方甘草片相当;河南唐河组、湖北天门组、河北安国组的高剂量组能够显著降低OD值(P<0.05),表明这3组的半夏祛痰作用弱于阳性药组,且各产地半夏水提液高剂量组的祛痰指数普遍高于低剂量组。
由表2可知,与空白对照组相比,不同产地给药组小鼠气管酚红排泌量有所增加,增加率在24.80%~60.69%,表明不同产地半夏均具有不同程度祛痰作用;其中,贵州赫章高剂量组、江苏南通高剂量组的小鼠酚红排泌量均明显高于其他4个产区,表明贵州赫章、江苏南通2个产地半夏水提液祛痰效果优于其他4个地区,贵州赫章产半夏祛痰作用最优。与阳性药(复方甘草片组)相比,贵州赫章组、江苏南通组、四川蓬溪组的高剂量组小鼠气管酚红排泌量无显著差异(P>0.05),表明这3个产地的半夏祛痰作用与复方甘草片相当;湖北天门、河南唐河的高剂量组小鼠气管酚红排泌量显著降低(P<0.05),河北安国高和低剂量组小鼠气管酚红排泌量极显著降低(P<0.01),表明河南唐河、湖北天门、河北安国3个地区的半夏祛痰作用明显弱于阳性药组,河北安国产半夏祛痰效果最弱。
2.2 镇咳试验
由表3可知,与空白对照组相比,不同产地给药组小鼠咳嗽潜伏期均明显延长,延长率为8.06%~63.01%,咳嗽次数明显减少,止咳率为8.23%~45.51%,表明不同产地半夏水提液均有不同程度镇咳作用。相对于高剂量(3.0 g/kg),贵州赫章组、江苏南通组小鼠均显著表现出与其他地区组更少的咳嗽次数及更高的止咳率,说明其镇咳作用明显优于其他4个地区的半夏。
在半夏高剂量(3.0 g/kg)的给药剂量下,与阳性药(复方甘草片组)相比,贵州赫章组、江苏南通组咳嗽潜伏期和咳嗽次数均无显著差异(P>0.05),表明其镇咳作用与复方甘草片相当,四川蓬溪产半夏镇咳作用稍弱于阳性药组;河北安国组、河南唐河组和湖北天门组咳嗽潜伏期及咳嗽次数具有显著性差异(P<0.01),表明河北安国、河南唐河、湖北天门这3个地区半夏止咳作用弱于阳性药组。
2.3 镇痛试验
由表4可知,与空白对照组相比,各产地半夏水提液均能明显延长小鼠扭体潜伏期,显著降低小鼠15 min内扭体次数(P<0.05),各产地半夏水提液组小鼠扭体抑制率为47.31%~74.45%,表明各产地半夏具有不同程度镇痛作用。其中,四川蓬溪高剂量组、湖北天门高剂量组的小鼠均明显表现出与其他给药组更长的潜伏期以及更少的扭体次数,扭体抑制率明显增大,说明其镇痛作用明显优于其他给药组。
2.4 抗炎试验
由表5可知,与空白对照组相比,不同产地的半夏水提液均能不同程度降低小鼠耳肿胀度,耳肿胀抑制率为8.04%~37.98%。其中,四川蓬溪组、湖北天门组、河南唐河高剂量组、贵州赫章高剂量组均能够极显著降低小鼠耳肿胀度(P<0.01);河南唐河低剂量组、贵州赫章低剂量组、河北安国高剂量组均能够显著降低小鼠耳肿胀度(P<0.05);河北安国低剂量组、江苏南通剂量组与空白对照组比较小鼠耳肿胀度无统计学差异(P>0.05)。上述结果表明四川蓬溪、湖北天门产地的半夏抗炎作用较好,河南唐河、贵州赫章、河北安国所产半夏抗炎效果次之,江苏南通所产的半夏抗炎作用弱于其他产地。
3 讨论与结论
中药材产地对中药材品质与安全有直接的影响。从生物学角度来看,中药材是物种受特定生态环境的影响,在长期生态适应过程中所形成的[12]。药材生长所需的气候、土壤、水文等生态因素与其生长发育和品质密切相关[13]。中药材质量的优劣取决于活性成分的组成与含量,而活性成分的合成和积累与其产地环境密切相关,前人将这种关系概括为中药材的“道地性”[14-16]。近年来,中医药产业的快速发展带来了中药材资源需求量的激增,但同时也存在诸多安全隐患,不同产地中药材的品质评价和药理活性工作亟待开展。
半夏用药历史悠久,临床应用广泛,为经方“扶阳派”十大帅药之一,常见方剂有半夏泻心汤、半夏厚朴汤、小半夏汤等。该研究以国内6个主产区(湖北天门、江苏南通、河南唐河、四川蓬溪、河北安国、贵州赫章)的半夏样品为试验材料,在祛痰止咳、镇痛、抗炎等方面进行药理学研究,结果表明,半夏水提液能够增加小鼠气管酚红排泌量,增加率在24.80%~60.69%,祛痰指数在1.24~1.58,即具有明顯的祛痰作用;对氨水诱发的小鼠咳嗽试验,能够明显延长小鼠咳嗽潜伏期,咳嗽次数减少,具有明显的镇咳作用,贵州赫章组明显优于其他产地;贵州赫章、江苏南通、四川蓬溪产半夏具有显著的祛痰作用,而其他产区半夏作用稍弱。对于醋酸致小鼠扭体试验,能够明显减少小鼠扭体次数,延长潜伏期,大幅度提高扭体抑制率,具有显著的镇痛作用;对于二甲苯致小鼠耳肿胀试验,能够明显降低小鼠耳肿胀度,具有明显的抗炎作用,其中四川蓬溪、湖北天门产半夏镇痛抗炎作用较好,河南唐河、贵州赫章、河北安国所产半夏镇痛抗炎效果次之,江苏南通半夏镇痛抗炎作用最弱。
综上所述,6个主产区的半夏水提液均有不同程度祛痰、镇咳、镇痛和抗炎作用,并随其药物浓度的增加作用增强。在祛痰止咳方面,贵州赫章、江苏南通、四川蓬溪3个产区半夏止咳祛痰作用明显优于湖北天门、河南唐河、河北安国;在镇痛抗炎作用方面,四川蓬溪、湖北天门所产半夏强于其他产地。
参考文献
[1] 国家药典委员会.中华人民共和国药典[S].北京:中国医药科技出版社,2020:123.
[2] 李哲,玄静,赵振华,等.半夏化学成分及其药理活性研究进展[J].辽宁中医药大学学报,2021,23(11):154-158.
[3] 王恒,于淼,李伟楠,等.半夏化学成分及抗肿瘤作用机制研究进展[J].中医药导报,2021,27(8):49-52.
[4] 王依明,王秋红.半夏的化学成分、药理作用及毒性研究进展[J].中国药房,2020,31(21):2676-2682.
[5] 黄凤英,高健美,龚其海.半夏药理作用及其毒性研究进展[J].天然产物研究与开发,2020,32(10):1773-1781.
[6] 王俊斐.不同产地半夏药材多成分质量分析研究[D].合肥:安徽中医药大学,2021.
[7] 李希凡,韩红梅,王志强,等.5产区不同产地半夏主要化学组分含量测定及整体质量评价[J].天津中医药,2020,37(3):332-337.
[8] 刘杨,包华音,王彬,等.不同产地半夏7种核苷类成分含量测定[J].甘肃中医药大学学报,2022,39(3):32-36.
[9] 董琳琳,闫慧敏,丰晨然,等.痰喘宁合剂平喘、镇咳、祛痰作用研究[J].中国比较医学杂志,2021,31(1):50-58.
[10] 陈玉丽,阮志鹏,林丽珊,等.香椿叶总黄酮抗炎镇痛作用实验研究[J].甘肃中医药大学学报,2022,39(1):7-11.
[11] 谷捷,李鑫,余黄合,等.二甲苯致小鼠耳肿胀急性炎症模型的建立[J].湖南中医药大学学报,2016,36(5):32-35.
[12] 孟祥才,邓代千,杜虹韦,等.高品质道地药材的科学内涵[J].中草药,2023,54(3):939-947.
[13] 陈士林,索风梅,韩建萍,等.中国药材生态适宜性分析及生产区划[J].中草药,2007,38(4):481-487.
[14] 黄璐琦,陈美兰,肖培根.中药材道地性研究的现代生物学基础及模式假说[J].中国中药杂志,2004,29(6):494-496,610.
[15] 谢彩香,宋经元,韩建萍,等.中药材道地性评价与区划研究[J].世界科学技术-中医药现代化,2016,18(6):950-958.
[16] 孙义新,魏源.道地药材成因及其土壤元素基准探讨[J].安徽农业科学,2018,46(31):8-11.

