吴茱萸碱调节HMGB1/TLR4/NF-κB信号通路对脑梗死大鼠神经炎症的影响
宋秀威 杨月君 王伟

摘要 目的:探討吴茱萸碱调节高迁移率族蛋白B1(HMGB1)/Toll样受体4(TLR4)/核转录因子-κB(NF-κB)信号通路对脑梗死大鼠神经炎症的影响。方法:采用大脑中动脉栓塞法构建脑梗死大鼠模型,随机分为模型组、吴茱萸碱低剂量组、吴茱萸碱高剂量组、吴茱萸碱高剂量+空载质粒组、吴茱萸碱高剂量+HMGB1过表达组,每组15只,另选取15只健康大鼠设为假手术组,以吴茱萸碱和质粒分组处理后,采用改良神经功能缺损评分(mNSS)评估大鼠神经损伤;三苯基氯化四氮唑(TTC)染色检测大鼠脑梗死面积;末端脱氧核苷酸转移酶介导的dUTP缺口末端标记(TUNEL)染色检测大鼠海马神经元凋亡率;透射电镜观察大鼠海马神经元超微结构;酶联免疫吸附法(ELISA)检测大鼠血清及脑组织促炎因子环氧化酶-2(COX-2)、白细胞介素-18(IL-18)、诱导型一氧化氮合酶(iNOS)水平;蛋白免疫印迹法检测大鼠脑组织HMGB1/TLR4/NF-κB信号通路蛋白表达。结果:与假手术组比较,模型组大鼠海马神经元超微结构发生损伤,mNSS评分、脑梗死面积、海马神经元凋亡率、血清与脑组织COX-2、IL-18、iNOS水平、脑组织HMGB1、TLR4蛋白表达及p-NF-κB p65/NF-κB p65明显升高(P<0.05);与模型组比较,吴茱萸碱低剂量组、吴茱萸碱高剂量组、吴茱萸碱高剂量+空载质粒组大鼠海马神经元超微结构损伤均减轻,mNSS评分、脑梗死面积、海马神经元凋亡率、血清与脑组织COX-2、IL-18、iNOS水平、脑组织HMGB1、TLR4蛋白表达及p-NF-κB p65/NF-κB p65均降低(P<0.05);吴茱萸碱高剂量组大鼠海马神经元超微结构损伤较吴茱萸碱低剂量组进一步减轻,mNSS评分、脑梗死面积、海马神经元凋亡率、血清与脑组织COX-2、IL-18、iNOS水平、脑组织HMGB1、TLR4蛋白表达及p-NF-κB p65/NF-κB p65进一步降低(P<0.05)。与吴茱萸碱高剂量组比较,吴茱萸碱高剂量+HMGB1过表达组大鼠海马神经元超微结构损伤加重,mNSS评分、脑梗死面积、海马神经元凋亡率、血清与脑组织COX-2、IL-18、iNOS水平、脑组织HMGB1、TLR4蛋白表达及p-NF-κB p65/NF-κB p65升高(P<0.05)。结论:吴茱萸碱可通过阻止HMGB1/TLR4/NF-κB信号激活而降低促炎因子表达,从而抑制神经炎症,减轻脑梗死大鼠神经功能损伤。
关键词 脑梗死;吴茱萸碱;高迁移率族蛋白B1/Toll样受体4/核转录因子-κB信号通路;神经炎症;实验研究
doi:10.12102/j.issn.1672-1349.2024.07.013
脑梗死(cerebral infarction,CI)是由脑动脉闭塞引起的脑组织缺血性坏死和神经元损伤凋亡,可导致偏瘫、认知能力下降,具有高死亡率、高致残率的特点[1-2]。过度的神经炎症是导致神经功能损伤的主要因素,抑制神经炎症可减少神经元凋亡,减轻认知功能损伤[3-4]。高迁移率族蛋白B1(high mobility group box 1,HMGB1)/Toll样受体4(Toll-like receptor 4,TLR4)/核转录因子-κB(nuclear transcription factor-κB,NF-κB)信号通路可通过调控促炎因子释放和小胶质细胞激活而介导神经炎症的发生发展,阻断该信号传导可抑制神经炎症[5-6]。吴茱萸碱可抑制NF-κB p65磷酸化,阻止小胶质细胞过度激活引起的神经炎症[7-8]。本研究以不同剂量吴茱萸碱处理脑梗死大鼠,探讨吴茱萸碱调节HMGB1/TLR4/NF-κB信号通路对脑梗死大鼠神经炎症的影响。
作者单位 保定市第二医院(河北保定 071000),E-mail:Sxiu55@126.com
引用信息 宋秀威,杨月君,王伟.吴茱萸碱调节HMGB1/TLR4/NF-κB信号通路对脑梗死大鼠神经炎症的影响[J].中西医结合心脑血管病杂志,2024,22(7):1240-1246.
1 材料与方法
1.1 材料
1.1.1 动物
SD大鼠,雄性,无特定病原体(SPF)级,购于莱岸科技(广州)有限公司,生产许可证号SYXK(粤)2022-0283,体质量200~230 g,6周龄左右,动物饲养房内保持屏障环境,分笼喂养,每笼不超过5只,所有操作符合3R原则,并严格遵循《实验动物管理条例》要求。
1.1.2 主要试剂及仪器
吴茱萸碱[经高效液相色谱(HPLC)法测得纯度≥98%]、三苯基氯化四氮唑(triphenyltetrazolium chloride,TTC)、大鼠环氧化酶-2(cyclooxygenase-2,COX-2)、白细胞介素-18(interleukin-18,IL-18)酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒购自北京索莱宝科技有限公司;大鼠诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)ELISA试剂盒购自上海生工生物工程股份有限公司;末端脱氧核苷酸转移酶介导的dUTP缺口末端标记(TUNEL)检测试剂盒、兔源一抗β-actin、HMGB1、p-NF-κB p65、TLR4、NF-κB p65购自英国Abcam公司。VHX-7000光学显微镜(日本基恩士公司生产);JEM-2100Plus透射电子显微镜(深圳市蓝星宇电子科技有限公司生产);VarioskanLUX全自动酶标仪(赛默飞世尔科技中国有限公司生产)。
1.2 方法
1.2.1 腦梗死大鼠模型制备及分组处理
参照文献[9]制备脑梗死大鼠模型:以50 mg/kg剂量的3%戊巴比妥钠腹腔内注射麻醉大鼠,以仰卧位固定在操作板上,剃除颈部毛发后消毒、备皮,切开左侧皮肤并分离肌肉组织,找到并游离颈动脉,将左侧颈总动脉和颈外动脉结扎,于颈总动脉处开孔插入线栓并前进至大脑中动脉,封闭血流2 h后取出线栓恢复血流,缝合伤口并再灌注24 h完成造模,然后从大鼠平衡、运动、感知和反射等方面对其神经功能缺损进行评定,评估标准参考文献[10],改良神经功能缺损评分(modified Neurological Severity Score,mNSS)总分18分,得分≥7分即为造模成功。随机分为模型组、吴茱萸碱低剂量组、吴茱萸碱高剂量组、吴茱萸碱高剂量+空载质粒组、吴茱萸碱高剂量+HMGB1过表达组,每组15只。另选取15只健康大鼠,设为假手术组,只游离颈动脉不进行缺血再灌注。
将吴茱萸碱和空载质粒、HMGB1过表达质粒溶于生理盐水,吴茱萸碱低剂量组、吴茱萸碱高剂量组大鼠分别以35、70 mg/kg的剂量灌胃(3.5、7.0 mg/mL的吴茱萸碱药液10 mL/kg,每日1次)[11],同时尾静脉注射与吴茱萸碱高剂量+HMGB1过表达组等剂量的生理盐水(每周2次);吴茱萸碱高剂量+空载质粒组、吴茱萸碱高剂量+HMGB1过表达组大鼠以70 mg/kg的剂量灌胃(7.0 mg/mL的吴茱萸碱药液10 mL/kg,每日1次),同时分别尾静脉注射空载质粒、HMGB1过表达质粒(每周2次);假手术组、模型组大鼠灌胃10 mL/kg剂量的生理盐水(每日1次),同时尾静脉注射与吴茱萸碱高剂量+HMGB1过表达组等剂量的生理盐水(每周2次)。各组大鼠均处理2周。
1.2.2 检测大鼠神经功能损伤情况
给药结束后24 h,采用mNSS评估各组大鼠神经功能,得分越高表示大鼠神经功能缺损越严重。
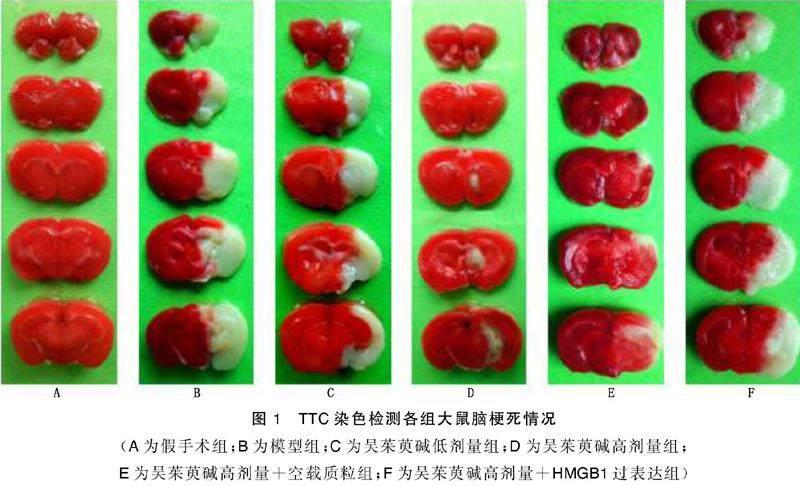
1.2.3 TTC染色检测大鼠脑梗死面积
各组大鼠于mNSS评分结束后以乙醚麻醉,采集颈动脉血离心,收集上清置于-80 ℃备用。每组随机选取5只大鼠,断头剥离出大脑,切成厚度大致相同的冠状切片,以TTC溶液染色后固定,拍照后以Image pro软件对图像进行分析,定量每只大鼠全脑切片面积和全脑切片中梗死面积,计算脑梗死面积,脑梗死面积=全脑切片中梗死面积/全脑切片面积×100%。
每组剩余的10只大鼠中,再次随机选取5只,断头剥离出大脑,使用手术剪剪下缺血半暗带脑组织0.4 g储存于液氮备用,剩余的脑组织置于4%多聚甲醛中固定后以梯度乙醇(50%、70%、80%、90%、100%)脱水、二甲苯透明、热石蜡包埋,置于石蜡切片机中固定切片,得到厚度约4 μm的切片备用。
每组剩余5只大鼠,断头剥离出大脑,使用手术剪剪下缺血半暗带脑组织0.4 g,剪碎、匀浆、离心后以二喹啉甲酸(BCA)法测定上清中总蛋白浓度,最后将脑组织蛋白样品液置于-80 ℃备用,剩余的脑组织依次置于2.5%戊二醛、2%四氧化锇中固定,以50%、70%、80%、90%、100%梯度乙醇依次脱水,然后浸透包埋后置于超薄切片机中固定切片,得到厚度约70 nm的切片备用。
1.2.4 TUNEL染色检测大鼠神经元凋亡情况
选取1.2.3中无破损的厚度约4 μm脑组织切片进行脱蜡、水化、TUNEL染色处理,在光学显微镜下观察并随机采集5个视野图像,以Image pro软件对图像进行分析,定量切片中海马神经元凋亡细胞数与海马神经元总细胞数,海马神经元凋亡率=海马神经元凋亡细胞数/海马神经元总细胞数×100%。
1.2.5 大鼠海马神经元超微结构检测
选取1.2.3中无破损的厚度约70 nm的脑组织切片,以枸杞酸铅和醋酸铀双重染色后,采用透射电子显微镜观察海马神经元超微结构并采集图像。
1.2.6 ELISA检测大鼠血清及脑组织促炎因子COX-2、IL-18、iNOS水平
取1.2.3中血清以冰水浴慢慢解冻,同时取出存在液氮中的脑组织剪碎、匀浆、离心后以BCA法测定上清中总蛋白浓度后,每组取出200 μL脑组织蛋白样品液和200 μL血清通过ELISA法测量其中COX-2、IL-18、iNOS水平,具体步骤参照各自ELISA试剂盒说明书进行。
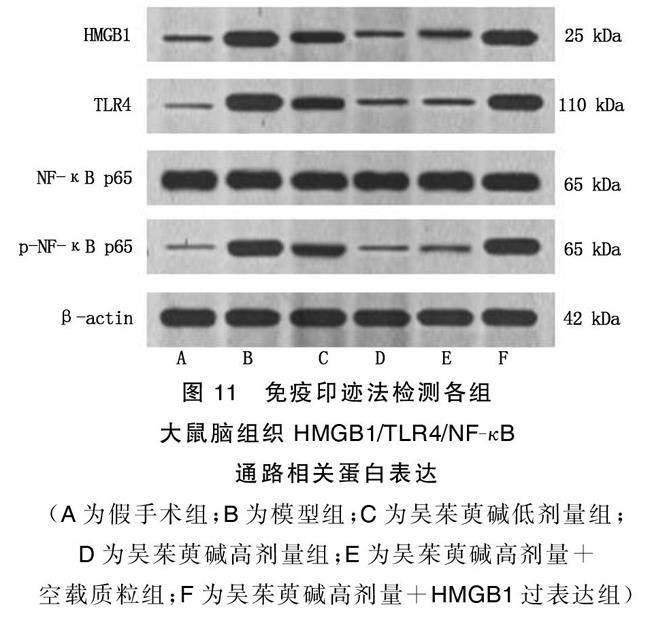
1.2.7 蛋白免疫印迹法检测大鼠脑组织HMGB1/TLR4/NF-κB通路蛋白表达
取1.2.3中置于-80 ℃的脑组织蛋白样品液以冰水浴慢慢解冻,根据蛋白浓度检测结果每组取出25 μg总蛋白,煮沸变性、电泳、转膜、封闭,将β-actin、HMGB1、TLR4、p-NF-κB p65、NF-κB p65蛋白自膜上剪下,以兔源一抗和辣根过氧化物酶(HRP)偶联羊抗兔二抗孵育进行抗原抗体反应,通过化学发光法显色后拍照,以Image pro软件对图像进行分析后量化各组蛋白相对表达量。
1.3 统计学处理
以SPSS 26.0软件进行统计学分析。符合正态分布的定量资料用均数±标准差(x±s)表示,两组间比较行t检验;多组间比较行单因素方差分析,两两之间进一步比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 吴茱萸碱对脑梗死大鼠神经功能损伤的影响
与假手术组比较,模型组大鼠mNSS评分、脑梗死面积明显升高(P<0.05);与模型组比较,吴茱萸碱低剂量组、吴茱萸碱高剂量组、吴茱萸碱高剂量+空载质粒组大鼠mNSS评分、脑梗死面积均降低(P<0.05),吴茱萸碱高剂量组大鼠mNSS评分、脑梗死面积较吴茱萸碱低剂量组进一步降低(P<0.05);与吴茱萸碱高剂量组比较,吴茱萸碱高剂量+HMGB1过表达组大鼠mNSS评分、脑梗死面积升高(P<0.05),吴茱萸碱高剂量+空载质粒组大鼠mNSS评分、脑梗死面积无明显变化(P>0.05)。详见图1~图3。
2.2 吴茱萸碱对脑梗死大鼠海马神经元凋亡的影响
与假手术组比较,模型组大鼠海马神经元凋亡率明显升高(P<0.05);与模型组比较,吴茱萸碱低剂量组、吴茱萸碱高剂量组、吴茱萸碱高剂量+空载质粒组大鼠海马神经元凋亡率均降低(P<0.05),吴茱萸碱高剂量组大鼠海马神经元凋亡率较吴茱萸碱低剂量组进一步降低(P<0.05);与吴茱萸碱高剂量组比较,吴茱萸碱高剂量+HMGB1过表达组大鼠海马神经元凋亡率升高(P<0.05);吴茱萸碱高剂量+空载质粒组大鼠海马神经元凋亡率无明显变化(P>0.05)。详见图4、图5。
2.3 吴茱萸碱对脑梗死大鼠海马神经元超微结构的影响
假手术组海马神经元胞体形态大且完好,存在众多神经轴突,细胞器完整,细胞核边缘光滑且染色质均匀分布;模型组大鼠海马神经元超微结构受损严重,神经元形态受损不完整,神经轴突大量消失,细胞器结构破坏,细胞质内形成很多空泡及溶酶体,细胞核皱缩且染色质凝聚;与模型组比较,吴茱萸碱低剂量组、吴茱萸碱高剂量组、吴茱萸碱高剂量+空载质粒组大鼠海马神经元超微结构受损症状均减轻,相比吴茱萸碱低剂量组,吴茱萸碱高剂量组、吴茱萸碱高剂量+空载质粒组大鼠海马神经元超微结构受损症状进一步减轻;与吴茱萸碱高剂量组比较,吴茱萸碱高剂量+HMGB1过表达组大鼠海马神经元受损症状加重。详见图6。
2.4 吴茱萸碱对脑梗死大鼠脑组织促炎因子COX-2、IL-18、iNOS水平的影响
与假手术组比较,模型组大鼠脑组织COX-2、IL-18、iNOS水平明显升高(P<0.05)。与模型组比较,吴茱萸碱低剂量组、吴茱萸碱高剂量组、吴茱萸碱高剂量+空载质粒组大鼠脑组织COX-2、IL-18、iNOS水平均降低(P<0.05),吴茱萸碱高剂量组大鼠脑组织COX-2、IL-18、iNOS水平相比吴茱萸碱低剂量组进一步降低(P<0.05);与吴茱萸碱高剂量组比较,吴茱萸碱高剂量+HMGB1过表达组大鼠脑组织COX-2、IL-18、iNOS水平升高(P<0.05);吴茱萸碱高剂量+空载质粒组大鼠脑组织COX-2、IL-18、iNOS水平无明顯变化(P>0.05)。详见图7。
2.5 吴茱萸碱对脑梗死大鼠血清促炎因子COX-2、IL-18、iNOS水平的影响
与假手术组比较,模型组大鼠血清COX-2、IL-18、iNOS水平明显升高(P<0.05)。与模型组比较,吴茱萸碱低剂量组、吴茱萸碱高剂量组、吴茱萸碱高剂量+空载质粒组大鼠血清COX-2、IL-18、iNOS水平均降低(P<0.05),吴茱萸碱高剂量组大鼠血清COX-2、IL-18、iNOS水平较吴茱萸碱低剂量组进一步降低(P<0.05);与吴茱萸碱高剂量组比较,吴茱萸碱高剂量+HMGB1过表达组大鼠血清COX-2、IL-18、iNOS水平升高(P<0.05),吴茱萸碱高剂量+空载质粒组大鼠血清COX-2、IL-18、iNOS水平无明显变化(P>0.05)。详见图8~图10。
2.6 吴茱萸碱对脑梗死大鼠脑组织HMGB1/TLR4/NF-κB通路相关蛋白表达的影响
与假手术组比较,模型组大鼠脑组织HMGB1、TLR4蛋白表达及p-NF-κB p65/NF-κB p65明显升高(P<0.05)。与模型组比较,吴茱萸碱低剂量组、吴茱萸碱高剂量组、吴茱萸碱高剂量+空载质粒组大鼠脑组织HMGB1、TLR4蛋白表达及p-NF-κB p65/NF-κB p65均降低(P<0.05),吴茱萸碱高剂量组大鼠脑组织HMGB1、TLR4蛋白表达及p-NF-κB p65/NF-κB p65较吴茱萸碱低剂量组进一步降低(P<0.05);与吴茱萸碱高剂量组比较,吴茱萸碱高剂量+HMGB1过表达组大鼠脑组织HMGB1、TLR4蛋白表达及p-NF-κB p65/NF-κB p65升高(P<0.05),吴茱萸碱高剂量+空载质粒组大鼠脑组织HMGB1、TLR4蛋白表达及p-NF-κB p65/NF-κB p65无明显变化(P>0.05)。详见图11、图12。
3 讨 论
神经炎症是造成脑梗死神经损伤的致病因素,抑制神经炎症可减轻神经元凋亡,从而改善脑损伤[12-13]。吴茱萸碱是具有强烈抗菌、抗炎特性的生物碱,可通过减轻机体炎来缓解哮喘大鼠气道炎症[14]和小鼠溃疡性结肠炎症状[15]。本研究结果显示,不同剂量的吴茱萸碱可降低脑梗死大鼠mNSS评分,减少脑梗死面积,并降低海马神经元凋亡率及血清与脑组织COX-2、IL-18、iNOS水平,减轻海马神经元超微结构损伤,表明吴茱萸碱可降低促炎因子表达释放,抑制神经炎症发生发展,减轻海马神经元凋亡损伤,最终改善脑梗死大鼠神经功能,提示吴茱萸碱具有明显的脑保护作用。
在炎症反应过程中,HMGB1作为TLR4的内源性配体,可以激活TLR4,然后激活NF-κB,促进一系列炎性因子的释放,导致过度和损伤性炎症,进而导致组织损伤。阻滞HMGB1/TLR4/NF-κB信号传导可降低炎性因子过量表达,减轻神经炎症,进而改善认知功能[16]。有研究显示,抑制HMGB1介导的TLR4/NF-κB信号通路的激活可抑制神经炎症和氧化应激,减轻包括脑梗死在内的脑缺血疾病导致的脑损伤和神经功能缺损[17-18]。本研究发现脑梗死大鼠脑组织HMGB1、TLR4蛋白表达及p-NF-κB p65/NF-κB p65较假手术组大鼠明显升高,表明HMGB1/TLR4/NF-κB信号通路被激活,吴茱萸碱可逆转其变化趋势,提示HMGB1/TLR4/NF-κB信号通路可能参与介导吴茱萸碱对脑梗死大鼠神经炎症的抑制过程。为了进一步验证吴茱萸碱的作用机制,本研究采用高剂量吴茱萸碱处理脑梗死大鼠的同时过表达HMGB1,结果发现上调HMGB1表达可激活TLR4/NF-κB信号传导,减弱吴茱萸碱对脑梗死大鼠神经炎症的抑制作用,拮抗其对海马神经元凋亡损伤的减轻作用,最终逆转吴茱萸碱对脑梗死大鼠神经功能的改善作用,揭示吴茱萸碱抑制脑梗死大鼠神经炎症是通过上调HMGB1实现的。
总之,吴茱萸碱可减少促炎因子释放,抑制神经炎症反应,减轻脑梗死大鼠海马神经元超微结构损伤及凋亡,最终改善大鼠神经功能缺损,阻断HMGB1/TLR4/NF-κB信号途径传导可能是其机制之一。本研究证实了吴茱萸碱对脑梗死大鼠具有治疗作用,为临床脑缺血疾病的治疗提供了新的药物选择。
参考文献:
[1] KONG F,HUANG X,SU L,et al.Risk factors for cerebral infarction in takayasu arteritis:a single-centre case-control study[J].Rheumatology,2021,61(1):281-290.
[2] TALERICO R,TOSONI A,PILATO F,et al.Cerebral infarction following cyanoacrylate endoscopic therapy of duodenal varices in a patient with a patent foramen ovale:comment[J].Internal and Emergency Medicine,2021,16(7):2021-2022.
[3] XIA Q,ZHAN G F,MAO M,et al.TRIM45 causes neuronal damage by aggravating microglia-mediated neuroinflammation upon cerebral ischemia and reperfusion injury[J].Experimental & Molecular Medicine,2022,54:180-193.
[4] LIU H,DAI Q M,YANG J,et al.Zuogui pill attenuates neuroinflammation and improves cognitive function in cerebral ischemia reperfusion-injured rats[J].Neuroimmunomodulation,2022,29(2):143-150.
[5] XU X,PIAO H N,AOSAI F M,et al.Arctigenin protects against depression by inhibiting microglial activation and neuroinflammation via HMGB1/TLR4/NF-κB and TNF-α/TNFR1/NF-κB pathways[J].British Journal of Pharmacology,2020,177(22):5224-5245.
[6] LI S,LUO L H,HE Y,et al.Dental pulp stem cell-derived exosomes alleviate cerebral ischaemia-reperfusion injury through suppressing inflammatory response[J].Cell Proliferation,2021,54(8):e13093.
[7] 抗晶晶,崔宁.吴茱萸碱类化合物对阿尔茨海默病及脑血管疾病的药理作用研究进展[J].南京师大学报(自然科学版),2021,44(3):137-141.
[8] MENG T Y,FU S P,HE D W,et al.Evodiamine inhibits lipopolysaccharide(LPS)-induced inflammation in BV-2 cells via regulating AKT/Nrf2-HO-1/NF-κB signaling axis[J].Cellular and Molecular Neurobiology,2021,41(1):115-127.
[9] 肖志博,谢海,金辉,等.丙泊酚基于SIRT1/Foxo1信号缓解脑缺血再灌注造成血脑屏障损伤[J].微循环学杂志,2022,32(1):12-18.
[10] 崔連旭,江文康,陆大鸿,等.临床级人脐带间充质干细胞对创伤性脑损伤大鼠神经功能的改善作用[J].中国组织工程研究,2023,27(6):835-839.
[11] CHOU C H,YANG C R.Neuroprotective studies of evodiamine in an okadaic acid-induced neurotoxicity[J].International Journal of Molecular Sciences,2021,22(10):5347.
[12] ZHENG K,ZHANG Y L,ZHANG C W,et al.PRMT8 attenuates cerebral ischemia/reperfusion injury via modulating microglia activation and polarization to suppress neuroinflammation by upregulating Lin28a[J].ACS Chemical Neuroscience,2022,13(7):1096-1104.
[13] SHAO Y J,ZHANG Y,WU R R,et al.Network pharmacology approach to investigate the multitarget mechanisms of Zhishi Rhubarb Soup on acute cerebral infarction[J].Pharmaceutical Biology,2022,60(1):1394-1406.
[14] WANG Q,CUI Y B,WU X F,et al.Evodiamine protects against airway remodelling and inflammation in asthmatic rats by modulating the HMGB1/NF-κB/TLR-4 signalling pathway[J].Pharmaceutical Biology,2021,59(1):192-199.
[15] 杨哲,孙荣蔚,王赛男,等.吴茱萸碱对DSS诱导小鼠急性溃疡性结肠炎的保护作用研究[J].中国野生植物资源,2021,40(1):1-8;14.
[16] QIU C,WANG M,YU W,et al.Activation of the hippocampal LXRβ improves sleep-deprived cognitive impairment by inhibiting neuroinflammation[J].Molecular Neurobiology,2021,58(10):5272-5288.
[17] YAN S H,FANG C Q,CAO L,et al.Protective effect of glycyrrhizic acid on cerebral ischemia/reperfusion injury via inhibiting HMGB1-mediated TLR4/NF-κB pathway[J].Biotechnology and Applied Biochemistry,2019,66(6):1024-1030.
[18] BAO Z C,ZHANG S G,LI X L.MiR-5787 attenuates macrophages-mediated inflammation by targeting TLR4/NF-κB in ischemic cerebral infarction[J].Neuro Molecular Medicine,2021,23(3):363-370.
(收稿日期:2022-09-24)
(本文編辑王丽)

