卡瑞利珠单抗联合XELOX 方案治疗晚期结肠癌的临床研究
段梅梅,张耀晴,付佳佳
1.华中科技大学协和京山医院/京山市人民医院 肿瘤科,湖北 荆门 431899
2.华中科技大学协和京山医院/京山市人民医院 普外科,湖北 荆门 431899
结肠癌是消化科发病率及致死率均较高的恶性肿瘤之一[1]。由于结肠癌起病过程较为隐匿,大多数患者仅在出现腹泻、血便、腹痛等严重症状后才进行排查,确诊时已进展至结肠癌晚期,因此无法进行手术治疗[2]。XELOX 联合方案是转移性及晚期结直肠癌一线化疗方案,在控制疾病进展方面具有一定效果,但部分患者易发生化疗耐药,导致预后不良[3]。众所周知,免疫抑制参与恶性肿瘤发生、发展过程。近年来,以程序性细胞死亡受体-1(PD-1)及其配体-1(PD-L1)抑制剂为代表的免疫靶向治疗可通过阻断结合而激活T 细胞,进而产生持续抗肿瘤效应,在肝癌、肺癌、食管癌和结直肠癌等肿瘤治疗中取得良好疗效[4-5]。卡瑞利珠单抗可靶向结合PD-1,通过阻断PD-1/PD-L1 通路发挥抗肿瘤效应。尽管卡瑞利珠单抗已在多种实体瘤中开展了临床试验并取得了一定效果,但由于其上市时间较短,目前有关卡瑞利珠单抗联合XELOX 方案是否能够有效提高结肠癌疗效尚不可知[6]。鉴于此,本研究探讨该方案对结肠癌疗效及对肿瘤标志物、血管新生指标的影响。
1 资料和方法
1.1 一般临床资料
选取2021 年1 月—2023 年1 月京山市人民医院收治的94 例结肠癌患者为研究对象。其中男性58例,女性36 例;年龄33~79 岁,平均年龄(57.84±8.23)岁;肿瘤大小2~9 cm,平均大小(5.01±1.30)cm。所有患者均签订知情同意书,本研究经京山市人民医院伦理委员会批准[批号(2021)006 号]。
纳入标准:经病理或细胞学诊断为结肠癌;晚期(Ⅳ期);至少有1 个可测量病灶。排除标准:伴其他恶性肿瘤;合并重要器官功能障碍;合并严重感染;预计生存期<3 个月;妊娠妇女。
1.2 药物
注射用奥沙利铂由浙江海正药业股份有限公司生产,规格50 mg/支,产品批号200321、210518、220419;卡培他滨片由上海罗氏制药有限公司生产,规格0.5 g/片,产品批号200319、210428、220409;注射用卡瑞利珠单抗由苏州盛迪亚生物医药有限公司生产,规格200 mg/瓶,产品批号202006073、202107091、202211066。
1.3 分组及治疗方法
随机将患者分为对照组(47 例)和治疗组(47例),其中对照组男性28 例,女性19 例;年龄33~79 岁,平均年龄(58.06±8.37)岁;身体质量指数(BMI)18~25,平均BMI(21.89±1.35)kg/m²;肿瘤大小2~9 cm,平均大小(4.89±1.32)cm;按照病理类型划分:管状腺癌22 例、黏液腺癌15 例、印戒细胞癌6 例、未分化癌4 例;按照病变位置划分:升结肠癌24 例、横结肠癌11 例、乙状结肠癌12例;按照转移部位划分:肝26 例、肺15 例、腹部淋巴结18 例、其他部位17 例。治疗组男性30 例,女性17 例;年龄35~76 岁,平均年龄(56.79±8.14)岁;BMI 18~25,平均BMI(22.06±1.39)kg/m²;肿瘤大小2~9 cm,平均大小(5.12±1.28)cm;按照病理类型划分:管状腺癌21 例、黏液腺癌14 例、印戒细胞癌7 例、未分化癌5 例;按照病变位置划分:升结肠癌23 例、横结肠癌12 例、乙状结肠癌12 例;按照转移部位划分:肝28 例、肺16 例、腹部淋巴结17 例、其他部位6 例。两组患者各项一般临床资料比较差异无统计学意义,具有可比性。
对照组患者采用XELOX 方案治疗,第1 天静脉滴注注射用奥沙利铂,130 mg/m2;第1~14 天早、晚餐后口服卡培他滨片,1 000 mg/m2,2 次/d。治疗组在对照组基础上静脉滴注注射用卡瑞利珠单抗,200 mg/次,1 次/3 周,滴注2 次。两组患者均治疗6 周。
1.4 疗效评价标准[7]
完全缓解(CR):目标病灶均消失且肿瘤标志物水平正常;部分缓解(PR):较治疗前目标病灶长径之和减少30%以上;疾病进展(PD):较治疗前目标病灶长径之和增加20%以上或出现新发病灶;疾病稳定(SD):介于PD 及PR 标准之间。
疾病控制率=(CR 例数+PR 例数+SD 例数)/总例数
1.5 观察指标
1.5.1 肿瘤标志物 治疗前后1 个月嘱患者随访并测定血清肿瘤标志物大肠特异性抗原-2(CCSA-2)、癌胚抗原(CEA)、糖类抗原19-9(CA19-9)水平,取晨起空腹静脉血3 mL,以8 cm 半径、3 500 r/min离心15 min 获得上层血清,以电化学发光法测定CCSA-2、CEA、CA19-9(上海美轩生物公司)。
1.5.2 血管新生指标 治疗前后1 个月嘱患者随访并采用酶联免疫吸附法测定血清中血管新生指标血管内皮生长因子(VEGF-A)和VEGF 受体 2(VEGFR2)水平(武汉华美生物公司试剂盒)
1.5.3 生活质量核心量表(QLQ-C30)评分 治疗前后1 个月嘱患者随访并应用QLQ-C30 评分评估,QLQ-C30 总分值范围为0~100 分,功能维度和总体生活质量维度得分越高说明功能状况越好,症状维度得分越高说明症状越严重、生活质量越差[8]。
1.6 不良反应观察
统计两组患者不良反应发生情况,包括贫血、粒细胞减少、恶心呕吐、血小板减少等。
1.7 统计学方法
采用统计学软件SPSS 25.0 处理数据,计数资料以例数描述,采用χ2检验,计量资料以x± s 描述,采用t 检验。
2 结果
2.1 两组临床疗效比较
治疗后,治疗组疾病控制率为80.85%,较对照组61.70%明显升高(P<0.05),见表1。

表1 两组临床疗效比较Table 1 Comparison on clinical efficacy between two groups
2.2 两组肿瘤标志物比较
治疗后,两组患者血清CCSA-2、CEA、CA19-9 水平较治疗前明显降低(P<0.05),且治疗组明显低于对照组(P<0.05),见表2。
表2 两组肿瘤标志物比较( )Table 2 Comparison on serum tumor markers between two groups ()

表2 两组肿瘤标志物比较( )Table 2 Comparison on serum tumor markers between two groups ()
与同组治疗前比较:*P<0.05;与对照组治疗后比较:▲P<0.05。*P < 0.05 vs same group before treatment;▲P < 0.05 vs control group after treatment.
2.3 两组血管新生指标比较
治疗后,两组患者血清VEGF-A、VEGFR2 水平均较治疗前明显降低(P<0.05),且治疗组较对照组降低更明显(P<0.05),见表3。
表3 两组血管新生指标比较( )Table 3 Comparison on serum angiogenesis indexes between two groups ()

表3 两组血管新生指标比较( )Table 3 Comparison on serum angiogenesis indexes between two groups ()
与同组治疗前比较:*P<0.05;与对照组治疗后比较:▲P<0.05。*P < 0.05 vs same group before treatment;▲P < 0.05 vs control group after treatment.
2.4 两组QLQ-C30 评分比较
治疗后,两组患者QLQ-C30 评分较治疗前明显升高(P<0.05),且治疗组较对照组升高更明显(P<0.05),见表4。
表4 两组QLQ-C30 评分比较( )Table 4 Comparison on QLQ-C30 scores between two groups()
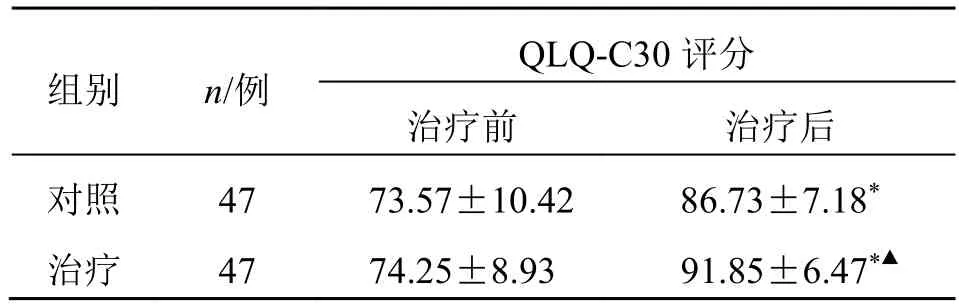
表4 两组QLQ-C30 评分比较( )Table 4 Comparison on QLQ-C30 scores between two groups()
与同组治疗前比较:*P<0.05;与对照组治疗后比较:▲P<0.05。*P < 0.05 vs same group before treatment;▲P < 0.05 vs control group after treatment.
2.5 两组不良反应比较
两组不良反应发生率比较差异无统计学意义,见表5。

表5 两组不良反应比较Table 5 Comparison on adverse reactions between two groups
3 讨论
目前,临床治疗不可切除的晚期结肠癌多采用化疗,XELOX 方案(奥沙利铂联合卡培他滨)作为一线方案显示了良好疗效[9-10]。奥沙利铂可通过产生烷化结合物抑制DNA 合成与复制,进而诱导肿瘤细胞凋亡。卡培他滨是抗代谢氟嘧啶脱氧核苷氨基甲酸酯类药物,可干扰细胞RNA、蛋白质合成[11]。但仅采用XELOX 方案的晚期结肠癌患者临床控制率有待进一步提高[12],因此临床需寻找新的有效方案以提升晚期结肠癌患者的治疗效果。
近年来,以PD-1/PD-L1 为靶点的免疫治疗成为肿瘤治疗研究热点。PD-1 属免疫球蛋白CD28/B7超家族成员,为Ⅰ型跨膜蛋白,具有免疫抑制性受体作用,可通过与其配体PD-L1 结合,引起蛋白激酶激活与磷脂酰肌醇-3-激酶磷酸化反应,刺激T 细胞活化,激活机体内源性抗肿瘤反应[13-14]。卡瑞利珠单抗作为人源化免疫球蛋白G4 型单克隆抗体,可通过阻断PD-1/PD-L1 通路恢复机体免疫功能,发挥抗肿瘤效应[15]。目前,卡瑞利珠单抗已在多种实体瘤中开展了临床试验[16],周梦熙等[17]研究显示,相较于单纯化疗,联合应用卡瑞利珠单抗可有效延长复发或晚期转移性食管鳞癌患者的总生存期;武玮等[18]研究表明,卡瑞利珠单抗联合化疗治疗非小细胞肺癌总有效率为64.0%,其中新辅助治疗有效率、一线治疗有效率、二线及后期治疗有效率分别为70.8%、63.6%、25.0%。本研究发现,卡瑞利珠单抗联合XELOX 方案治疗结肠癌患者,疾病控制率由61.70%增至80.85%,由此可知,在XELOX 方案的基础上联合卡瑞利珠单抗可提高抗肿瘤效果。CCSA-2、CEA、CA19-9 均为结肠癌常见肿瘤标志物,其水平随患者病情进展而发生变化,可用于肿瘤早期诊断、疗效监测及预后预测[19-20]。同时,应用卡瑞利珠单抗联合XELOX 方案的患者血清CCSA-2、CEA、CA19-9 水平显著较低,提示卡瑞利珠单抗通过阻断PD-1/PD-L1 通路阻断PD-1/PDL1 通路恢复机体免疫功能,抑制肿瘤细胞持续增殖,进而减少肿瘤相关抗原释放,降低肿瘤标志物水平。另外,两组不良反应发生率比较差异无统计学意义,表明卡瑞利珠单抗的使用不会增加不良反应发生率。
研究指出,血管新生贯穿整个恶性肿瘤发生、发展过程,肿瘤血管生成受血管生成因子诱导,其中VEGF 为最强血管生成刺激因子,研究证实,VEGFA/VEGFR2 通路是促使肿瘤血管新生的关键通路[21-22]。本研究数据显示,治疗后治疗组血清VEGF-A、VEGFR2 水平较对照组降低,可见卡瑞利珠单抗联合XELOX 方案治疗结肠癌患者,可进一步降低血清VEGF-A、VEGFR2 水平,抑制肿瘤血管新生。通过构建正常化缺陷小鼠模型,研究发现,阻断免疫检查点可激活辅助性T(Th)细胞并诱导血管正常化,提示肿瘤血管与免疫系统间存在相互作用[23]。卡瑞利珠单抗抑制肿瘤血管新生机制可能为,通过阻断PD-1/PD-L1 通路激活T 细胞,调节免疫系统重编程并作用于肿瘤血管,促使肿瘤血管正常化,抑制VEGF-A、VEGFR2 等细胞因子生成。
综上可知,卡瑞利珠单抗联合XELOX 方案可有效改善晚期结肠癌患者血清中异常肿瘤标志物及VEGF-A、VEGFR2 等血管生长因子水平,提高生活质量,疗效显著,且安全性高。
利益冲突所有作者均声明不存在利益冲突

