基于网络药理学、分子对接技术及实验验证探讨新橙皮苷治疗创伤性脑损伤作用机制
王伸盛,张新中,张岱男,岳双柱,杨卫泷,李文超
新乡医学院第一附属医院 河南省神经修复重点实验室,河南 新乡 453100
创伤性脑损伤是指由外部物理力量引起的大脑神经功能障碍[1]。据统计,全世界每年有5 000 多万人遭受颅脑损伤[2]。颅脑损伤包括原发性和继发性,原发性损伤与大脑的原发外部影响直接相关,继发性损伤在原发性损伤后几分钟到几天内发生,通过氧化应激、炎症反应、细胞凋亡等机制,进一步损害神经细胞,破坏血脑屏障,引起严重脑水肿[3]。研究发现,继发性脑损伤在很大程度上决定了颅脑损伤患者的预后情况[4]。
新橙皮苷是一种二氢黄酮苷类化合物,作为一种传统中药枳实的主要成分,具有抗氧化[5]、降低炎性反应[6]、抗凋亡[7]等作用。研究表明,新橙皮苷可以穿透血脑屏障[8],即使在大鼠中每天750 mg/kg剂量持续91 d 未见明显毒性反应[9]。新橙皮苷在脑缺血实验中通过抑制神经细胞的凋亡和氧化应激,减轻神经元损伤,增强大脑的抗氧化能力,从而减轻脑缺血再灌注损伤,显著改善神经功能[10],但对大鼠创伤性脑损伤后的神经保护机制尚未见报道。
网络药理学以广泛的数据库为基础,已成为系统揭示复杂生物系统功能和行为的有力工具,可全面揭示多成分药物植物中多成分-多靶点-多通路的作用机制[11],本研究利用通过网络药理学方法及动物实验探讨新橙皮苷治疗创伤性脑损伤的神经保护作用机制,为后续药物研发的开展提供依据。
1 材料与方法
1.1 实验动物
SPF 级SD 雄性大鼠72 只,体质量(200±20)g,购自济南朋悦实验动物繁育有限公司,动物生产合格证号SCXK(鲁)20220006,此实验经过新乡医学院第一附属医院伦理委员会批准,动物实验伦理批文号EC-022-206。
1.2 主要试剂与仪器
新橙皮苷(质量分数≥97%,批号N886330)购于上海麦克林生化科技股份有限公司;ELISA 试剂盒购自武汉菲恩生物科技有限公司;TUNEL 试剂盒购自武汉赛维尔生物科技有限公司;PCR 引物购自上海生工公司;RNA 提取及逆转录试剂盒购自天根生化科技(北京)公司;倒置荧光显微镜成像系统购自德国Carl Zeiss 公司,Quantitation DX 实时荧光定量PCR 仪购自美国ABI 公司。
1.3 网络药理学
1.3.1 新橙皮苷靶点的预测 使用TCMSP 数据库(https://old.tcmsp-e.com/tcmsp.php)、Pharmmapper数据库(http://www.lilab-ecust.cn/pharmmapper/)、BATMAN-TCM 数据库(http://bionet.ncpsb.org.cn/batman-tcm/)和SwissTargetPrediction 数据库(http://www.swisstargetprediction.ch/),并查阅相关文献,对新橙皮苷的潜在靶点进行预测,在去重后,经Uniprot 蛋白质数据库(https://www.uniprot.org/)将靶点信息进行规范化处理。
1.3.2 创伤性脑损伤靶点的收集 基于OMIM 数据库(https://www.omim.org/)和TCMIP 数据库(http://www.tcmip.cn/TCMIP/index.php)[12]、Drug Bank 数据库(https://go.drugbank.com/)、Pharmgkb数据库(https://www.pharmgkb.org/)、TTD 数据库(http://db.idrblab.net/ttd/ )、GeneCards 数据库(https://www.genecards.org/),以关键词“traumatic brain injury”进行检索,获得创伤性脑损伤的疾病靶点,合并数据去重后,利用UniProt 数据库将靶点信息进行规范化处理。
1.3.3 蛋白质相互作用(PPI)网络的构建和核心靶点筛选 使用Venny 2.1.0 获得新橙皮苷、创伤性脑损伤的交集靶点并绘制Venn 图,并导入STRING数据库(https://cn.string-db.org/)中,设置种属为“Home sapiens”,得到PPI 网络,利用Cytoscape 3.8.0的Network Analysis 插件对得到的PPI 网络进行拓扑分析,应用CytoHubba 插件基于最大团中心性(MCC)算法来确定PPI 排名前10 位的节点作为核心靶点。
1.3.4 靶点基因本体(GO)功能与京都基因与基因组百科全书(KEGG)通路富集分析 利用David 数据库(https://david.ncifcrf.gov/home.jsp),对新橙皮苷-创伤性脑损伤交集靶点进行GO 功能与KEGG通路富集分析,设置物种为“Homo sapiens”,其中GO 功能分析包括生物功能(BP)、细胞成分(CC)、分子功能(MF)3 部分,将结果导入微生信软件,画图并分析。
1.3.5 分子对接[13]验证新橙皮苷与核心靶点的结合能力 在PubChem 数据库获取新橙皮苷的结构式,将1.3.3 项下筛选的核心靶点作为分子对接的靶点蛋白,靶点蛋白结构从PDB 数据库获得PDB ID,在PDB 数据库中下载蛋白3D 结构。用Pymol和Autodock 软件对靶点蛋白进行去水、去配体、加氢、分配电荷处理,采用AutoDockTools 1.5.7 软件完成分子对接,最后利用PyMol 软件处理结果。
1.4 动物实验验证
1.4.1 分组、造模与给药 将大鼠适应性喂养1 周后,随机分为假手术组、模型组和新橙皮苷组,每组24 只。模型组和新橙皮苷组采用改良Feeney's 法造模,即沿头部中线切开皮肤,分离皮下组织暴露颅骨,定位右侧中线旁2.5 mm,冠状缝后1.5 mm处,使用颅骨磨钻打开直径约5 mm 骨窗,保持硬脑膜完整,调节自由落体打击装置,对准骨窗,于30 cm 处使用20 g 砝码自由落体打击骨窗,假手术组只头皮切开、游离骨膜、打开骨窗,不进行自由落体打击。脑损伤大鼠出现短暂的呼吸暂停、四肢抽搐且昏迷2 h 以上者为造模成功[14]。新橙皮苷组于脑损伤后ip 生理盐水稀释的新橙皮苷40 mg/kg,给药剂量参考文献报道[11]设置,假手术组和模型组给予ip 等量的生理盐水,1 次/d,共给药7 d。
1.4.2 大鼠神经功能评估 于造模后第1、2、3、5、7 天对各组大鼠采用神经功能缺损(mNSS)法进行评估,mNSS 评分包括运动、感觉、反射和平衡测试,评分越高表明大鼠神经功能障碍越严重。
1.4.3 大鼠脑组织病理观察 采用尼氏染色法进行观察。每组选取造模后3 d 大鼠5 只,ip 戊巴比妥钠麻醉,用生理盐水和4%多聚甲醛心脏灌注后断头取脑,用4%多聚甲醛固定液固定,石蜡包埋切片,行尼氏染色,镜下观察脑组织神经元细胞病理形态学,并拍照记录。
1.4.4 大鼠脑组织凋亡细胞情况 采用TUNEL 染色法进行观察。取1.4.3 项下脑组织石蜡切片,参照TUNEL 试剂盒说明书步骤进行检测,依次采用TUNEL 反应混合液、DAPI 染色,封片后使用荧光显微镜观察损伤灶及周围脑组织并拍照,每张切片中随机取6 个视野,使用Image J 图像分析软件计数凋亡细胞和总细胞(结果取平均值),计算凋亡率。
1.4.5 大鼠脑组织中炎症因子含量测定 每组选取造模后3 d 大鼠5 只,ip 戊巴比妥钠麻醉,断头取脑,取损伤灶及边缘2 mm 区域,按照脑湿质量与生理盐水100 mg∶0.9 mL 的比例进行组织匀浆,经研磨仪破碎处理,离心后取其上清液,采用ELISA法检测肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-6、IL-1β 含量,具体操作参照相应试剂盒说明书。
1.4.6 qRT-PCR法检测大鼠脑组织血管内皮生长因子(VEGF)、酪氨酸蛋白激酶(SRC)、蛋白激酶B1(Akt1)mRNA 表达水平 根据试剂盒说明书操作从受损脑组织中提取RNA。经逆转录扩增后,采用荧光定量PCR 仪(QuantStudio DX)进行常规溶解曲线分析,测定Ct 值,采用2-ΔΔCt法计算各组目的基因的表达水平,结果以β-actin 作为内参基因,引物序列见表1。

表1 PCR 引物序列Table 1 PCR primer sequence
1.4.7 统计学方法 结果采用SPSS 26.0 统计软件分析,计量资料采用表示,多组间比较采用单因素方差分析,组间多重比较采用SNK-q检验。
2 结果与分析
2.1 新橙皮苷靶点的收集
通过数据库检索并经过查阅文献报道[15]补充相关作用靶点,比较分析去除重复值后获得322 个作用靶点。
2.2 创伤性脑损伤靶点的获取
基于使用OMIM、TCMIP、DrugBank、TTD、GeneCards 等数据库,获取创伤性脑损伤的作用靶点,合并数据库去除重复值后,获得创伤性脑损伤疾病相关作用靶点1 470 个。
2.3 新橙皮苷治疗创伤性脑损伤共同靶点的网络构建及分析
通过Venny 图获得新橙皮苷治疗创伤性脑损伤的交集靶点85 个,见图1。利用Cytoscape 3.8.0 软件构建“新橙皮苷-靶点-创伤性脑损伤”关系网络,见图2。
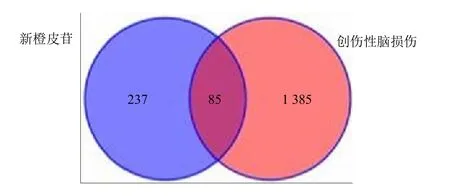
图1 Venn 图Fig.1 Venn diagram

图2 新橙皮苷-靶点-创伤性脑损伤复杂网络Fig.2 Neohesperidin -target-traumatic brain injury complex network
2.4 新橙皮苷和创伤性脑损伤PPI 网络的构建和分析
将85 个交集靶点导入STRING 数据库构建PPI网络见图3,该网络共有85 个节点和362 条边,使用Cytoscape 3.8.0 的CytoHubba 插件基于MCC 算法来确定PPI 排名前10 位的节点作为核心靶点有基质金属蛋白酶9(MMP9)、环加氧酶2(PTGS2)、过氧化物酶体增殖激活受体γ(PPARG)、表皮生长因子受体(EGFR)、丝裂原活化蛋白激酶(MAPK)8、IL-6、SRC、MAPK14、TNF、Akt1,见图4。
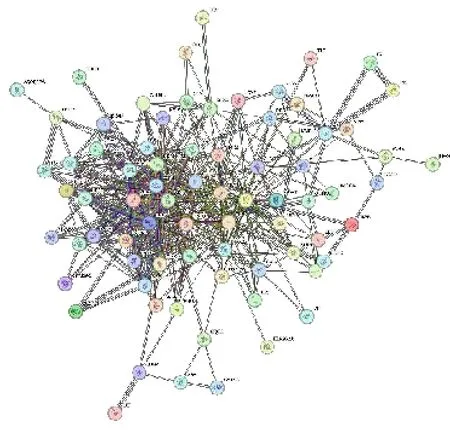
图3 交集靶点PPI 网络图Fig.3 PPI network diagram of intersection target

图4 核心靶点PPI 网络图Fig.4 Core target PPI network diagram
2.5 GO 功能与KEGG 通路富集分析
GO 富集分析结果表明,CC 主要涉及质膜、胞外区、膜筏;生物过程主要涉及对细胞凋亡过程的负调控、对异种刺激的反应、蛋白水解作用;MF 主要涉及相同蛋白结合、酶结合、蛋白质丝氨酸/苏氨酸/酪氨酸激酶活性、蛋白激酶活性,根据Count 值筛选出每个模块的前10 个项目,并将其可视化,见图5。

图5 GO 功能富集分析Fig.5 GO functional enrichment analysis histogram
KEGG 通路富集分析结果显示,新橙皮苷治疗创伤性脑损伤的关键靶点可能主要集中在内分泌抵抗、VEGF 信号通路、TNF 通路、Rap1 信号通路等,其可能主要通过抗炎、抗凋亡途径起到保护神经作用,根据P值选出前20 项结果,并绘制气泡图,见图6。

图6 KEGG 通路富集分析Fig.6 KEGG pathway enrichment analysis bubble diagram
2.6 分子对接结果
将新橙皮苷与10 个核心靶点分别进行分子对接。分子对接的稳定性一般通过结合能的大小来体现,结合能越小,结合两者的能量所需越少,结构越稳定。当结合能小于-5.0 kcal/mol(1cal=4.2 J)表示具有较好的结合能力,结果表明,新橙皮苷与10 个核心靶点之间结合活性良好,见表2,提示新橙皮苷可能通过作用于以上10 个核心靶点发挥治疗创伤性脑损伤的作用,见图7。
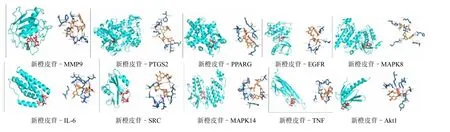
图7 新橙皮苷与核心靶蛋白的分子对接图Fig.7 Molecular docking diagram of neohesperidin and core target protein

表2 新橙皮苷与核心靶点的结合能Table 2 Binding energy between neohesperidin and core target
2.7 实验验证
2.7.1 大鼠mNSS 评分 在第1~7 天,相较于假手术组,模型组大鼠mNSS 评分显著升高(P<0.05),在第2~7 天时,与模型组比较,新橙皮苷组大鼠mNSS 评分均显著降低(P<0.05),见表3。
表3 各组大鼠神经功能缺损mNSS 评分(,n =6)Table 3 mNSS score for neurological deficits in each group of rats (,n =6)

表3 各组大鼠神经功能缺损mNSS 评分(,n =6)Table 3 mNSS score for neurological deficits in each group of rats (,n =6)
与假手术组比较:*P<0.05;与模型组比较:#P<0.05。*P < 0.05 vs sham-operation group;#P < 0.05 vs model group.
2.7.2 大鼠脑组织病理学变化 给药3 d 后,尼氏染色显示,假手术组神经元细胞排列有序,细胞形态规则,染色较淡,核仁明显;模型组脑组织损伤灶神经元细胞排列紊乱而稀松,细胞固缩,神经元数量减少;新橙皮苷组正常形态细胞较多,排列相对规则,固缩减轻,神经元细胞及尼氏小体数量显著增加,见图8。

图8 新橙皮苷对创伤性脑损伤大鼠脑组织损伤灶病理变化的影响(尼氏染色,×400)Fig.8 Effect of neohesperidin on pathological changes of brain tissue injury foci in traumatic brain injury rats(Niss staining,×400)
2.7.3 大鼠脑组织神经细胞凋亡情况 给药3 d 后,相较于假手术组,模型组大鼠脑组织细胞凋亡率明显上调(P<0.05),与模型组比较,新橙皮苷组大鼠脑组织细胞凋亡率的显著降低(P<0.05),见图9、10。
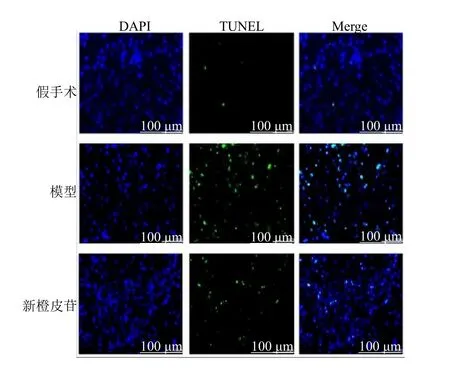
图9 给药3 d 后各组大鼠脑组织损伤灶神经细胞凋亡情况(Tunel,×400)Fig.9 Neurocell apoptosis in the injury foci of rat brain tissue in each group after 3 d of drug administration(Tunel staining,×400)

图10 各组大鼠脑组织损伤灶神经元凋亡率Fig.10 Neuronal apoptosis rate of brain tissue injury lesion
2.7.4 大鼠脑组织炎症因子含量比较 与假手术组相比,模型组大鼠损伤灶中炎症因子IL-6、IL-1β、TNF-α 的含量显著升高(P<0.05),相较于模型组,新橙皮苷组大鼠损伤灶中炎症因子IL-6、IL-1β、TNF-α 的含量明显下降(P<0.05),见图11。

图11 各组大鼠脑组织中IL-6、IL-1β、TNF-α 含量(,n =6)Fig.11 Levels of IL-6,IL-1β,and TNF-α in the brain tissue of rats in each group (,n =6)
2.7.5 大鼠脑组织VEGF、SRC、AKT1mRNA 表达量的比较 给药3 d 后,相较于假手术组,模型组大鼠脑组织中SRC、Akt1mRNA 表达水平均显著下调,而VEGFmRNA 表达水平明显上调(P<0.05),与模型组相比较,新橙皮苷组大鼠脑组织中VEGF、SRC、AKT1mRNA 表达水平明显上调(P<0.05),见图12。

图12 新橙皮苷治疗对大鼠脑组织VEGF、SRC、AKT1 mRNA 表达量的影响(,n =6)Fig.12 Effect of neohesperidin treatment on the expression of VEGF,SRC,and Akt1 mRNA in rat brain tissue (,n =6)
3 讨论
目前,创伤性脑损伤已成为全球第3 大死因[16]。全球每年有超过5 000 万人患有不同程度的创伤性脑损伤[17]。严重的创伤性脑损伤会导致痴呆、长期残疾或死亡,并且预后不良,给家庭和社会带来沉重的经济负担[18]。创伤性脑损伤包括原发性损伤和继发性损伤。其中,由机械力造成的原发性神经损伤通常为难逆甚至不可逆。因此,如何早期减轻继发性脑损伤具有非常重要的意义[19]。本研究为探讨新橙皮苷治疗创伤性脑损伤的作用机制,通过网络药理学方法筛选出新橙皮苷的主要作用靶点,并应用动物实验验证了筛选的预测结果。
通过网络药理学和分子对接技术筛选并验证了10 个核心靶基因,包括MMP9、PTGS2、PPARG、EGFR、MAPK8、IL-6、SRC、MAPK14、TNF、Akt1等,其中MMP9与脑水肿发生密切相关,过度表达可导致血脑屏障通透性增加,加重脑水肿[20]。PTGS2 可将花生四烯酸转化为生物活性前列腺素,脑损伤后急性炎症级联反应中发挥核心作用[21]。PPARG 具有保护中枢神经系统的作用,表现为抑制炎症、抑制神经元凋亡、保护血脑屏障等[22]。EGFR信号通路激活,引起小胶质细胞活化,产生IL-6、IL-1β 和TNF-α 等炎症因子,从而加速神经细胞损伤[23]。MAPK8 又称为JNK,属于MAPK 家族,在炎症与细胞凋亡等应激反应中发挥重要作用[24]。IL-6 在创伤性脑损伤后炎症反应、神经创伤修复等方面起着重要作用,研究表明,IL-6 作为变化指标能提高对创伤性脑损伤不良预后的预测特异性和敏感性[25]。SRC 是一种非受体蛋白酪氨酸激酶,可调节细胞外信号调节激酶,继而发挥脑保护作用[26]。MAPK14 是MAPKs 超家族的一员,在颅脑创伤后病情发展的信号传递过程中发挥着重要作用[27]。Akt1 可以通过抑制细胞凋亡过程参与细胞存活途径,可以阻止细胞凋亡从而促进细胞存活[28]。TNF是重要的免疫调节和炎症因子,参与创伤性脑损伤后炎症反应等过程[29],TNF-α 在脑组织中高表达具有神经毒性,可加速神经细胞的死亡[30]。GO 生物过程富集分析结果显示,新橙皮苷可能通过对细胞凋亡过程的负调控、磷脂酰肌醇3-激酶(PI3K)信号的正调控过程、蛋白水解作用参与生物过程。KEGG 通路富集分析发现,新橙皮苷可能主要通过抗凋亡、抗炎等途径治疗创伤性脑损伤,保护神经功能,主要涉及VEGF 信号通路、Rap1 信号通路、TNF 信号通路等。新橙皮苷与MMP9、EGFR、MAPK8、IL-6、TNF、Akt1 等10 个核心靶点均具有较好的结合活性及稳定性,具有良好的亲和力。上述核心靶点与VEGF 信号通路明显相关,表明新橙皮苷可能通过VEGF 信号通路治疗创伤性脑损伤。研究发现,VEGF 信号通路在血管新生、血管通透性、增强神经元细胞的再生与分化等方面发挥重要作用[31]。据报道,发生创伤性脑损伤后,脑组织损伤区域VEGF 表达上调,促进微血管发生,改善损伤大脑缺血缺氧状态,促进脑损伤神经修复。并且VEGF 可以通过参与损伤血管的修复与再生,可以加快损伤区域脑组织新血管的形成及微环境的构建,从而达到修复受损神经组织的目的[32]。SRC为VEGF 通路的下游基因。SRC 蛋白激活后会进一步促使PI3K/Akt 通路激活[33],在PI3K 通路中,PI3K 激活后诱导Akt 自身磷酸化,来调节下游底物表达,如Foxo、Caspase-9、mTOR 等,通过激活数个信号转导通路发挥多重生物学效应,包括抗氧化、调节细胞周期、抗炎、抗凋亡等作用。基于网络药理学预测结果,通过体内实验表明,新橙皮苷治疗可以改善神经功能缺损,减轻神经细胞损伤,抑制细胞凋亡,并且显著抑制创伤性脑损伤大鼠脑组织中炎症因子IL-6、IL-1β、TNF-α 的表达,同时明显上调VEGF、SRC、Akt1mRNA 表达水平,从而发挥神经保护作用。
综上所述,本研究采用网络药理学、分子对接及体内实验初步预测了新橙皮苷治疗创伤性脑损伤关键靶点及通路。新橙皮苷可能通过MMP9、PTGS2、PPARG、EGFR、MAPK8、IL-6、SRC、MAPK14、TNF、Akt1 等核心靶点,通过干预VEGF信号通路、TNF 通路、Rap1 信号通路等通路,进而发挥治疗创伤性脑损伤的作用,本研究可为新橙皮苷治疗创伤性脑损伤的进一步实验及临床研究提供参考,但相关研究结果仍有待进一步的生物学验证。
利益冲突所有作者均声明不存在利益冲突

