β-环糊精-聚乙二醇-7-乙基-10-羟基喜树碱胶束在大鼠体内的药动学研究
彭于之 ,姜良竹 ,徐传锡 ,王志强,孙勇兵*
1.江西中医药大学 中药固体制剂制造技术国家工程研究中心,江西 南昌 330004
2.江西中医药大学 药学院,江西 南昌 330004
伊立替康是喜树碱类拓扑异构酶I 抑制剂[1],用于转移性结直肠癌、胰腺癌等的临床治疗。伊立替康本质上是一种前药,需要在羧酸酯酶作用下转化为活性代谢物7-乙基-10-羟基喜树碱(SN38)才能发挥疗效[2]。然而,仅有2%~8%的伊立替康可转化为活性的SN38。SN38 在多种肿瘤细胞株上表现出比伊立替康高10~1 000 倍的抗肿瘤活性[3-5]。直接用SN38 作为抗癌药物无需体内酯酶的激活,可以克服伊立替康的代谢激活缺陷。目前开发SN38靶向给药系统已成为大型制药企业竞相开展的重要课题。浙江海正药业开发的SN38 胶束制剂PEGSN38 已经进入了I 期临床[6-7];日本化药株式会社开发的载SN38 胶束制剂NK012 已经进入II 期临床,而且被美国食品药品管理局批准作为治疗非小细胞肺癌的治疗药物[8-9]。SN38 脂质体的研究也是一个热门[10-11]。在前期研究中,本课题组以β-环糊精-聚乙二醇作为亲水端,通过酯键将SN38 的20位羟基与β-环糊精-聚乙二醇相连,构建了两亲性聚合物β-环糊精-聚乙二醇-7-乙基-10-羟基喜树碱胶束(β-CD-PEG-SN38),该聚合物能在水性介质中自组装成100 nm 左右的胶束。为了更好地了解β-CDPEG-SN38 在体内的动态行为,开展其的药动学研究是非常有必要的。本研究建立了HPLC-MS/MS 法测定大鼠血浆中游离型和键合型SN38,考察了β-CD-PEG-SN38 胶束在大鼠体内的药动学,以期为新药开发提供更多的支持。
1 仪器和材料
Nexera LC-40 超高效液相系统(配备自动进样器和二元泵,日本Shimadzu 公司),API4500 三重四级杆质谱仪(美国AB Sciex 公司),ST8R 超高速离心机(美国Thermo Fisher 公司)。
SN38 原料药[质量分数大于 99.8%,批号20221005,凯立德生物医药技术(上海)有限公司],盐酸小檗碱(质量分数大于99.5%,批号20221021,江西本草天工科技有限公司)。甲醇、乙腈(色谱级,美国Fisher Scientific 公司),甲酸(色谱级,上海麦克林公司),纯净水(自制),其余试剂均为分析纯。
β-CD-PEG-SN38 胶束由江西中医药大学自制,HPLC 法测得SN38 的载药量为11.2%。SD 大鼠由江西中医药大学实验动物中心提供,动物使用许可证号SYXK(赣)2022-0002。药动学实验得到江西中医药大学实验动物伦理委员会批准。
2 方法和结果
2.1 色谱和质谱条件
色谱条件:月旭Welch C18色谱柱(50 mm×2.1 mm,1.7 μm);流动相为水(含0.1%的甲酸溶液,A)-乙腈(含0.1%的甲酸溶液,B),梯度洗脱(洗脱程序为0~0.4 min,5% B;0.4~4.5 min,5%~80% B;4.51~6.0 min,80%~5% B);柱温是40 ℃;体积流量0.2 mL/min;进样量是1 μL。
质谱条件:ESI 源,正离子检测,多反应监测(MRM)方式扫描;离子通道:393.1→349.1(SN38),336.1→320.0(内标小檗碱)。源电压为5 500 V,Gas1(N2)为60 psi(1 psi=6 895 Pa),Gas2(N2)为60 psi,离子源温度是600 ℃;Curtain gas(N2)为40 psi,CAD Gas(N2)为9 psi。
2.2 溶液的制备
2.2.1 标准溶液和质量控制(QC)标准溶液的制备 精密称取SN38 对照品适量,用70%甲醇溶液制备272.0 μg/mL 储备液,然后用70%甲醇溶液依次稀释制备标准曲线工作溶液,SN38 的质量浓度分别为68.0、340.0、680.0、1 360.0、2 720.0、5 440.0、13 600.0、27 200.0、43 520.0、54 400.0 ng/mL。按照同样的方式制备SN38 低、中、高质量浓度(136.0、27 200.0、43 520.0 ng/mL)的QC 标准溶液。所有溶液置于冰箱(4 ℃)保存。
2.2.2 内标溶液的制备 精密称取小檗碱对照品适量,用70%甲醇溶液制备400 μg/mL 储备液,然后用70%甲醇溶液稀释制备250 ng/mL 内标溶液,置于冰箱(4 ℃)保存。
2.3 血浆样品的处理
2.3.1 标准曲线和QC 血浆样品的制备 取标准曲线溶液和QC 工作溶液10 μL,置于具塞玻璃试管中,用氮气吹干,加入空白血浆200 μL,配制SN38 质量浓度在3.4~2 720.0 ng/mL 标准曲线血浆样品,同时制备SN38 低、中、高质量浓度分别是6.8、1 360.0、2 176.0 ng/mL 的血浆QC 样品。
2.3.2 血浆样品的制备 将40 μL 血浆样品置于1.5 mL 离心管中,加入10 μL 内标小檗碱工作溶液、20 μL 水,涡旋2 min,加入330 μL 甲醇溶液,涡旋5 min,于4 ℃、10 000 r/min 离心8 min,取上清液,即得游离型SN38 测定的血浆样品溶液。将40 μL 血浆样品置于1.5 mL 离心管中,加入1 mol/L氢氧化钠溶液10 μL,23 ℃孵育10 min,然后加入1 mol/L 盐酸溶液10 μL,再加入10 μL 内标小檗碱工作溶液,涡旋2 min,加入330 μL 甲醇溶液,涡旋5 min,于4 ℃、10 000 r/min 离心8 min,取上清液,即得SN38 总质量浓度(键合型和游离型之和)测定的血浆样品溶液。质量浓度超过标准曲线最高点的样品用空白血浆稀释10 倍后测定。
2.4 方法学试验
2.4.1 方法选择性 取6 个不同来源的大鼠空白血浆40 μL,除不加入内标小檗碱溶液(补加70%甲醇10 μL),其余按照2.3.2 项下方法操作,得空白血浆样品;取含SN38 6.8 ng/mL 的低质量浓度QC样品40 μL,加入10 μL 内标小檗碱工作溶液,其余按照2.3.2 项下方法操作,得低质量浓度QC 样品;取受试大鼠给药后的血浆40 μL,按照2.3.2 项下方法操作,得大鼠给药样品。取各样品进样测定,色谱图见图1。可以看出SN38 的保留时间为3.923 min,内标物小檗碱的保留时间为3.805 min,血浆中的内源性成分不干扰SN38、小檗碱的测定。
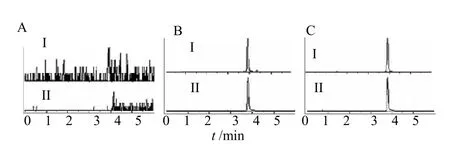
图1 空白血浆(A)、QC 样品(B)和大鼠给药样品(C)的MRM 色谱图Fig.2 MRM chromatograms of blank plasma (A),QC sample (B),and sample from rat (C)
2.4.2 线性回归曲线方程 取标准曲线血浆样品40 μL,加入10 μL 内标小檗碱溶液,按2.3.2 项下方法操作,每个质量浓度进行双样本分析,分别以质量浓度(x)为横坐标,以待测物和内标的峰面积比(y)为纵坐标,以加权(y=1/x2)最小二乘法进行线性回归,得典型的线性回归曲线方程y=4.356×10-4x+2.43×10-4,r=0.992 3,结果表明SN38 的血浆质量浓度在3.4~2 720.0 ng/mL 线性关系良好。
2.4.3 精密度和准确度试验 精确配制6.8、1 360.0、2 176.0 ng/mL 的血浆样品,各5 份,按2.3.2项下方法操作,测定药物质量浓度,同一个质量浓度样品每隔1 h 测定1 次,共3 次,进行日内精密度计算;每隔1 d 测定1 次,共3 次,进行日间精密度计算,结果见表1。在3 种质量浓度下,日内精密度小于6.5%,日间精密度小于6.3%。
表1 精密度试验结果(,n=5)Table 1 Results of precision test (,n=5)
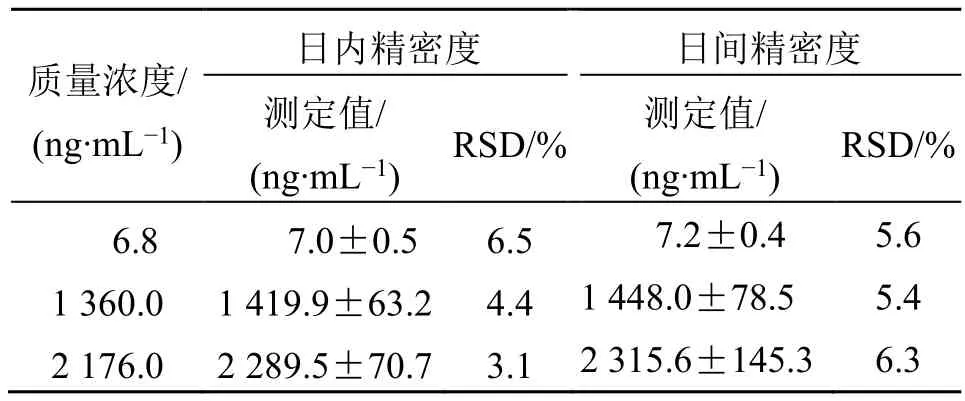
表1 精密度试验结果(,n=5)Table 1 Results of precision test (,n=5)
分别配制6.8、1 360.0、2 176.0 ng/mL 血浆样品,各5 份,按2.3.2 项下方法操作,按标准曲线法计算质量浓度和准确度,见表2。根据药物临床前药动学指导原则,准确度应在85%~115%,RSD 值应小于15%,3 种质量浓度下准确度均符合要求。
表2 准确度试验结果(,n=5)Table 2 Results of accuracy test (,n=5)
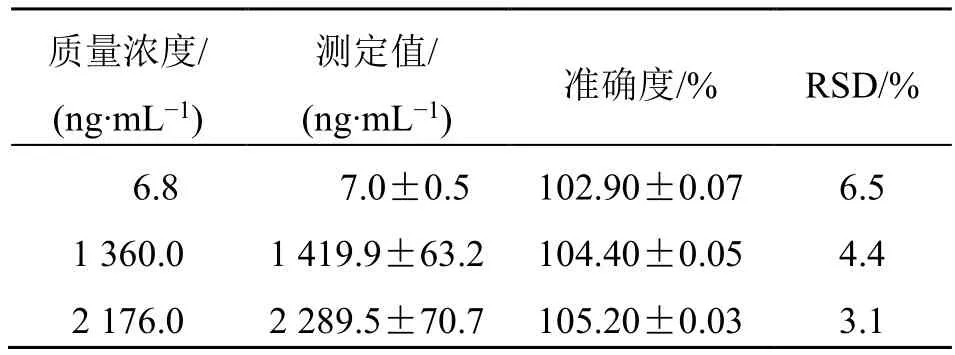
表2 准确度试验结果(,n=5)Table 2 Results of accuracy test (,n=5)
2.4.4 方法提取回收率和基质效应 配制SN38 质量浓度分别是6.8、1 360.0、2 176.0 ng/mL 的QC 血浆样品。取血浆样品40 μL,加入10 μL 内标小檗碱溶液,其余按2.3.2 项下方法操作,测得峰面积A1;另取空白血浆40 μL,先经甲醇沉淀后,加入QC 标准工作溶液,制备未经提取的QC 样品,测得峰面积A2;取混合后的QC 标准工作溶液10 μL,除以水代替空白基质外,其余按2.3.2 项下操作,制备无基质的QC 样品,测得峰面积A3。以提取后的样品峰面积A1除以未经提取的样品峰面积A2计算待测物SN38 和内标小檗碱的回收率。以未经提取的样品峰面积A2除以无基质样品峰面积A3分别计算待测物和内标的基质效应,结果见表3。SN38 的提取回收率在88.5%~95.7%,基质效应在96.4%~103.2%。内标小檗碱的提取回收率和基质效应分别是92.1%、98.3%。
表3 提取回收率和基质效应试验结果(,n=5)Table 3 Result of extraction and matrix effect (,n=5)

表3 提取回收率和基质效应试验结果(,n=5)Table 3 Result of extraction and matrix effect (,n=5)
2.4.5 稳定性试验 配制SN38 质量浓度分别是6.8、2 176.0 ng/mL 的血浆样品,考察样品室温放置2 h、3 个冻融循环(-20~23 ℃)、4 ℃放置24 h、长期放置30 d(-20 ℃)的稳定性,以及处理后的样品的稳定性。结果见表4。
表4 稳定性试验结果(,n=5)Table 4 Result of stability (,n=5)

表4 稳定性试验结果(,n=5)Table 4 Result of stability (,n=5)
2.5 药动学研究
取SD 大鼠12 只,实验前禁食给水过夜,随机分成2 组。大鼠iv β-CD-PEG-SN38 胶束溶液,剂量以SN38 计为6 mg/kg,给药后观察大鼠的腹泻情况,同时用乙醚麻醉大鼠,在5、15、30、45 min 以及1、1.5、2、3、4、6、8、10、24、48 h 眼眶取血0.2 mL。在4 ℃、2 000 r/min 条件下离心10 min,分离血浆,并于-20 ℃冰箱中保存待测。
将同一份血浆分为两份,各40 μL,按照2.3.2项下方法处理,其中1 份用来测定血浆中游离型的SN38 质量浓度,另1 份用来测定血浆中SN38 总质量浓度(键合型和游离型之和),其中血浆中SN38的总质量浓度减去游离型的SN38 质量浓度就是键合型的SN38 质量浓度。
利用Das 软件计算β-CD-PEG-SN38 胶束溶液中SN38 的药动学参数。平均血药浓度-时间曲线见图2,主要药动学参数见表5。结果发现,利用Das 软件处理药动学数据,三室模型能最佳的进行药动学数据的拟合。大鼠iv β-CD-PEG-SN38 胶束溶液后,游离型SN38 和键合型SN38 的AUC 分别是1 490.7、5 060.3 ng/(mL·h),在大鼠血浆中占主导的是键合型的SN38。
表5 药动学参数()Table 5 Pharmacokinetics parameters ()
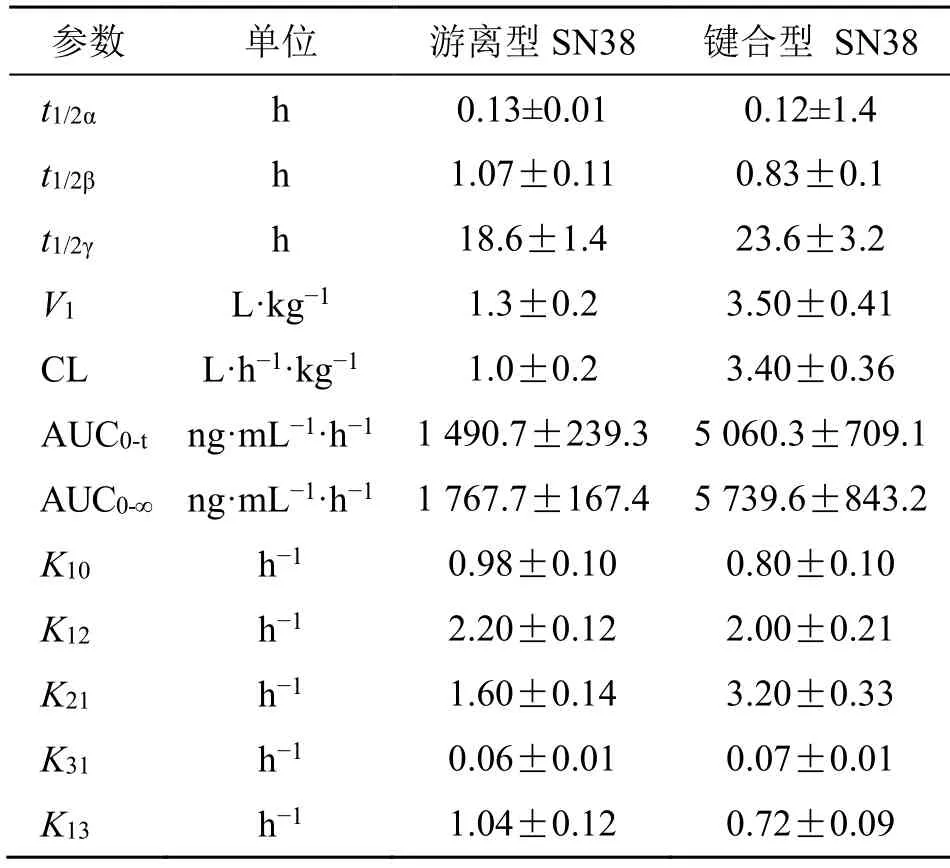
表5 药动学参数()Table 5 Pharmacokinetics parameters ()
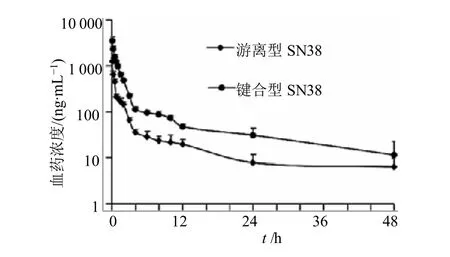
图2 大鼠体内平均血药浓度-时间曲线(,n=6)Fig.2 Mean plasma concentration-time curve of SN38 in rats (,n=6)
3 讨论
本研究建立了测定血浆中SN38 质量浓度的HPLC-MS/MS 方法,通过碱性水解的方法将键合型的SN38 从β-CD-PEG-SN38 胶束上断裂出来,血浆中SN38 的总质量浓度减去游离型的SN38 质量浓度就是键合型SN38 的质量浓度。利用沉淀蛋白法处理样品,操作简单;方法的基质效应很低,适合高通量的药物测定。
聚合物胶束制备工艺简单,胶束能以一个完整的形式达到肿瘤部位,实现肿瘤靶向性。两亲性聚合物胶束的药动学研究是一个具有挑战性的难题。从本研究结果可以看出,键合型SN38 质量浓度显著高于游离SN38 的质量浓度,说明胶束在血浆中具有较好的稳定性,SN38 会更多地以胶束的形式靶向肿瘤部位。键合型SN38 的表观分布容积大,说明胶束在组织中尤其是肿瘤组织中分布较多[7]。
利益冲突所有作者均声明不存在利益冲突

