一株具有多种毒力基因的粪肠球菌噬菌体的研究分析
常军帅,赵 玉,段付霜,屈勇刚,梁 晏,李 娜
(1. 石河子大学动物科技学院 石河子 832003;2.动物疾病防控兵团重点实验室 石河子 832003)
粪肠球菌(Enterococcusfaecalis)是肠球菌属一种寄生于胃肠道的革兰阳性菌,它作为一种机会致病菌,在免疫功能低下的宿主中引起系统性感染,如败血症、心内膜炎或脑膜炎[1-3]。在牛群中,肠球菌与犊牛腹泻和奶牛乳腺炎有关,有实验证明它们的致病性可能会导致不同阶段的乳腺感染[4],奶牛乳房皮肤上存在的肠球菌,也可能污染相应的牛奶样本[5]。除了它们在导致动物发生疾病中的重要性外,携带抗生素耐药性基因的能力方面也值得重视[6]。致病性和耐抗生素的肠球菌可能通过受亚临床或潜伏性乳腺炎感染的生奶制品传播给人类[7-8]。抗生素耐药性每年导致全球70万人死亡[9-10],耐多药细菌的高流行率和现有抗生素治疗的低效率激发了人们寻找可行的替代方案。
噬菌体广泛存在于自然界,凡是有细菌存在的地方就会有相应的噬菌体,噬菌体作为一种感染细菌的病毒,在微生态系统中,具有着重要的地位[11-13]。噬菌体在不同环境压力下都可存活,作为载体,在毒力基因、耐药基因传播过程中发挥着重要作用[11,14]。噬菌体通常携带一些非必要的毒力基因,且与噬菌体的进化存在着连续性[13]。Mazaheri等[15]的一项研究表明,噬菌体EFRM31能够有效地将庆大霉素耐药性转导到多种肠球菌。目前,对于奶牛乳房炎的研究主要集中在病原菌的多样性,而忽视了对噬菌体多样的研究[16-18]。因此本研究中,我们以粪肠球菌SL22作为宿主菌,从临床型奶牛乳房炎乳样中分离粪肠球菌噬菌体,并鉴定其生物学特性及毒力基因、耐药基因存在情况,为进一步研究临床型乳房炎奶牛乳房中的噬菌体多样性、微生态关系奠定基础。
1 材料和方法
1.1 样品来源及菌株准备 47份临床型乳房炎乳样(通过CMT及SCC进行检测)采自北疆某规模化奶牛场;6周龄SPF级小鼠24只(雌雄对半),体重约25 g,购自新疆医科大学医学实验动物中心;试验用菌株均由石河子大学动物科技学院传染病实验室分离鉴定。
1.2 主要培养基和试剂 BHI培养基购自青岛海博生物技术有限公司;琼脂粉、PEG8000、2%磷钨酸负染液购自北京索莱宝科技有限公司;病毒基因 DNA/RNA提取试剂盒购自天根生化科技(北京)有限公司;DNase I、RNase A和Mung Bean Nuclease 购自康为世纪生物科技有限公司;SM缓冲液购自上海源叶生物科技有限公司。
1.3 噬菌体的分离与纯化 以粪肠球菌SL22为宿主菌,加1 mL对数生长期的菌液进入200 mL的BHI培养基后,再与47份临床型乳房炎乳样组成的200 mL样品混匀,在37℃电热恒温培养箱内180 r/min培养。从第12 h开始,每隔2 h取样10 mL,直到第24 h结束。取出的样品在4℃、10 000×g离心15 min,取中间较为清亮的液体过0.22 μm滤膜,之后参考文献[19],用点滴法及双层琼脂平板法检测是否有噬菌体。
采用双层琼脂平板法进行纯化噬菌体,挑取噬菌斑大而透亮的反复纯化5次以上,直到一个平板上噬菌斑大小均匀一致。
1.4 噬菌体的浓缩及电镜观察 参考文献[20],使用PEG8000对噬菌体进行浓缩。浓缩液用氯仿去除杂质后,滴加20 μL于铜网上吸附5 min,用滤纸吸干多余水分,置铜网于2%磷钨酸负染液内作用3 min,干燥后即可在电镜下进行观察。
1.5 噬菌体的基因组鉴定 按照病毒基因 DNA/RNA提取试剂盒说明书对噬菌体进行核酸提取,测定核酸浓度后,分为4组,其中3组分别根据核酸浓度加入一定量的DNase I、RNase A和Mung Bean Nuclease,在37℃水浴锅内作用1 h。作用后的样品加入适量loading buffer,采用琼脂糖(0.7%)凝胶电泳法对消化产物进行检测。
1.6 噬菌体的生物学特性研究
1.6.1 宿主谱的测定 将100 μL对数期菌液与100 μL噬菌体液混匀吸附15 min,利用双层琼脂平板法测定其裂解谱。测定菌株包括SL22、实验室保存的牛源粪肠球菌、鸡源粪肠球菌、金黄色葡萄球菌、大肠杆菌及无乳链球菌。
1.6.2 最佳感染复数测定(multiplicity of infection,MOI) 参考文献[21],略有修改。将已知滴度的噬菌体液与等体积不同浓度的对数生长期宿主菌,按照不同MOI(MOI=100、10、1、0.1、0.01、0.001、0.0001)的比例混匀吸附10 min,加入5 mL的BHI培养基后在37℃恒温振荡器内培养5 h。利用双层琼脂平板法测定不同组的噬菌体效价,单位为PFU/mL。重复3次,取平均值(噬菌斑30~300为有效数据),滴度最高的组为最佳MOI。
1.6.3 一步生长曲线的测定 按照最佳MOI的比例在200 mL的BHI培养基内加入噬菌体及其宿主菌,在不同时间内取5 mL液体,离心后测噬菌体滴度。重复3次,每次2个平行,取平均值绘制一步生长曲线图。
1.6.4 热稳定性的测定 取50 mL已知滴度的噬菌体液,平均分装在30个1.5 mL的无菌EP管内。30个样品根据不同温度(40℃、50℃、60℃、70℃、80℃)分为5个组,各组每隔10 min取1个样品测其滴度,直到取完为止。重复3次,取平均值绘制折线图。
1.6.5 酸碱耐受性的测定 在12个1.5 mL的无菌EP管内,各加入100 μL高滴度的噬菌体液。取900 μL不同pH的无菌BHI培养基加入混匀,在37℃水浴锅内作用1 h,测不同组的噬菌体效价。重复3次,取平均值绘制曲线图。
1.6.6 紫外耐受性的测定 取5 mL噬菌体增殖液置于直径为90 mm的一次性平皿内,开盖放于超净台内的紫外灯(18 W)下15 cm进行照射2 h,期间每隔20 min取100 μL测定噬菌体效价。重复3次,取平均值。
1.6.7 有机溶剂耐受性的测定 在5个1.5 mL的无菌EP管内,各加入500 μL高滴度的噬菌体液,再取500 μL不同的有机溶剂(过氧乙酸、氯仿、异戊醇、甲醇、乙醇)分别加入混匀。在室温下作用1 h,测不同组的噬菌体效价。重复3次,取平均值。
1.7 小鼠治疗试验 参考文献[22],将小鼠随机分为4组,每组6只。第1组每只小鼠腹腔注射1倍LD100的菌液量;第2组每只小鼠腹腔注射1倍LD100的菌液量,2 h后再次注射一定量的噬菌体液(按照最佳MOI的比例);第3组每只小鼠腹腔注射与第2组等体积等滴度的噬菌体液;第4组每只小鼠腹腔注射与1组等体积的生理盐水溶液。观察72 h内小鼠精神状态及死亡情况。
1.8 毒力基因与耐药基因检测 粪肠球菌毒力基因参考文献[23],耐药基因参考文献[24-26]。由北京睿博兴科生物技术有限公司合成,根据参考文献中的合成体系及退火温度,对病毒基因DNA/RNA提取试剂盒提取出的粪肠球菌噬菌体核酸进行PCR鉴定。
2 结果与讨论
2.1 噬菌体的纯化及电镜观察 分离纯化出了1株粪肠球菌噬菌体,暂命名为vB_EcoT_PSL22(简称PSL22)。在双层琼脂平板上,PSL22的噬菌斑呈透明的针尖状(图1)。在电镜下噬菌体PSL22形态呈对称性多面体,直径约66 nm,无尾部(图2)。依据《病毒分类—国际病毒分类委员会第9次报告》中对噬菌体阶元的划分及噬菌体常规命名方法,PSL22为无尾噬菌体,与复层病毒科噬菌体极为相似,进一步鉴定可通过全基因组测序[27-28]。据以往报道,在副溶血弧菌噬菌体、鸡源沙门菌噬菌体中也发现了复层病毒科噬菌体;在奶牛乳房中有长尾噬菌体的存在,这表明可能随着引起奶牛乳房炎的病原菌的不同,乳房内的噬菌体也呈现出多样性[20,29-30]。

图1 噬菌体PSL22 的噬菌斑形态Fig.1 Plaques morphology of phage PSL22

图2 噬菌体PSL22 的透射电镜观察Fig.2 TEM observation of phage PSL22
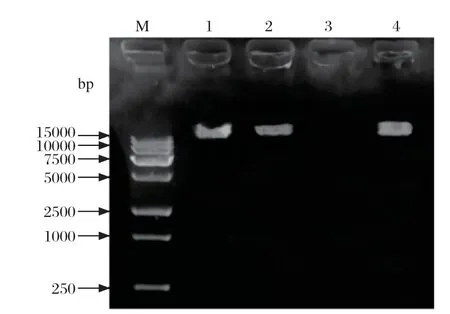
图3 噬菌体PSL22 基因组的鉴定Fig.3 Identif ication of the phage PSL22 Genomes
2.2 PSL22的基因组鉴定 噬菌体PSL22的基因经过不同的核酸消除酶(RNase I、DNase A、 Mung Bean Nuclease)作用后,鉴定出噬菌体PSL22的基因组为双链DNA(Double-stranded DNA,dsDNA)。这与宋增福等[29-30]对复层病毒科噬菌体的核酸类型研究结果一致。
2.3 噬菌体的生物学特性研究 在宿主谱的测定中(表1),PSL22只能裂解其宿主菌,可能受实验室粪肠球菌数量少所影响,后期发现新的菌株可补充测定;对其他粪肠球菌及大肠杆菌、金黄色葡萄球菌、无乳链球菌未发现有裂解现象,这与目前报道的绝大多数噬菌体一样,无跨种裂解能力。在其他生物学测定中,PSL22最佳MOI为0.1(图4A),在奶牛乳房中可裂解大量宿主菌;一步生长曲线中(图4B),确定出了PSL22的感潜伏期约20 min,爆发期约130 min(20~150min ),裂解量约为52 PFU/cell(裂解量=裂解爆发末期噬菌体滴度/初期感染宿主菌浓度),说明该株噬菌体可对宿主菌进行长时间裂解。在热稳定性的测定(图4C)、酸碱耐受性的测定(图4D)、紫外耐受性的测定(图4E)、有机溶剂耐受性的测定(图4F)中,发现PSL22在70℃温度下,40 min就可使PSL22完全失活;对酸不耐受;紫外下2 h就可彻底失活。研究结果说明PSL22生存空间较广泛,对处于不同环境中的宿主菌都能裂解。

表1 噬菌体PSL22 的宿主范围Table 1 Host range of phage PSL22

图4 噬菌体PSL22 生物学特性Fig.4 Biological properties of the phage PSL22
2.4 小鼠治疗试验 通过之前对SL22的测定记录,LD100为5.6×1010CFU/只。为了解PSL22在奶牛乳房内是否有效裂解宿主菌,通过对小鼠分组注射不同的样品(表2),得出PSL22对小鼠的治愈率为33.33%(2/6),说明PSL22在奶牛乳房内可对宿主菌起到裂解作用,进而减少乳房炎的发生。赵影等[29]得出经过噬菌体治疗后,小鼠脏器的病理变化较攻毒组减轻,与本研究结果相同。
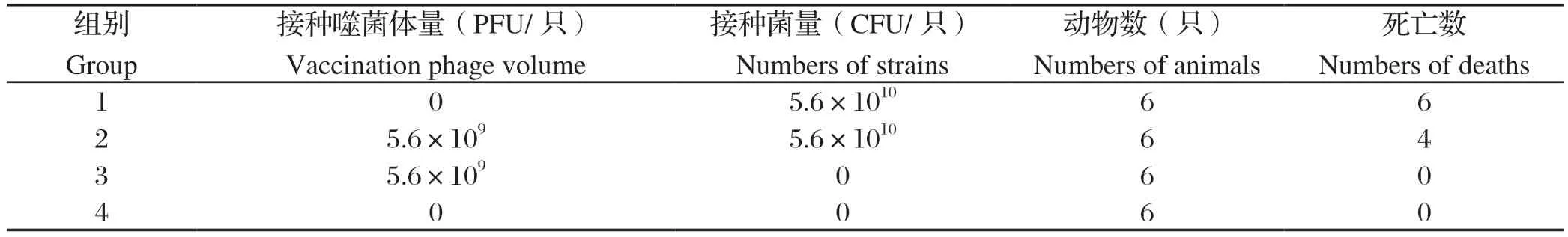
表2 PSL22 对小鼠治疗试验Table 2 PSL22 treatment trial for mice
2.5 毒力基因与耐药基因检测 通过PCR鉴定,发现PSL22含有2个耐药基因,为Acc和aac(3)-IV(图5A)。噬菌体结构简单,作为最佳载体之一,在抗生素耐药基因(ARGs)转导过程中发挥着重要作用。据报道某些ARGs可通过噬菌体在微生态环境中自由传递,进而推动生物的多样性[31]。PSL22含有4种毒力基因,分别为gelE、cylA、ace和efaA(图5B)。噬菌体通常会携带部分病毒非必要基因,宿主菌可通过转化噬菌体编码的毒力基因,来使宿主菌更快适应环境。通过本次检测PSL22存在的潜在风险,将不会考虑将其作为治疗性噬菌体在临床中使用。考虑其科研方面的价值,将来可进一步研究其耐药基因、毒力基因传播的机理。

图5 PSL22 部分基因扩增结果Figure 5 Results of gene amplif ication in PSL22
奶牛乳房微生态系统中,噬菌体与宿主菌的相互利用,促进了微生态的多样性。未来,可通过更先进的方法和手段去了解噬菌体与宿主菌的进化机制,以便全面的解释奶牛乳房中噬菌体与细菌的相互关系。

