牛病毒性腹泻病毒1 型KE-9 基因缺失弱毒疫苗和牛病毒性腹泻病毒2 型NY-93 基因缺失弱毒疫苗在怀孕母牛中垂直传播能力评价
孙艳永,田赵勇,徐 瑞,陈 宁,文世富
(勃林格殷格翰动物保健(中国)有限公司,泰州 225300)
牛病毒性腹泻病毒(Bovine viral diarrhea virus,BVDV)是广泛存在于反刍动物中的一种病毒,给养牛业造成严重的经济损失[1]。BVDV属黄病毒科瘟病毒属成员,BVDV对任何年龄牛均易感,可导致呼吸道疾病、生殖系统疾病、肠道疾病和免疫功能障碍等疾病[2-3]。BVDV感染的主要经济影响是经子宫或胎盘感染导致母畜流产、胎儿先天畸形或牛出生后持续感染(PI)[2-3]。胎牛可经两种方式获得持续性感染。一是在妊娠早期(30~125 d)母牛感染BVDV非致细胞病变生物亚型(noncytopathic,NCP)后,BVDV通过胎盘传播给胎牛,胎牛出生后100%为持续性感染[2-6],这一时期也被认为是造成PI牛的高峰期[7]。二是PI母牛怀孕后将BVDV传染胎牛[8]。PI牛可终生带毒,且连续不断的将病毒排到周围环境中,被认为是BVDV传播的主要源头[9]。妊娠期125~150 d后的胎牛有一定程度的免疫能力,此时感染BVDV可导致先天性感染,造成流产、死胎、先天性缺陷或产出看起来正常的有BVDV抗体的犊牛[3,10]。为母牛注射BVDV疫苗被认为是可以控制PI牛出现的最重要措施。目前,多种疫苗都有能力保护胎牛不受BVDV感染[11-13]。
本研究所用牛病毒性腹泻病毒1型KE-9基因缺失弱毒疫苗和牛病毒性腹泻病毒2型NY-93基因缺失弱毒疫苗均是通过定点突变的方法缺失了整个Npro蛋白的编码区(N端4个密码子除外)和位于Erns的RNA酶活性中心编码区中第349位组氨酸[14-15]。BVDV通过上述双缺失大大降低了病毒的致病性,疫苗毒不能穿越胎盘屏障,对胎牛是安全的[14,16]。本研究根据《农业转基因生物安全管理条例》和《农业转基因生物安全评价管理办法》评价牛病毒性腹泻病毒1型KE-9基因缺失弱毒疫苗和牛病毒性腹泻病毒2型NY-93基因缺失弱毒疫苗对怀孕母牛的安全性,因妊娠前期母牛对BVDV最易感,因此本研究选择孕期在60~90 d的母牛进行试验。
1 材料和方法
1.1 试验动物 中国荷斯坦奶牛16头,孕龄60~90 d,购自东营神州澳亚现代牧场有限公司新户分公司。试验开展前在勃林格殷格翰动物保健(中国)有限公司实验动物管理与使用委员会(IACUC)审核、批准(AUP#:AUP-18-01)和监督下完成。
1.2 试验地点 本次试验在山东省东营市河口区新户镇东兴村东营神州澳亚现代牧场有限公司新户分公司进行。本试验根据《农业转基因生物安全管理条例》和《农业转基因生物安全评价管理办法》等相关法规开展,中国人民共和国农业转基因生物安全审批书编号为农基安审字(2018)第062号和农基安审字(2018)第063号。
1.3 疫苗和疫苗稀释液 牛病毒性腹泻病毒1型KE-9基因缺失弱毒疫苗,批号:24100BPDI-1,病毒滴度≥104.0TCID50/mL,有效期至2020年10月19日,以下简称BVDV-1基因缺失疫苗;牛病毒性腹泻病毒2型NY-93基因缺失弱毒疫苗,批号:241-030117BPS-2C,病毒滴度≥104.0TCID50/头份,每头份2 mL,有效期至:2019年3月17日,以下简称BVDV-2基因缺失疫苗;疫苗由勃林格殷格翰动物保健有限公司生产。疫苗稀释液(磷酸盐缓冲液,WPBS),批号:8090103A、8090049A,由勃林格殷格翰动物保健有限公司生产。
1.4 试验设计 将16头试验用牛随机分成2组,每组8头。第1组6母牛肌肉注射2.0 mL牛病毒性腹泻病毒1型KE-9基因缺失弱毒疫苗;另外2头牛不做任何接种作为哨兵牛同群饲养。第2组6母牛肌肉注射2.0 mL牛病毒性腹泻病毒2型NY-93基因缺失弱毒疫苗;另外2头牛不做任何接种作为哨兵牛同群饲养。
疫苗免疫后连续观察56 d,每天观察动物是否有流产情况,如果出现流产则将流产胎牛进行剖检,采集胎牛的脑、胸腺、肠系膜淋巴结、脾脏及该流产母牛的血液用于病毒分离,若病毒分离结果为阳性则对该病毒进行基因测序以确认该病毒是否为疫苗毒。在免疫当天(免疫前)和免疫后第56 d时,采集所有怀孕母牛的血清样本用于抗体检测,以检测是否有BVDV血清转阳。在免疫后第56 d将6头免疫牛进行安乐死并采集其胎牛的脑、胸腺、肠系膜淋巴结和脾脏组织,通过病毒分离的方法进行BVDV检测,若病毒分离结果为阳性则对该病毒进行基因测序以确认该病毒是否为疫苗毒。
1.5 抗原检测 用荧光定量反转录聚合酶链式反应(以下简称:qRT-PCR)方法对免疫前试验用牛进行牛病毒性腹泻病毒抗原的检测。
RNA提取:使用病毒核酸提取试剂盒(QIAGEN,Cat:52904)提取血清中牛病毒性腹泻病毒RNA,方法如下:每个1.5 mL无RNase无菌EP管中加入560 μL裂解液AVL(包含5.6 μL Carrier RNA);加入140 μL待检血清;涡旋振荡混匀15 s;室温放置10 min;每管加入560 μL无水乙醇后涡旋15 s;将630 μL上述混合物转移至一个吸附柱,如果总体积超过630 μL,可分两次将溶液加入同一个吸附柱中;6010 ×g离心1 min,倒掉收集管中的废液;加入500 μL AW1漂洗液,6010 ×g离心1 min,弃废液;加入500 mL AW2漂洗液,12 000 ×g离心3 min,弃废液;将吸附柱放回空收集管中,13 523 ×g离心1 min,尽量除去漂洗液,以免漂洗液中残留乙醇抑制下游反应;取出吸附柱,放入一个新的1.5 mL离心管中,在吸附膜的中间部位加50 μL洗脱缓冲液,室温放置1 min,13 523×g离心1 min。洗脱的RNA用qRT-PCR检测。
qRT-PCR:使用商品化的牛病毒性腹泻病毒qRT-PCR检测试剂盒(QIAGEN,Cat:280375)进行检测,方法如下:根据样品数量计算PCR Mix(19.75 μL/个样品)和Enzyme Mix(0.25 μL/个样品)需要的总量,将PCR Mix和Enzyme Mix加入同一个无菌管中混匀;将上述混合液分装至96孔荧光定量反应板中,每个孔20 μL;加入5 μL待检样品RNA或阴性、阳性对照;使用封板膜封住反应板;将反应板放入荧光定量PCR仪;按照以下条件进行荧光定量PCR扩增:50℃ 20 min;95℃预变性15 min;95℃变性30 s,57℃退火45 s,68℃延伸45 s,40个循环。试验成立的标准:阳性对照的FAM和HEX检测通道的Ct值小于36,阴性对照的FAM检测通道无信号但在HEX检测通道的Ct值小于36。结果判定:若待检样品在FAM和HEX检测通道产生信号则判定为阳性;若待检样品在HEX检测通道产生信号但在FAM检测通道无信号则判定为阴性;若待检样品在FAM和HEX检测通道均无信号则检测为不确定结果。
1.6 抗体检测 使用牛病毒性腹泻病毒p80蛋白抗体检测试剂盒(IDEXX,Cat:P00645-5)检测血清中牛病毒性腹泻病毒抗体,方法如下:包被板每孔加入50 μL样品稀释液N.9。随后加入50 μL被检样品,并设立阴性和阳性对照,待检样品及阳性对照不作重复孔,阴性对照作重复孔。18℃~26℃孵育1 h后用300 μL洗涤液洗涤板子3~5次。每个孔加入100 μL酶标抗体,室温孵育30 min后用300 μL洗涤液洗涤板子3~5次;每个孔加入100 μL TMB底物,室温避光孵育20 min。再向每孔加入100 μL终止液终止反应。在450 nm波长测定各样品的吸光值。结果判定:计算S/N%值,S/N%=100×样品A450/阴性对照平均值。S/N%值大于或等于50%判定为阴性,小于或等于40%为阳性,大于40%但小于50%为可疑。
1.7 病毒分离 使用无菌剪刀剪取1~5 g的组织,剪碎后转移至组织碾磨管中,按照1∶1体积/重量比加入培养基,使用组织碾磨仪进行碾磨。将上述组织匀浆经3次反复冻融后2000 ×g离心20 min取上清液,接种细胞前使用细胞培养基将上清液作1∶10稀释并用0.22 μm滤器过滤。将犊牛鼻甲骨细胞(BT)培养于24孔细胞培养板,待细胞长至30%~40%后,将上述样品接种于BT细胞,每个样品作4个重复,每孔250 µL,37℃培养5 d。收获培养板后反复冻融两次,在BT细胞上再传代1次,每孔接种250 µL第1代冻融的样品,37℃培养5 d。收获培养板后反复冻融两次,将第2代冻融的样品接种于牛肾细胞(MDBK),于37℃培养4 d后进行间接免疫荧光染色。间接免疫荧光试验步骤如下:弃去上清培养液,使用50%甲醇/丙酮固定液进行细胞固定;每孔加入85 µL牛病毒性腹泻病毒特异性单克隆抗体,37℃孵育50 min;每孔加入200 µL洗涤液洗细胞3次;每孔加入75 µL的驴抗鼠IgG绿色荧光二抗(Life technologies,REF:A21202),37℃孵育50 min;每孔加入200 µL洗涤液洗细胞3次;在荧光显微镜下观察结果。
1.8 试验成立标准 试验成立须满足下列所有条件:免疫前所有动物健康状态良好;免疫前所有动物的血清牛病毒性腹泻病毒抗原和抗体检测结果为阴性;试验期内所有哨兵牛牛病毒性腹泻病毒抗原/抗体检测结果均为阴性;试验期内,哨兵牛不出现与牛病毒性腹泻病毒感染相关临床症状,如发热、流产等。
1.9 试验判定标准 用于试验结果判定的指标包括有无疫苗株免疫而引起的流产以及胎牛组织中有无疫苗毒的存在。
2 结果
免疫前所有试验牛健康状态均良好,牛病毒性腹泻病毒抗原和抗体检测结果为阴性。哨兵牛在整个试验期内牛病毒性腹泻病毒抗原和抗体检测结果均保持阴性,且健康状态良好,试验成立。
2.1 免疫后流产观察 所有免疫牛在整个试验期间食欲旺盛、躯体匀称、体态丰满、被毛光亮,未观察到任何临床症状和流产情况。结果表明,免疫BVDV-1基因缺失疫苗和BVDV-2基因缺失疫苗对怀孕母牛是安全的。
2.2 抗体反应 所有怀孕母牛在免疫当日为BVDV抗体阴性,免疫后血清抗体转阳,抗体明显升高,而同居饲养的哨兵牛BVDV血清抗体一直保持阴性,具体检测结果见图1。该结果表明,免疫BVDV-1基因缺失疫苗和BVDV-2基因缺失疫苗可以导致BVDV抗体转阳,但疫苗毒不会通过免疫牛水平传播给未免疫牛。
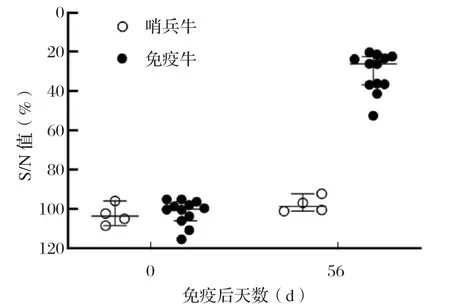
图1 免疫后BVDV 抗体反应Fig.1 BVDV seroconversion after vaccination
2.3 疫苗毒在胎牛体内的分布情况 试验结束时胎牛发育良好,对所有采集的胎牛组织进行病毒分离均未检测出BVDV,检测结果见表1。该结果表明,试验用牛在免疫该弱毒疫苗后,疫苗毒不能穿过胎盘感染胎牛,无垂直传播。
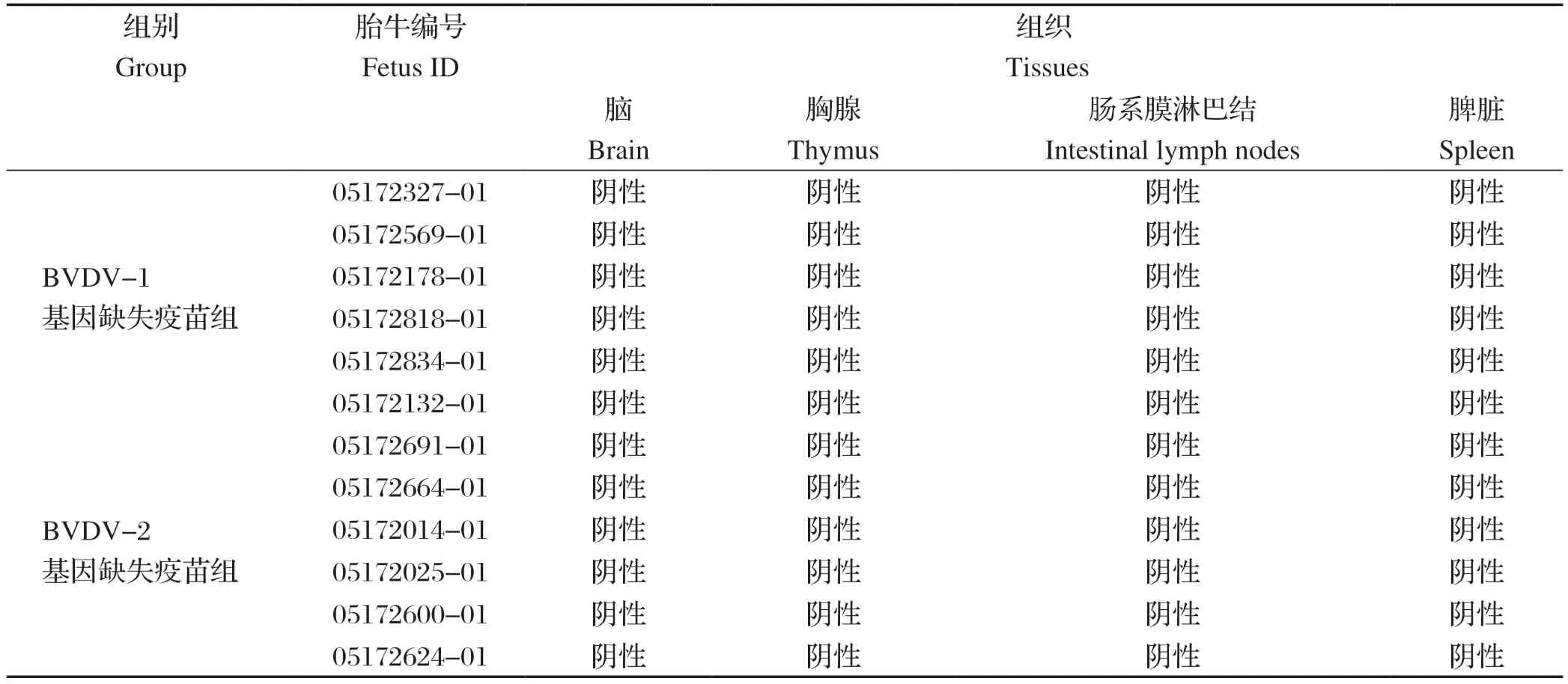
表1 胎牛组织样本病毒分离结果Table 1 Virus isolation results of fetuses' tissue
3 讨论
疫苗免疫接种可以激发动物机体产生特异性免疫力,可以使易感动物转化为非易感动物,是预防和控制动物传染病的重要措施。在过去的一段时间里,减毒活疫苗和灭活疫苗(传统疫苗)在动物传染病防控过程中起到了至关重要的作用,目前广泛应用于实际生产中,其中具有代表性的疫苗如口蹄疫灭活疫苗和猪瘟C株弱毒疫苗等[17-21]。但是随着养殖模式和生物安全方式的转变,传统疫苗也存在诸多不足,如灭活苗不能有效刺激机体产生细胞免疫,需要加强免疫;高致病性病原灭活疫苗生产需要高等级生物安全实验室;致弱不完全的弱毒疫苗会毒力返强等。因此,近些年来,兽医行业都在大力研发新型疫苗,包括基因工程亚单位疫苗、基因重组活载体疫苗、基因缺失疫苗、合成肽疫苗和核酸疫苗等[22]。相比传统疫苗,新型疫苗可通过除去病原体的无效和致病成分,只保留能引起免疫保护作用的成分提供更安全的防护;可制成多价联合疫苗,做到一针多防;可以区分免疫动物和野毒感染动物,服务于疫病净化等[23]。
目前,瘟病毒主要新型疫苗有猪瘟病毒E2亚单位疫苗[24]、以BVDV毒株CP7为骨架病毒,将其E2基因替换为猪瘟病毒E2基因的重组嵌合瘟病毒活疫苗[25]和利用人5型复制缺陷性腺病毒载体系统构建了表达猪瘟病毒E2基因的重组腺病毒rAdV-E2疫苗[26]等。上述疫苗广泛应用于临床,在疾病预防控制工作中起到了非常重要的作用。本研究牛病毒性腹泻病毒1型KE-9基因缺失弱毒疫苗和牛病毒性腹泻病毒2型NY-93基因缺失弱毒疫苗的设计理论是基于BVDV主要保护性抗原E2蛋白、和两个抑制宿主先天免疫功能的病毒蛋白Npro和Erns的功能与特性研制的,通过定点突变的方法缺失了BVDV整个Npro蛋白的编码区(N端4个密码子除外)和位于Erns的RNA酶活性中心编码区中第349位组氨酸,进而获得了安全性和免疫原性良好的BVDV疫苗。该疫苗在研发期间,已有超过3000头牛进行了疫苗接种,包括犊牛和怀孕母牛,安全性良好,无水平传播、无垂直传播,也无毒力返强。欧洲田间试验中,有近300万头牛接种了该疫苗,包括犊牛和怀孕母牛。2014年在欧盟国家注册后,至今已在30个国家广泛使用,且已有大约570万头牛接种了该疫苗,其安全性已经得到充分证实(内部实验数据,未发表)。本研究结果再次证实,怀孕母牛免疫牛病毒性腹泻病毒1型KE-9基因缺失弱毒疫苗和牛病毒性腹泻病毒2型NY-93基因缺失弱毒疫苗后,母牛无临床症状及流产情况,且胎牛组织中不存在BVDV,即疫苗无垂直传播,对母牛和胎牛均具有良好的安全性。

