急性脑梗死静脉溶栓患者的CRP、NLR和LER动态变化及其对预后的预测价值
薛冰,郭中霞
(商丘市第一人民医院 急诊重症监护室,河南 商丘 476000)
急性脑梗死(acute cerebral infarct,ACI)主要是因脑部重要供血动脉出现严重狭窄甚至闭塞所导致的脑部供血不足引起的一种脑血管疾病[1]。研究显示,ACI在全部脑卒中约占70%[2]。现阶段国内外诊疗指南[3-4]均推荐应用静脉溶栓治疗ACI,且在临床中获得较好的临床疗效。但临床工作中发现,部分ACI患者在静脉溶栓后1 d出现症状波动,故如何预防溶栓后的症状波动,对改善患者预后具有重要临床意义。有相关研究发现,ACI发病后机体出现的炎症反应程度与患者病程及疾病的进展有关[5]。C反应蛋白(C-reactive protein,CRP)作为一种炎症指标,在ACI中扮演重要角色,其水平的变化与患者神经功能缺损程度有关[6]。中性粒细胞和淋巴细胞比值(neutrophils-lymphocytes ratio,NLR)及白细胞和红细胞计数比值(leukocyte-erythrocyte ratio,LER)是近年提出的2个新的炎症指标,相对于其他单一指标其更稳定、更灵敏。有研究表明,NLR与炎症反应密切相关,且可作为动脉粥样硬化性脑梗死斑块稳定性的预测指标[7]。目前临床中关于NLR及LER对ACI预后预测的相关研究鲜有报道,其在ACI预后中所起的作用仍需进一步证实。鉴于此,本研究主要探讨分析CRP、NLR及LER在ACI患者中的动态变化,及其对患者预后的预测价值,以期为日后指导临床改善患者预后提供一定的科学依据。
1 资料与方法
1.1 一般资料
选择商丘市第一人民医院2020年2月至2023年2月急诊就诊的126例ACI且在院进行静脉溶栓治疗的患者。所有患者年龄35~78岁,平均(50.68±8.72)岁,男72例,女54例。纳入标准:(1)符合《中国急性缺血性脑卒中诊治指南》[8]中相关诊断标准,且发病到治疗时间在4.5 h内;(2)符合静脉溶栓条件;(3)为轻型非致残性卒中,美国国立卫生院神经功能缺损评分(the National Institutes of Health Stroke Scale,NIHSS)≤4分;(4)签署静脉溶栓知情同意书。排除标准:(1)入院前感染症状明显,如出现发热、咳嗽咳痰等症状;(2)静脉溶栓后行介入取栓术;(3)近期曾有免疫抑制剂应用史。本研究已通过医院医学伦理委员会批准。
1.2 分组方法
根据发病后90 d改良Rankin量表评分(modified Rankin scale,mRS)[9]将所有患者分为预后良好组(94例)及预后不良组(32例)。mRS评分>3分即为预后不良,反之则为预后良好。
1.3 观察指标
(1)比较两组溶栓前、溶栓后1 d、溶栓后7 d的CRP、NLR、LER的变化情况及发病90 d的mRS评分。入院后分别于上述不同时间段采集患者血液,进行CRP及血常规水平(包括白细胞计数、红细胞计数、中性粒细胞计数、淋巴细胞计数等)检测。应用国赛Aristo特定蛋白分析仪(由济南爱来宝仪器设备有限公司提供)测定CRP水平。应用帝迈DP-H10全自动血细胞分析仪(由深圳市帝迈生物技术有限公司提供)测定血常规水平。
(2)收集可能影响ACI静脉溶栓患者预后的相关因素,主要包括:年龄、性别、高血压病史、冠心病病史、2型糖尿病病史、心房颤动病史、入院舒张压及收缩压、血糖、体重指数、吸烟史、饮酒史、发病至用药时间、入院至用药时间等。
1.4 统计学分析
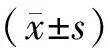
2 结果
2.1 比较溶栓前后不同时间CRP、NLR、LER水平及发病90 d mRS评分
重复测量方差分析显示,两组CRP、NLR、LER在时间效应、时间效应及交互效应均有统计学意义(P<0.05)。简单效应分析:溶栓前两组CRP、NLR、LER水平比较,差异无统计学意义(P>0.05)。预后良好组患者溶栓后1 d及7 d的CRP、NLR、LER水平低于预后不良组(P<0.05)。预后良好组mRS评分主要为1分(7例)、2分(54例)、3分(33例),预后不良组为4分(26例)、5分(6例),预后良好组mRS评分分布优于预后不良组(P<0.05)。见表1。
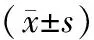
表1 溶栓前后前后不同时间CRP、NLR、LER水平比较
2.2 两组一般资料比较
两组性别、高血压病史、冠心病病史、2型糖尿病病史、心房颤动病史、入院舒张压及收缩压、血糖、体重指数、吸烟史、饮酒史、发病至用药时间、入院至用药时间比较,差异无统计学意义(P>0.05)。预后良好组年龄较预后不良组更低(P<0.05)。见表2。
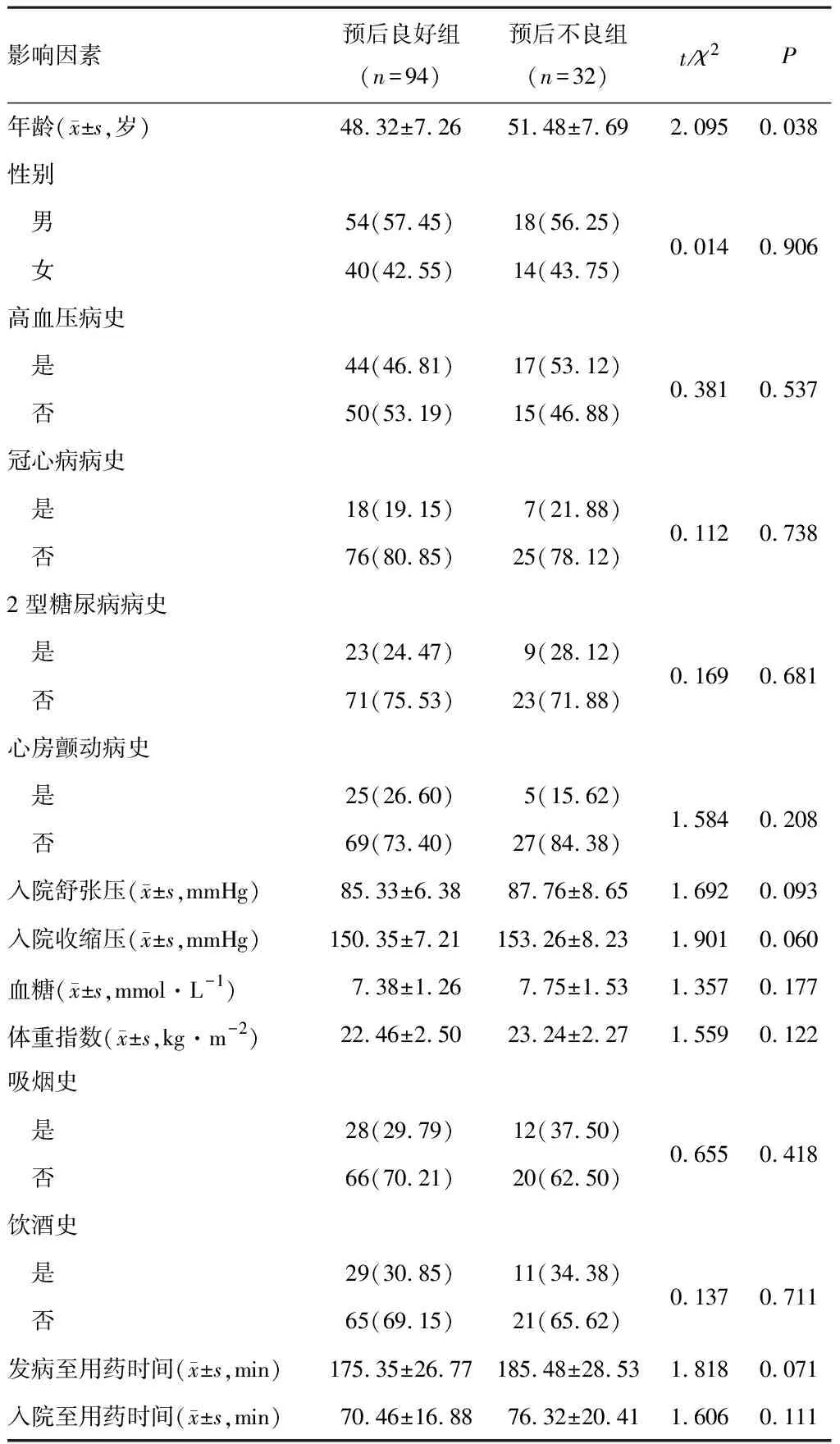
表2 两组一般资料比较
2.3 影响ACI静脉溶栓患者预后相关因素的Cox回归分析
将表1及表2中差异有统计学意义的变量代入Cox多因素回归模型分析,结果显示,溶栓后1 d及7 d的CRP、NLR、LER水平均是ACI静脉溶栓患者预后不良的危险因素(P<0.05)。见表3。
2.4 CRP、NLR、LER水平与ACI静脉溶栓患者mRS评分的相关性分析
Spearman相关性分析示,溶栓后1 d及7 d的CRP、NLR、LER水平与ACI静脉溶栓患者发病90 d的mRS评分呈正相关(r=0.405、0.481、0.518、0.680、0.530、0.504,P<0.05)。
2.5 CRP、NLR、LER对ACI静脉溶栓患者预后预测的ROC曲线分析
ROC曲线结果显示,溶栓后7 d的CRP、NLR、LER及三者联合的曲线下面积(area under the curve,AUC)均大于溶栓后1 d的各项对应指标及联合指标的AUC,溶栓后7 d各项指标联合预测ACI静脉溶栓患者预后的AUC最大,为0.856。见表4。

表4 ROC曲线分析CRP、NLR、LER对ACI静脉溶栓 患者预后的预测价值
3 讨论
ACI发病多发于高脂血症、糖尿病及高血压人群,主要以口角歪斜、言语障碍及肢体无力等为临床表现[10-11]。目前ACI发病机制临床尚未完全明确,但其发病率呈逐渐升高趋势,已成为严重威胁患者生命安全的疾病[12]。既往研究显示,ACI患者发病至溶栓时间可对患者临床疗效及预后产生极大影响[13]。故第一时间开通ACI患者梗死的血管,促进缺血脑组织血液灌流的尽快恢复是治疗ACI的关键环节[14]。现有大量国内外相关研究证实应用静脉溶栓是一种有效治疗ACI的临床方案。但ACI已坏死的神经无法恢复,经治疗后仍遗留有不同程度的神经功能障碍,且溶栓过程中会造成不同程度缺血再灌注损伤,亦可对预后造成影响,因此及时使用准确度且灵敏度高的指标对预后进行评估以采取有效的治疗方案具有重要临床意义。
本次研究以ACI患者行静脉溶栓后预后的不同为切入点,经过对比分析发现,预后不良组溶栓后1 d及7 d的CRP水平均高于预后良好组,表明在ACI患者溶栓治疗过程中其CRP的变化水平可能与预后有关。CRP可介导脑梗死血脑屏障及血管内皮损伤,导致机体微环境发生改变,从而参与疾病的发生及发展。高CRP水平可影响凝血因子的表达,进而对机体凝血机制产生影响。研究表明,凝血因子激活导致ACI患者病情加重,导致ACI病死率增加[15]。此外,CRP的快速升高还可导致梗死范围扩大,加重脑组织及神经的损伤。本研究还发现预后不良组溶栓后1 d及7 d的NLR及LER水平亦高于预后良好组。有研究报道,中性粒细胞降低可对血肿周围神经细胞的凋亡起到抑制作用,但若其浸润到出血部位则可能造成细胞损伤,导致脑损伤程度加重[16]。淋巴细胞是一种免疫识别指标。NLR作为两项指标的比值,其水平上升表示淋巴细胞相对下降而中性粒细胞则相对增加,可能引发凝血,引起内皮功能障碍,促进斑块形成,且淋巴细胞减少可促进斑块不稳定的进展,故其水平的升高往往预示着患者血管病变严重程度加重,神经功能损伤程度增加[17]。
本研究中进行Cox多因素回归分析及相关性分析发现,溶栓后1 d及7 d的CRP、NLR、LER水平均是ACI静脉溶栓患者预后不良的危险因素,亦与ACI静脉溶栓患者发病90 d的mRS评分呈正相关,说明CRP、NLR、LER水平变化与ACI患者预后有一定的关系。在ACI的发病及发展中炎症反应扮演着重要角色,中性粒细胞及淋巴细胞作为白细胞的主要成分参与至炎症反应中。在ACI发生后的5 d内中性粒细胞可通过细胞外诱捕网损害ACI后的血运重建。中性粒细胞及其细胞外诱捕网是脑血栓栓塞的组成部分。而淋巴细胞则可在ACI后的修复过程中起到重要作用,可保护神经,改善出血转化。故作为中性粒细胞及淋巴细胞的结合体,NLR可反映出ACI患者的病情进展及预后情况。基于上述研究结果,进一步绘制ROC曲线,结果显示,溶栓后1 d及7 d的CRP、NLR、LER在ACI患者预后中均具有一定的预测价值,其中溶栓后7 d 3项指标联合预测效能最佳,其AUC可达到0.856,说明其可为临床ACI静脉溶栓患者预后的早期预测提供一定科学依据,可指导临床医生针对预测效果制定早期干预及治疗措施以改善患者预后。
4 结论
ACI患者经静脉溶栓治疗后CRP、NLR、LER随患者病情改善而下降,且各项指标的变化水平与患者预后有关,可作为ACI静脉溶栓患者临床预后的预测指标。

