血清IL-8、ESM-1、VAP-1在慢性阻塞性肺疾病临床诊断及病情评估中的应用
刘传,于卫民,王嵘,李丽娟
(1.郑州大学第一附属医院 呼吸与危重症医学科,河南 郑州 451162;2.开封市中医院 内分泌科,河南 开封 475000)
我国慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)依据病情情况可分为急性加重期慢性阻塞性肺疾病(acute exacerbation of chronic obstructive pulmonary disease,AECOPD)和稳定期慢性阻塞性肺疾病(stable chronic obstructive pulmonary disease,SCOPD),目前对于COPD早期识别、评估病情,仍缺乏明确生物标志物[1]。白细胞介素-8(interleukin-8,IL-8)属于多细胞源性的炎症因子,可诱导气道炎症反应、气道重塑,参与COPD发生发展过程[2]。内皮特异性分子-1(endothelial cell speci molecule-1,ESM-1)属于蛋白多糖,可引起肺部内皮功能障碍[3]。血管黏附蛋白-1(vascalur adhesion protein-1,VAP-1)可促进应激产物表达,促使有害代谢物质堆积,加重炎症反应,进而参与肺部疾病等炎症病理进展过程[4]。目前关于选择哪些指标联合诊断COPD尚未统一,本研究通过检测血清IL-8、ESM-1、VAP-1水平,对比分析其在COPD诊断、病情严重程度评估中的价值,为临床医生判断病情及治疗提供参考。
1 资料与方法
1.1 一般资料
选取2021年11月至2022年8月郑州大学第一附属医院收治的153例COPD患者为研究对象,其中COPD稳定期42例(设为SCOPD组)、COPD急性加重期111例(设为AECOPD组),依据病情严重程度[5]分为轻度53例、中度48例、重度52例,同时选取同期体检的51例健康志愿者为对照组。
SCOPD组:男24例、女18例,年龄54~71(62.52±2.62)岁,体重指数18~26(21.86±1.15)kg·m-2,收缩压106~125(115.63±3.03)mmHg(1 mmHg=0.133 kPa),舒张压64~75(68.85±1.45)mmHg,每年吸烟40~66(53.16±4.16)包,病程2~14(8.03±1.86)a,合并症糖尿病14例、冠心病20例、慢性肾脏病10例。AECOPD组:男78例、女33例,年龄53~72(61.75±2.85)岁,体重指数18~27(22.16±1.38)kg·m-2,收缩压94~136(114.85±6.88)mmHg,舒张压63~76(69.06±1.85)mmHg,每年吸烟36~68(51.85±5.08)包,病程1~15(7.96±2.03)a,合并症糖尿病40例、冠心病52例、慢性肾脏病26例。对照组:男29例、女22例,年龄52~72(62.01±3.11)岁,体重指数12~32(21.75±3.18)kg·m-2,收缩压102~128(114.88±4.16)mmHg,舒张压61~78(69.71±2.63)mmHg,每年吸烟37~68(52.26±5.03)包。各组一般资料均衡可比(P>0.05)。本研究经郑州大学第一附属医院医学伦理委员会批准,所有患者及其家属知情且签署知情同意书。
1.2 纳入与排除标准
纳入标准:符合COPD诊断标准[6],且经胸部CT、X线检查确诊;符合AECOPD诊断标准[7],且临床症状加重、痰量增多,并伴有发热;符合SCOPD诊断标准[8],且呼吸道症状轻微或稳定,病情平稳时间>2个月;入组前未使用抗凝药物。排除标准:伴有脓毒症;合并恶性肿瘤;合并支气管扩张、肺动脉高压等肺部疾病;合并免疫系统功能障碍;既往肺部手术史;精神障碍。
1.3 方法
1.3.1收集临床资料
统计各组临床资料,包括白细胞计数(white blood cell count,WBC)、中性粒细胞与淋巴细胞比值(neutrophil-to-lymphocyte ratio,NLR)、红细胞分布宽度(red blood cell distribution width,RDW)、纤维蛋白原(fibrinogen,Fib)、COPD评估测试表(COPD assessment test,CAT)、解整合素样-金属蛋白酶8(A disintegrin and metalloprotease domain 8,ADAM8)、第1秒用力呼气容积(forced expiratory volume in one second,FEV1)、FEV1占用力肺活量(forced vital capacity,FVC)的百分比(FEV1/FVC)。经血常规、凝血全项检查WBC、NLR、RDW、Fib,采用HI-101型肺功能测定仪(日本CHEST株式会社)检测FEV1、FEV1/FVC。采用ELISA法检测血清ADAM8水平,美国Abcam公司提供检测试剂盒。CAT评分包括运动耐力、日常运动影响、咳嗽、咳痰、胸闷、睡眠、精力、情绪,总分为40分,分值越高表明症状越严重[9]。
1.3.2检测血清IL-8、ESM-1、VAP-1水平
采集COPD患者入组时空腹静脉血5 mL,对照组于体检当日采集空腹静脉血5 mL,3 800 r·min-1离心5 min留取上清液,-80 ℃低温保存待测。采用ELISA法检测血清IL-8、ESM-1、VAP-1水平,上海酶联生物公司提供IL-8检测试剂盒,美国Elabscience公司提供ESM-1检测试剂盒,上海润裕生物科技公司提供VAP-1检测试剂盒,检测仪器为FAME24/20酶标仪(瑞士Hamilton公司)。
1.3.3统计学分析
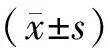
2 结果
2.1 临床资料
SCOPD组、AECOPD组WBC、NLR、RDW、Fib、CAT、ADAM8高于对照组,且AECOPD组高于SCOPD组(P<0.05);SCOPD组、AECOPD组FEV1/FVC、FEV1低于对照组,且AECOPD组低于SCOPD组(P<0.05)。见表1。
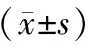
表1 各组临床资料比较
2.2 血清IL-8、ESM-1、VAP-1水平
AECOPD组、SCOPD组血清IL-8、ESM-1、VAP-1水平高于对照组,且AECOPD组高于SCOPD组(P<0.05),见表2。
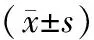
表2 各组血清IL-8、ESM-1、VAP-1水平比较
2.3 不同病情程度患者血清各指标
随着病情程度升高,血清IL-8、ESM-1、VAP-1水平逐渐升高(P<0.05),见表3。
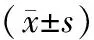
表3 不同病情程度患者血清 各指标比较
2.4 血清各指标与肺功能、生化指标、病情程度相关性
IL-8、ESM-1、VAP-1与WBC、NLR、RDW、Fib、CAT、ADAM8、病情程度呈正相关,而与FEV1/FVC、FEV1呈负相关(P<0.05),见表4。
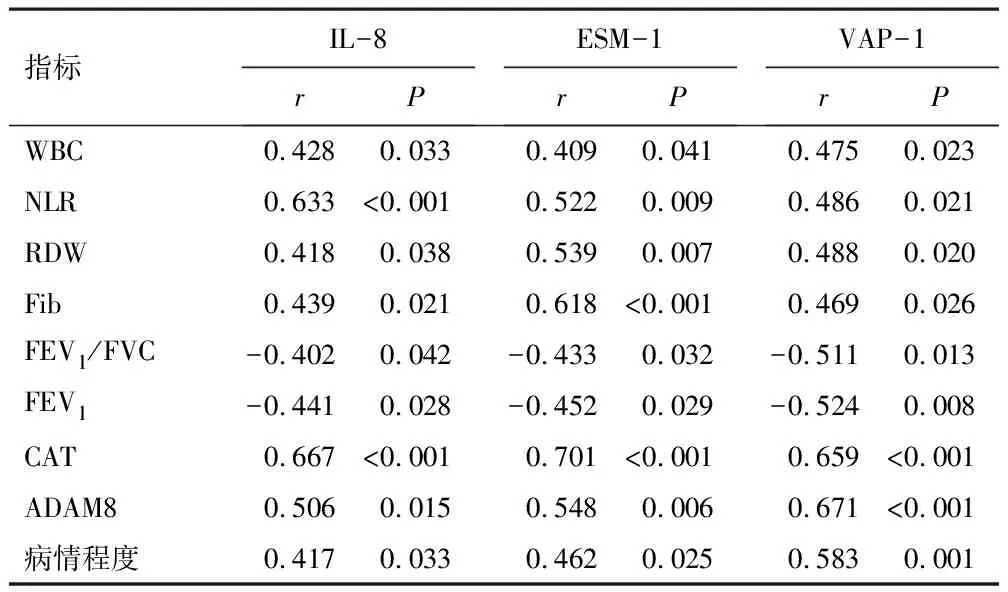
表4 血清各指标与肺功能、生化指标、病情程度相关性
2.5 血清各指标对COPD的诊断价值
以SCOPD组42例为阳性样本,以对照组51例为阴性样本绘制ROC曲线,结果显示血清IL-8、ESM-1、VAP-1联合诊断SCOPD的曲线下面积(area under the curve,AUC)大于单独指标诊断(P<0.05);以AECOPD组111例为阳性样本,以SCOPD组42例为阴性样本绘制ROC曲线,结果显示血清IL-8、ESM-1、VAP-1联合鉴别诊断SCOPD与AECOPD的AUC大于单独指标鉴别诊断(P<0.05),见表5。
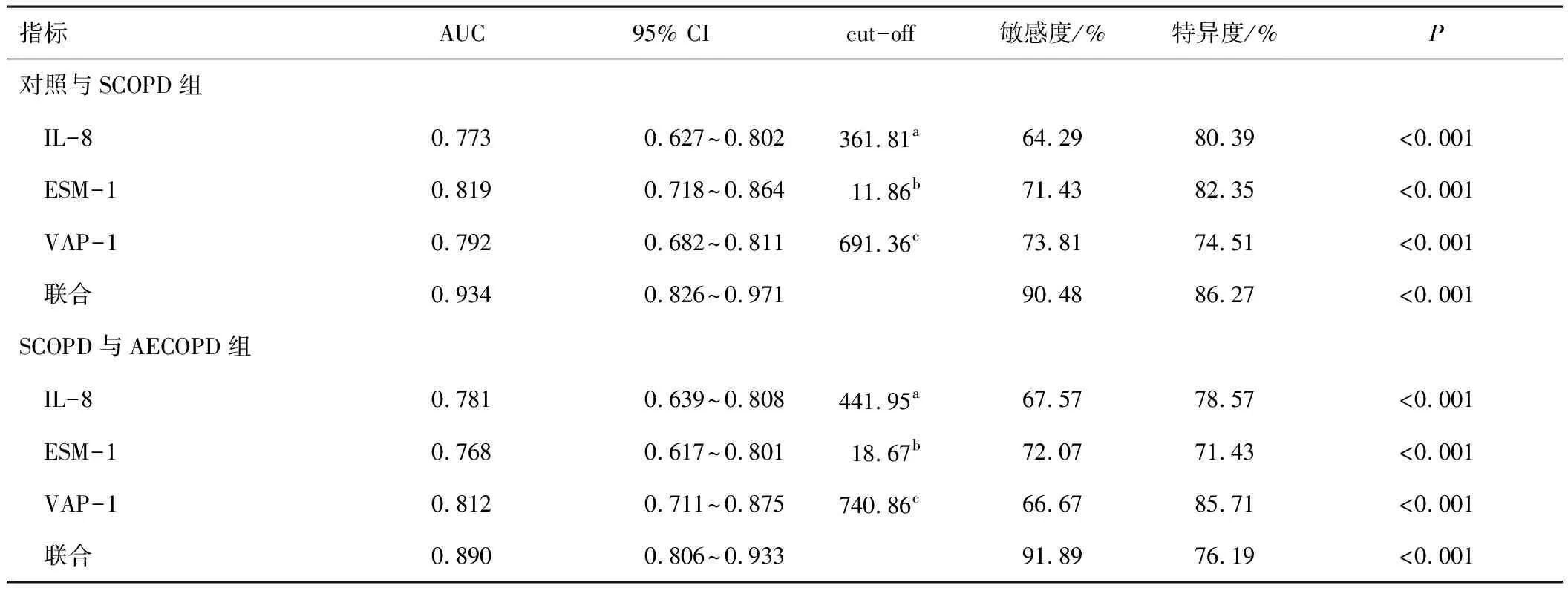
表5 血清各指标对COPD的诊断价值
3 讨论
COPD发病机制可能与多种炎症细胞活化、炎症因子释放、呼吸道发生慢性非特异性炎症反应有关[10]。WBC、NLR、RDW、Fib、ADAM8可诱导气道炎症浸润,促进COPD发生发展;CAT评分随着COPD病情加重而逐渐升高,而肺功能指标FEV1/FVC、FEV1则降低[11]。本研究结果显示SCOPD组、AECOPD组WBC、NLR、RDW、Fib、CAT、ADAM8高于对照组,FEV1/FVC、FEV1低于对照组,与上述研究报道相符,提示COPD发生发展与炎症介质释放量增加有关。
IL-8可激活中性粒细胞,抑制细胞外基质分解,促进纤维细胞增殖,改变肺泡组织结构及功能,还可激活凝血机制,促进血栓形成,不利于气体交换,造成肺组织持续性炎症损伤[12]。本研究结果显示,AECOPD组、SCOPD组血清IL-8水平高于对照组,且AECOPD组高于SCOPD组,提示IL-8可反映COPD病情严重程度。随着COPD病情加重,炎症递质释放量增加,促使气道、肺实质炎症加重,诱发全身炎症反应,导致血液循环中IL-8水平增加。同时本研究发现IL-8与WBC、NLR、RDW、Fib、CAT、ADAM8、病情程度呈正相关,而与FEV1/FVC、FEV1呈负相关。分析其原因可能为IL-8可刺激淋巴细胞、中性粒细胞分泌,激活嗜酸粒细胞释放过度神经毒性,促使肥大细胞聚集于肺组织,诱导气道高反应性,引起气道、小气道痉挛,进而参与COPD发生发展过程。ESM-1水平升高可促使肺内内皮细胞损伤,诱发内皮功能障碍,并可参与炎症性病理过程[13-14]。内皮功能障碍与COPD发生发展密切相关,本研究发现ESM-1水平在AECOPD组中较SCOPD组、对照组升高,且随病情严重程度增加而呈升高趋势,提示ESM-1可能用于评估COPD病情严重程度。同时本研究发现ESM-1与WBC、NLR、RDW、Fib、CAT、ADAM8呈正相关,而与FEV1/FVC、FEV1呈负相关,其原因可能为炎症递质过度释放可诱导ESM-1表达,ESM-1可通过级联炎症反应,引起肺组织损伤,影响COPD患者肺功能。
VAP-1可与淋巴细胞、单核细胞结合,参与机体炎症反应,并可募集淋巴细胞侵入肺组织,诱导淋巴细胞分泌炎症因子,加剧肺组织炎症损伤,诱发肺功能障碍[15-16]。本研究结果显示,随着病情程度升高,血清VAP-1水平逐渐升高,且与肺功能、生化指标、病情程度密切相关,提示血清VAP-1水平越高,则COPD患者气流受限越严重,肺功能越差,进而促进病情进展。分析其原因可能为VAP-1可促进炎症反应因子转录,提高多元醇通路活性,诱导毒性产物损伤内皮细胞,募集单核细胞、中性粒细胞迁移至肺组织,并可激活NOD样受体热蛋白结构域相关蛋白3信号通路,诱导下游炎症因子释放,进而介导肺部炎症反应[17]。结合本研究结果可知IL-8、ESM-1、VAP-1均参与COPD发生发展过程,其血清水平越高,则患者病情越严重。但尚未见报道分析IL-8、ESM-1、VAP-1对AECOPD、SCOPD的鉴别诊断价值,本研究结果显示血清IL-8、ESM-1、VAP-1联合鉴别诊断SCOPD与AECOPD的AUC大于单独指标鉴别诊断,表明IL-8、ESM-1、VAP-1联合检测对COPD具有临床诊断价值。
4 结论
COPD患者血清IL-8、ESM-1、VAP-1水平升高,联合检测其水平对SCOPD、AECOPD具有诊断效能,对评估COPD病情程度具有一定临床价值,可为临床医生对COPD患者病情判断提供依据。

