白细胞介素32对人脐带来源间充质干细胞向脂肪细胞分化的调控作用
张夏茹,赵薪丰,郑远静,刘元林,李雪,王洋,王丽峰,张毅
(1.南华大学衡阳医学院军事医学研究院研究生协作培养单位,湖南 衡阳 421001;2.军事科学院军事医学研究院辐射医学研究所,北京 100850;河北大学 3.化学与材料科学院,4.生命科学学院,河北 保定 071000)
间充质干细胞(mesenchymal stem cells,MSC)是一类具有多向分化潜能的成体干细胞,在再生医学中具有广阔的应用前景。MSC具有向脂肪细胞、骨细胞和软骨细胞等多种细胞分化的功能[1]。研究表明,转录因子在调控MSC 向不同细胞分化过程中起重要作用,激活转录因子可调节特定细胞分化基因的表达[2]。过氧化物酶体增殖物激活受体γ(peroxisome proliferator activated receptor γ,PPARγ)作为MSC 向脂肪细胞分化的主要调节因子,其在脂肪形成过程中发挥重要作用。PPARγ以PPARγ1和PPARγ2 2 种形式的异构体存在,后者主要在脂肪组织中表达[3]。当PPARγ 被敲除后,脂肪将无法形成,且所有的前体成脂细胞信号通路均与PPARγ相关[4]。目前MSC向成脂细胞分化的作用机制尚不清楚,MSC多向分化调控作用的研究成为目前研究的热点。
本课题组前期通过单细胞测序发现,肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和干扰素γ(interferon-γ,IFN-γ)激活的人脐带来源MSC(stimulated- human umbilical cord-derived MSCs,S-HuMSC)基因表达与正常HuMSC 存在显著差异,其中白细胞介素32(interleukin-32,IL-32)在S-HuMSC 中的表达显著升高[5]。生物信息学分析发现,IL-32可参与调节MSC 的多向分化。IL-32又称自然杀伤细胞转录物4,是一种分泌性蛋白,由T 淋巴细胞、自然杀伤细胞、上皮细胞、单核细胞和成纤维样滑膜细胞分泌[6]。IL-32 作为一种炎症细胞因子,可通过激活NF-κB 和p38 丝裂原活化蛋白激酶诱导多种细胞因子的产生,如TNF-α,IL-1β,IL-6 和IL-8 等[7]。有研究报道,与高脂饮食的野生型小鼠相比,高脂饮食的IL-32β转基因小鼠肝脂质蓄积减少,肝组织PPARγ 表达下调[8]。由此提示,IL-32 对脂肪细胞分化过程可能具有一定的调控作用。本研究利用过表达IL-32的慢病毒转染HuMSC,检测IL-32对HuMSC成脂分化能力的影响。
1 材料与方法
1.1 细胞、主要试剂和仪器
HuMSC 为军事医学研究院辐射医学研究所冻存细胞。胎牛血清、α-MEM 培养基和0.25%胰酶,美国Thermo Fisher 公司;APC-抗人CD14、APC-抗人CD34、APC-抗人CD45、PE-抗人CD73、PE-抗人CD90 和PE-抗人CD105,美国eBioscience公司;含过表达IL-32基因序列或阴性对照(negative control,NC)序列且带有绿色荧光蛋白(green fluorescent protein,GFP)及嘌呤霉素抗药基因的慢病毒载体(简称为稳定表达IL-32 慢病毒载体和NC 空载体)由吉凯基因生物工程有限公司构建;成脂分化相关转录因子PPARγ、CCAAT 增强子结合蛋白α(CCAAT enhancer binding protein α,C/EBPα)和脂肪酶(adiponectin,ADI),成骨分化相关转录因子Runt 相关转录因子2(RUNX family transcription factor 2,RUNX2)、碱性磷酸酶(alkaline phosphatase,ALP)和无远侧同源盒5(distalless homeobox 5,DLX5),IL-32及GAPDH引物(表1),上海生工生物工程股份有限公司合成;TNF-α、IFN-γ、嘌呤霉素盐酸盐、吲哚美辛、地塞米松、油红O 粉、胰岛素、维生素C 磷酸盐、β-磷酸甘油、3-异丁基-1-甲基黄嘌呤(3-isobutyl-1-methylxanthine,IBMX)和Trizol 试剂,美国Sigma 公司;ALP 染液,上海碧云天生物技术有限公司;M-MLV、RNA 酶抑制剂、5×M-MLV 缓冲液、Oligo dT 和随机引物,日本Takara 公司;dNTP 和DTT,康为世纪有限公司;细胞恒温培养箱(CLM-170B-8-NF),新加坡艺思高科技有限公司;核酸定量仪(ND life-5463)、实时荧光定量PCR仪(A40425)、PCR扩增仪(4382286)和低温高速离心机(Heraeus Fresco 21),美国Thermo Fisher 公司;倒置显微镜(CKX53SF-R)和荧光显微镜(CKX53),日本Olympus 公司;流式细胞仪(Accuri C6 Plus),美国Becton Dickinson公司。

Tab.1 Primer sequences for real-time quantitative PCR(RT-qPCR)
1.2 HuMSC培养和激活
复苏HuMSC 并接种于T75 细胞培养瓶,α-MEM 完全培养基(含10%胎牛血清)培养。待细胞融合度达约80%弃原培养基,PBS 润洗2 次;用0.125%胰蛋白酶消化成单细胞悬液,150×g离心5 min,HuMSC 沉淀用α-MEM 完全培养基(含10%胎牛血清)重悬。取部分HuMSC接种于新的T75培养瓶中,用TNF-α(20 μg·L-1)和IFN-γ(20 μg·L-1)孵育24 h,得到S-HuMSC。倒置显微镜下观察HuMSC和S-HuMSC形态并拍照。
1.3 HuMSC和S-HuMSC表型鉴定
HuMSC和S-HuMSC分别用1.4 mL PBS重悬,细胞密度为1×109L 分别分装于7 个EP 管(6 个流式抗体管,1个细胞对照管)中,每管200 μL。除细胞对照管外,其余6 管分别加入相应抗体(APC-抗人CD14、APC-抗人CD34、APC-抗人CD45、PE-抗人CD73、PE-抗人CD90和PE-抗人CD105),每管1 μL,混匀;避光孵育30 min,每管加入PBS 800 μL 混匀,离心(150×g,5 min);每管加入PBS 200 μL 重悬,于流式细胞仪检测HuMSC和S-HuMSC表型。
1.4 HuMSC和S-HuMSC成骨和成脂诱导分化
将HuMSC和S-HuMSC分别接种于六孔板中,每孔5×104细胞,进行成骨和成脂诱导分化,同时设自分化对照组(含10%胎牛血清的α-MEM完全培养基培养)。成骨分化诱导液含10%胎牛血清、地塞米松0.1 μmol·L-1、维生素C磷酸盐50 μmol·L-1和β-磷酸甘油10 mmol·L-1;成脂分化诱导液含10%胎牛血清、地塞米松1 μmol·L-1、胰岛素10 μg·L-1、IBMX 0.5 mmol·L-1和吲哚美辛0.5 mmol·L-1;每隔2 d换液1次。成骨分化诱导14 d,ALP 染色后用ImageJ软件分析检测ALP 染色面积,并收集各组细胞提取总RNA,实时荧光定量PCR(real-time quantitative PCR,RT-qPCR)检测成骨相关转录因子RUNX2,ALP和DLX5mRNA表达,测定HuMSC 和S-HuMSC成骨诱导分化能力。成脂分化诱导10 d,进行油红O染色后用ImageJ软件分析检测脂滴形成面积,并收集各组细胞提取总RNA,RT-qPCR 检测成脂相关转录因子PPARγ,C/EBPα和ADI mRNA表达,测定HuMSC 和S-HuMSC 成脂诱导分化能力。
1.5 利用慢病毒载体构建稳定过表达lL-32 的HuMSC(lL-32highHuMSC)
将生长状态良好的P3代HuMSC按每孔1×105接种于六孔板内,分为HuMSC,NC-HuMSC 和IL-32highHuMSC 组。NC-HuMSC 和IL-32highHuMSC组分别感染NC 空载体和稳定表达IL-32 慢病毒载体,感染病毒载量均为1×1010L-1,复感染指数(multiplicity of infection,MOI)=10;HuMSC 组未加慢病毒悬液。转染24 h 后,各组弃原培养基,更换为新的α-MEM 完全培养基(含10%胎牛血清)。转染48 h 后进行嘌呤霉素抗药基因筛选,嘌呤霉素终浓度为2 mmol·L-1。筛选72 h,待HuMSC 组无存活细胞,NC-HuMSC 和IL-32highHuMSC组更换为不含嘌呤霉素的α-MEM 完全培养基(含10%胎牛血清)培养并扩增,同时另取同批次的HuMSC 继续培养。待细胞融合度达约80%时,荧光显微镜下观察各组细胞GFP 表达,并收取各组细胞用流式细胞仪测定GFP荧光强度计算转染效率。同时收集各组细胞分别提取总RNA,RT-qPCR 检测细胞IL-32mRNA 表达,鉴定IL-32highHuMSC是否稳定过表达IL-32。
1.6 lL-32highHuMSC 和NC-HuMSC 培养扩增及形态和表型鉴定
同1.2 和1.3 对NC-HuMSC 和IL-32highHuMSC进行培养扩增,并对其形态和细胞表型进行鉴定。
1.7 lL-32highHuMSC 和NC-HuMSC 成脂分化能力测定
分别将HuMSC,NC-HuMSC 和IL-32highHuMSC同1.4 进行成脂诱导分化,分别于诱导后第0,3,5,7,10 和14 天进行油红O 染色,并用ImageJ 软件分析脂滴形成面积;同时收集各组细胞并提取总RNA,RT-qPCR 检测成脂相关转录因子PPARγ,C/EBPα和ADImRNA 表达,测定NC-HuMSC 和IL-32highHuMSC成脂分化能力。
1.8 RT-qPCR检测成骨和成脂相关转录因子及IL-32 mRNA表达
取1.4 和1.7 提取的细胞总RNA,测定RNA 浓度,逆转录合成cDNA,程序为:70 ℃,10 min;42 ℃,1 h;70 ℃,15 min。随后以cDNA 为模板进行PCR,检测成骨相关转录因子RUNX2,ALP和DLX5及成脂相关转录因子PPARγ,C/EBPα和ADI或IL-32mRNA 表达水平。RT-qPCR 反应体系(20 μL):上下游引物(10 μmol·L-1)各0.5 μL,ddH2O 8.0 μL,cDNA 1.0 μL,2×MltraSYRP 混合物10.0 μL。反应条件:95 ℃10 min;95 ℃15 s,60 ℃1 min,共40 个循环;95 ℃15 s。以GAPDH为内参基因,采用2-△△Ct法计算目的基因相对表达水平。
1.9 统计学分析
实验结果数据以±s表示,使用GraphPad Prism 9 软件进行统计学分析。多组间比较采用单因素方差分析,两组间比较采用t检验。P<0.05 认为差异具有统计学意义。
2 结果
2.1 HuMSC和S-HuMSC形态和表型鉴定
倒置显微镜下观察发现,培养的HuMSC 和S-HuMSC 均呈长梭形、漩涡状、贴壁生长(图1)。流式细胞术检测结果表明,HuMSC 和S-HuMSC 均高表达CD73,CD90 和CD105,不表达或低表达CD14,CD34 和CD45(图2),提示HuMSC 和S-HuMSC符合MSC的生物学特征。

Fig.1 Morphology of human umbilical cord-derived mesenchymal stem cells(HuMSCs)and stimulated HuMSCs(S-HuMSCs).S-HuMSCs were the HuMSCs activated by tumor necrosis factor-α 20 μg·L-1 and interferon-γ 20 μg·L-1 for 24 h.Both HuMSCs and S-HuMSCs showed spindleshaped growth under an inverted microscope.

Fig.2 Cellular phenotypes of HuMSCs(A)and S-HuMSCs(B)detected by flow cytometry.See Fig.1 for the cell treatment.Both HuMSCs and S-HuMSCs positively expressed CD73,CD90 and CD105,and negatively expressed CD14,CD34 and CD45.
2.2 HuMSC 和S-HuMSC 成骨和成脂诱导分化能力鉴定
HuMSC 和S-HuMSC 成骨诱导分化14 d,ALP染色结果显示,诱导组细胞ALP 染色面积明显大于各自自分化对照组(P<0.01,图3A)。RT-qPCR 结果显示,HuMSC 和S-HuMSC 诱导组成骨分化相关转录因子Runx2,ALP和DLX5mRNA 表达亦显著高于各自自分化对照组(P<0.01,图3B)。由此表明,HuMSC和S-HuMSC均具有成骨分化能力。

Fig.3 Osteogenic differentiation abilities of HuMSCs and S-HuMSCs.A:alkaline phosphatase(ALP)staining area of HuMSCs and S-HuMSCs after 14 d of osteogenic induction,A2 was the semi-quantitative result of A1.B:the mRNA expressions of osteogenesis-related transcription factors.±s,n=3.**P<0.01,compared with the corresponding self-differentiated control group.
HuMSC和S-HuMSC成脂诱导分化10 d,油红O 染色可见,诱导组脂滴形成面积明显多于各自自分化对照组(P<0.01,图4A)。RT-qPCR 结果显示,HuMSC 和S-HuMSC 诱导组成脂分化相关转录因子PPARγ,C/EBPα和ADImRNA 表达亦显著高于各自自分化对照组(P<0.01,图4B)。由此表明,HuMSC和S-HuMSC均具有成脂分化能力。

Fig.4 Adipogenic differentiation abilities of HuMSCs and S-HuMSCs.A:oil red O staining area of HuMSCs and S-HuMSCs after 10 d of adipogenic induction,A2 was the semi-quantitative result of A1.B:the mRNA expressions of adipogenic transcription factors.±s,n=3.**P<0.01,compared with the corresponding self-differentiated control group.
2.3 S-HuMSC与HuMSC成脂诱导分化能力和lL-32表达水平的比较
HuMSC 和S-HuMSC 成脂诱导分化10 d 后,油红O 染色结果表明,S-HuMSC 诱导组细胞脂滴形成面积明显小于HuMSC 诱导组(P<0.01,图5A);RT-qPCR 结果表明,S-HuMSC 诱导组成脂分化相关转录因子PPARγ,C/EBPα和ADImRNA 表达亦低于HuMSC 诱导组(P<0.05,图5B),提示S-HuMSC 成脂分化能力较HuMSC 显著降低。RT-qPCR测定IL-32mRNA表达结果表明,S-HuMSC中IL-32mRNA 表达显著高于HuMSC(P<0.01,图5C)。

Fig.5 Comparison of adipogenic differentiation ability and IL-32 mRNA expression levels between HuMSCs and S-HuMSCs after 10 d of adipogenic induction.A:oil red O staining area,A2 was the semi-quantitative result of A1.B:the mRNA expressions of adipogenic transcription factors by RT-qPCR.C:IL-32 mRNA expression by RT-qPCR.±s,n=3.*P<0.05,**P<0.01,compared with HuMSC group.
2.4 慢病毒感染HuMSC 的效率和lL-32highHuMSC中IL-32 mRNA表达水平
荧光显微镜下可见,与HuMSC相比,NC-HuMSC和IL-32highHuMSC均出现大量绿色荧光(图6A)。流式细胞术检测转染效率结果显示,NC-HuMSC和IL-32highHuMSC 转染效率均>90%(图6B)。RT-qPCR检测结果表明,NC-HuMSC中IL-32mRNA表达与HuMSC 比较无明显变化,IL-32highHuMSC中IL-32mRNA表达显著高于HuMSC和NC-HuMSC(P<0.01)(图6C)。以上结果提示,过表达IL-32 的慢病毒可高效感染HuMSC,且IL-32highHuMSC 可稳定高表达IL-32。

Fig.6 Efficiency of lentivirus infection of HuMSCs and expression of IL-32 mRNA in lL-32highHuMSCs.The lentiviral vector containing the over-expression of IL-32 gene sequence with green fluorescent protein(GFP)and puromycin resistance genes(lentiviral vector with IL-32 over-expression)and the negative control(NC)lentiviral vector were constructed before the lentiviruses were harvested.HuMSCs were infected with the lentiviral vector with IL-32 over-expression and NC lentiviral vector,respectively,to obtain IL-32highHuMSCs and NC-HuMSCs.HuMSCs untransfected control group was set up at the same time.A:morphology of the cells under an inverted microscope and GFP expression under a fluorescence microscope;B:transfection efficiency calculated by capturing GFP fluorescence intensity by flow cytometry;C:IL-32 mRNA expression detected by RT-qPCR.±s,n=3.**P<0.01,compared with HuMSC group;##P<0.01,compared with NC-HuMSC group.
2.5 lL-32highHuMSC细胞表型鉴定
流式细胞术检测结果显示,HuMSC,NC-HuMSC和IL-32highHuMSC均高表达CD73,CD90和CD105,不表达或低表达CD14,CD34 和CD45(图7),提示IL-32highHuMSC表型未发生改变,符合MSC表型特征。

Fig.7 ldentification of phenotypes of lL-32high HuMSCs by flow cytometry.See Fig.6 for the cell treatment.HuMSCs(A),NC-HuMSCs(B)and IL-32highHuMSCs(C)highly expressed CD73,CD90 and CD105,while CD14,CD34 and CD45 were negatively or lowly expressed.
2.6 过表达lL-32抑制HuMSC成脂分化
将HuMSC,NC-HuMSC 和IL-32highHuMSC 进行成脂诱导分化,诱导后第0,3,5,7,10和14天,三者脂滴形成面积随时间均呈增加趋势。但从诱导后第3 天开始,IL-32highHuMSC 与HuMSC 和NC-HuMSC 相比,其脂滴形成面积均明显减少(P<0.01,图8A)。RT-qPCR 检测结果表明,从成脂诱导后第3 天开始,与HuMSC 和NC-HuMSC 相比,IL-32highHuMSC 成脂相关转录因子PPARγ,C/EBPα和ADImRNA 表达均显著降低(P<0.05,图8B)。以上结果提示,过表达IL-32 对HuMSC 成脂分化具有抑制作用。
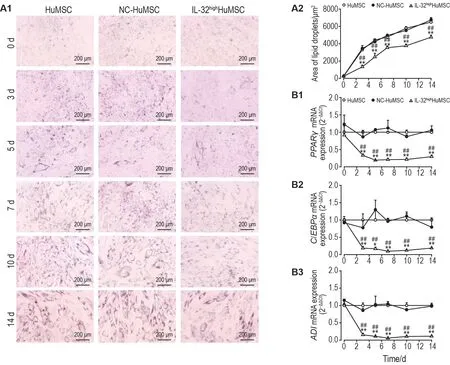
Fig.8 Over-expression of lL-32 on adipogenic differentiation ability of HuMSCs.HuMSCs,NC-HuMSCs and IL-32highHuMSCs were adipogenic induction and their adipogenic differentiation abilities were determined on the 0,3,5,7,10,and 14 days after induction.A:oil red O staining area,A2 was the semi-quantitative result of A1.B:mRNA expressions of adipogenic transcription factors by RT-qPCR.±s,n=3.*P<0.05,**P<0.01,compared with HuMSC group;##P<0.01,compared with NC-HuMSC group.
3 讨论
据世界卫生组织的统计数据,全球成年人肥胖(身体质量指数>30 kg·m-2)率近年来呈持续上升态势。异位脂质的沉积与胰岛素抵抗[9]、2 型糖尿病[10]和非酒精性脂肪性肝病[11]的发生密切相关。因此,调节脂肪生成对治疗脂肪代谢失衡相关疾病尤为重要。MSC 是成骨细胞和脂肪细胞的共同祖细胞,需严格调控其分化,以维持成骨和成脂的分化平衡。与年龄、绝经后和慢性疾病相关的多种骨质疏松性骨丢失疾病的特征是骨髓脂肪生成增加和骨形成减少[12]。MSC 向成骨细胞和脂肪细胞分化需要重要的信号通路,包括转化生长因子β/骨形态发生蛋白、Wnt 和Hedgehog 信号以及特异性转录因子如RUNX2 和PPARγ 等[13],其中PPARγ 在脂肪形成过程中发挥重要作用。在脂肪形成过程中,MSC表达转录因子锌指蛋白423,参与前脂肪细胞形成,并产生调节因子PPARγ和转录共激活因子C/EBPα/β 从而进一步促进其分化和成熟[14]。研究报道,IL-32共含有8 个外显子,组合构成不同的IL-32剪接异构体;IL-32 亚型有9 种,其中最常见的为IL-32α,IL-32β和IL-32γ[15],其中IL-32β可通过抑制PPARγ表达和AMP依赖的蛋白激酶活化而减少脂质累积[8]。但它们之间的联系错综复杂,影响因素也很多,MSC成脂机制尚需进一步研究。
本研究首先对S-HuMSC 和HuMSC 进行成脂诱导分化。结果表明,S-HuMSC 脂滴形成面积明显小于HuMSC,且成脂相关转录因子PPARγ,C/EBPα和ADImRNA表达亦明显低于HuMSC,提示S-HuMSC 成脂能力降低;但S-HuMSC 中IL-32mRNA表达显著升高。由此推测,IL-32对脂肪细胞形成具有一定的调控作用。
随后,用本研究构建的稳定过表达IL-32 的慢病毒载体转染HuMSC,获得IL-32highHuMSC,进一步验证IL-32 是否参与MSC 成脂分化过程。首先检测IL-32highHuMSC 是否保持MSC 的生物学特性。结果表明,IL-32highHuMSC细胞形态仍为成纤维样贴壁生长,高表达CD73,CD90 和CD105,低表达或不表达CD14,CD34 和CD45,且仍具有成脂分化能力,表明IL-32highHuMSC 具有MSC 的生物学特性。进一步研究结果表明,随成脂诱导时间延长,IL-32highHuMSC 脂滴形成面积与HuMSC 和NC-HuMSC相比明显减少;而且从成脂诱导分化后第3 天开始,IL-32highHuMSC 成脂相关转录因子PPARγ,C/EBPα和ADImRNA 表达与HuMSC 和NC-HuMSC 相比亦显著降低。由此提示,IL-32 参与调控HuMSC 的成脂分化,且过表达IL-32 对HuMSC的成脂分化具有抑制作用。
综上所述,IL-32 在MSC 成脂分化中发挥重要作用。随对其具体调控机制的深入研究,其有可能作为调控MSC 成脂分化的有效靶点,为脂肪代谢失衡相关疾病的精准治疗提供新思路。

