2,5-二甲氧基-4-碘苯丙胺对自由活动小鼠次级视觉皮质V2区γ振荡的作用
王福旗,田京伟,张树卓,苏瑞斌
(1.烟台大学药学院,山东 烟台 264005;2.军事科学院军事医学研究院毒物药物研究所,国家安全特需药品全国重点实验室,神经精神药理学北京市重点实验室,北京 100850)
致幻剂是一类天然或人工合成的精神活性物质,可影响人的情绪和感觉,使人在时间和空间上产生错觉和幻觉,导致自我歪曲、妄想和思维分裂。经典致幻剂的化学结构主要有3 类,即以N,N-二甲基色胺(N,N-dimethyltryptamine)为代表的色胺类、以麦角酸二乙胺(lysergic acid diethylamide)为代表的麦角碱类和以2,5-二甲氧基-4-碘苯丙胺(2,5-dimethoxy-4-iodoamphetamine,DOI)为代表的苯乙胺类。DOI 作为5-羟色胺2A 受体(5-hydroxytryptamine 2A receptor,5-HT2AR)激动剂被广泛用于构建幻觉模型,其引起的药物辨别反应、神经化学和电生理效应均可被选择性5-HT2AR拮抗剂氟利色林(volinanserin)所阻断[1]。
5-HT2AR 对调节皮质功能和认知起关键作用。目前普遍认为DOI 引起的生理效应和意识状态的改变主要是其与5-HT2AR 相互作用产生的[2-3],而且非临床和临床研究均表明,5-HT2AR 的激活是产生幻觉的必要条件[4]。5-HT2AR 在脑内分布不均一且广泛。受体放射自显影实验结果显示,5-HT2AR 在海马、丘脑核、新皮质和中脑均有分布,其中在新皮质区域分布最为密集[5]。5-HT2AR 在视觉皮质中高度表达,可能参与介导神经退行性疾病如精神分裂症和帕金森病等的幻觉症状的产生[6]。唯一已知能减轻精神分裂症患者幻觉症状的药物是抗精神分裂药,典型的抗精神分裂药如奥氮平和氯氮平等均能对抗幻觉症状[7],而且均对5-HT2AR 产生拮抗作用,提示幻觉症状的产生可能与5-HT2AR有关。
大脑包含不同的神经网络和区域,这些神经网络与大脑区域之间相互协调,产生更高的认知功能和执行功能。知觉来自丘脑皮质系统中的γ振荡的内在自组织,在唤醒机制、注意力机制和传入感觉输入的调节下形成连贯的集合,当产生幻觉时连贯的集合被打破,γ 振荡受到影响[8]。幻觉的产生也是神经网络和大脑区域之间的协调活动出现紊乱的结果。这些同步活动反映在振荡活动中,而大脑振荡可以通过脑电图(electroencephalography,EEG)记录的大脑不同频率的脑电波来评估。大脑中的脑电波主要有5种波形,分别是δ波(1~4 Hz)、θ波(4~7 Hz)、α 波(8~12 Hz)、β 波(12~30 Hz)和γ 波(30~80 Hz),这些脑电信号从低频的δ 波到高频的γ振荡,均是神经元放电产生的结果,反映大脑的活动情况。γ 振荡参与多种认知过程,如感觉、注意力、学习和记忆等,其振幅由低频θ 振荡的相位调制。视觉系统是人类和其他动物中非常重要的感知系统之一。初级视觉皮质是视觉系统中接收外部世界视觉信息的第一个皮质区域,对视觉系统感受到的信息进行整合和处理,处理的信息传递到高阶视觉区域进一步处理[9]。有研究表明,当健康受试者在外界的视觉刺激下产生视觉错觉时,初级视觉皮质γ 振荡功率升高[10]。次级视觉皮质与初级视觉皮质相邻,在视觉意识形成之前的加工阶段具有重要地位,视觉信息只有经过次级视觉皮质处理后才能传递到更高的视觉区域从而形成意识[11]。研究表明,致幻剂5-甲氧基-N,N-二甲基色胺增加初级视觉皮质V1 区的δ振荡功率,导致视觉丘脑皮质神经网络的异常活动[12]。另外,DOI 影响不同脑区的γ 振荡,如在前额叶皮质(medial prefrontal cortex,mPFC)可降低γ 振荡的功率[13],在伏隔核(nucleus accumbens,NAC)可降低高频γ 振荡(60~70 Hz)的功率[14]。DOI 主要引起视幻,其是否影响次级视觉皮质V2区场电位的变化尚未见报道。
幻觉是指在无相应的客观刺激时所出现的知觉体验,一些神经退行性疾病(如精神分裂症和帕金森病等)均伴随幻觉的产生,但幻觉产生的机制尚不清楚。以DOI 为药物模型研究致幻剂对次级视觉皮质V2区γ振荡的影响,可能为改善退行性神经疾病伴随的幻觉症状提供实验依据。
1 材料与方法
1.1 动物、药品、试剂和仪器
雄性C57BL/6J 小鼠,SPF 级,体重22~25 g,由北京华阜康生物科技股份有限公司提供,实验动物许可证号:SCXK(京)2019-0008。所有小鼠在25 ℃环境中分笼饲养,12 h/12 h 明暗周期昼夜交替,自由进食饮水。实验动物的使用遵守军事科学院军事医学研究院实验动物管理细则(动物伦理学审查编号:IACUC-DWZX-2023-P519)。
DOI(批号:B5321;HPLC 纯度≥98%),美国APExBIO 公司。氟利色林(批号:T5389;HPLC 纯度≥98%),美国TargetMol 公司;戊巴比妥钠,国药集团化学试剂有限公司;义齿基托树脂(粉),贺利氏古莎齿科有限公司;义齿基托树脂(液),上海新世纪齿科材料有限公司;牙科用粘接剂,北京永轩科技有限公司;异氟烷、体式显微镜(77001)、脑立体定位仪(68018)、单孔卤素冷光源(76301)、气体麻醉机(R50)和精细镊子,深圳瑞沃德生命科技有限公司;螺丝刀、0.3 mm 颅骨钻、螺丝和标准16 道小鼠孔型ECOG电极,苏州桃花岛生物科技有限公司;Plexon 生物信号记录系统(DHP),美国Plexon公司。
1.2 小鼠电极安装术
用戊巴比妥钠(100 mg·kg-1,ip)麻醉小鼠并固定在脑立体定位仪上,充分暴露颅骨。以前卤(bregma)(AP:0 mm;ML:0 mm)为坐标零点标记电极位置,分别安装测量电极(次级视觉皮质V2区)(AP:-2.5 mm;ML:-1.9 mm)(图1A)、参考电极(AP:-6.8 mm;ML:-2.3 mm)和接地电极(AP:-6.8 mm;ML:2.3 mm),用牙科水泥进行封固。最后,伤口周围涂抹碘伏,放回笼中单笼饲养。

Fig.1 Schematic of electrocorticography(ECOG)electrode recording.A:schematic representation of the locations of the anterior halo,area V2 of the secondary visual cortex,the reference(REF)electrode and the ground(GND)electrode.B:diagram of the ECOG recording.
1.3 局部场电位(local field potential,LFP)信号采集和数据分析
手术7 d 后,将小鼠转移至实验室环境饲养3 d,并每天在记录箱内适应30~40 min。正式开始记录时,小鼠称重并使用2%异氟烷进行麻醉,插上信号放大器后(图1B)放入记录箱中恢复自由活动并适应环境30~40 min。用Plexon DHP 系统记录电生理信号,然后以1 kHz 的采样频率采集LFP 信号。采用连接地线和覆盖铜网等方式排除信号采集系统噪音干扰。
待记录信号平稳后,ip 给予小鼠1% DMSO(溶剂),待信号稳定后记录30 min;待1%DMSO记录完成后ip 给予小鼠DOI 2.0 mg·kg-1,注射完毕5 min后开始记录30 min。待DOI 2.0 mg·kg-1记录完成后ip给予小鼠5-HT2AR拮抗剂氟利色林0.3 mg·kg-1,注射完毕5 min后开始记录30 min。
LFP 数据导入Neuro Explorer 软件,在分析之前使用滤波功能对原始数据进行4~7 Hz和30~80 Hz的滤波,滤除4~7 Hz 和30~80 Hz 以外的波段频率。使用Power Spectrafor Continuous功能分析功率谱,并绘制频谱图;将功率谱数据导入GraphPad Prism8.0.2 软件,分析4~7 Hz 和30~80 Hz 的总功率并进行统计。使用Matlab软件分析θ振荡和γ振荡的相位振幅耦合[15]。分别对θ振荡和γ 振荡的功率谱密度和相位振幅耦合调制指数(modulation index,MI)进行统计分析。
1.4 统计学分析
实验结果数据以±s表示,使用GraphPad Prism 8.0.2软件进行统计学分析,采用配对t检验分析给药前后LFP 功率变化。P<0.05 表示差异有统计学意义。
2 结果
2.1 DOl 增强小鼠次级视觉皮质V2 区γ 振荡功率且能被氟利色林逆转
热图(图2A)和频谱分析(图2B)显示,给予DOI 2.0 mg·kg-1后小鼠次级视觉皮质V2 区γ 振荡的功率谱升高,给予5-HT2AR 拮抗剂氟利色林0.3 mg·kg-1后下降。统计LFP在30~80 Hz的总功率结果(图2C)显示,给予DOI 2.0 mg·kg-1后总功率较给予DOI前(溶剂组)显著升高(P<0.05),给予5-HT2AR 拮抗剂氟利色林0.3 mg·kg-1后总功率较给氟利色林前(DOI 组)显著下降(P<0.05),表明DOI 可增强小鼠次级视觉皮质V2 区γ 振荡功率且能被氟利色林逆转。

Fig.2 2,5-Dimethoxy-4-iodoamphetamine(DOl)enhances power of γ oscillations in area V2 of mouse secondary visual cortex and can be reversed by volinanserin.Mice were ip given vehicle(1% DMSO),and recording was made for 30 min after the signals were stabilized;after 30 min,the mice continued to be injected with DOI(2.0 mg·kg-1,ip),and recording lasted for 30 min 5 min after injection.The 5-HT2AR antagonist volinanserin(0.3 mg·kg-1)was ip given after the DOI(2.0 mg·kg-1)recording was completed,and recording lasted for 30 min 5 min after injection.A:spectrograms of local field potential(LFP)recording in area V2 of mouse secondary visual cortex.B:schematic representation of the changes in the power spectral density(PSD)of γ oscillations in area V2 of the parafoveal cortex after being ip given the solvent,DOI(2.0 mg·kg-1)and volinanserin(0.3 mg·kg-1).C:the quantitative result from B.±s,n=6.*P<0.05,compared with vehicle group;#P<0.05,compared with DOI group.
2.2 DOl 增强小鼠次级视觉皮质V2 区θ 振荡功率且能被氟利色林逆转
热图(图3A)和频谱分析(图3B)显示,给予DOI 2.0 mg·kg-1后小鼠次级视觉皮质V2 区θ 振荡的功率谱升高,给予氟利色林0.3 mg·kg-1后θ 振荡的功率谱下降。统计LFP 在4~7 Hz 的总功率结果(图3C)显示,给予DOI 2.0 mg·kg-1后总功率较给DOI前显著升高(P<0.05),给予氟利色林0.3 mg·kg-1后总功率较给予DOI 时显著下降(P<0.05)。表明DOI 可以增强小鼠次级视觉皮质V2 区θ 振荡功率且能被氟利色林逆转。
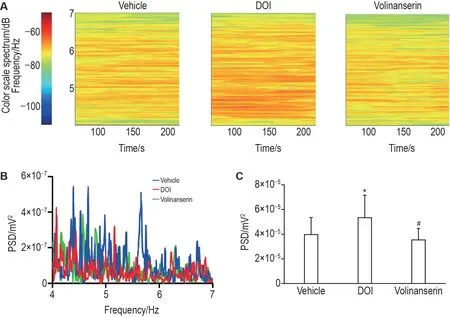
Fig.3 DOl enhances θ oscillatory power in area V2 of mouse secondary visual cortex and can be reversed by volinanserin.See Fig.2 for the treatment.A:spectrograms of LFP recording in area V2 of mouse secondary visual cortex.B:schematic representation of the changes in PSD of γ a oscillations in area V2 of the parafoveal cortex after being ip given the vehicle,DOI(2.0 mg·kg-1)and volinanserin(0.3 mg·kg-1).C:the quantitative result from B.x ±s,n=6.*P<0.05,compared with vehicle group;#P<0.05,compared with DOI group.
2.3 DOl对θ振荡和γ振荡相位振幅耦合的影响
θ 振荡和γ 振荡的相位振幅耦合MI 统计分析结果(图4)显示,与溶剂组相比,DOI 2.0 mg·kg-1组θ 振荡和γ 振荡相位振幅耦合MI 显著降低(P<0.01)。

Fig.4 DOl reduces phase-amplitude coupling of θ and γ oscillations.See Fig.2 for the treatment.A:the mean γ amplitude per θ phase averaged under control conditions(vehicle,A1),following DOI application(30 min,A2).B:the quantitative result from A.±s,n=14.**P<0.01,compared with vehicle group.
3 讨论
致幻剂作为一种精神活性物质,由于其能改变人类的认知,长久以来备受关注。文献报道,致幻剂产生幻觉效应的原因可能与5-HT2AR 激活有关[16]。5-HT2AR 在视觉皮质高表达[6]。研究发现,通过对人类大脑枕顶颞叶皮质进行电刺激可引起视觉幻觉[17]。枕顶颞叶皮质上包含初级视觉皮质和视觉联合区,具有视觉记忆的功能,提示视觉皮质可能参与幻觉的形成。幻觉是精神类疾病的主要症状之一。Huot等[18]研究表明,帕金森病患者产生幻觉时视觉皮质中5-HT2AR 的密度发生了改变。异常的振荡活动可能与精神类疾病的核心症状有关,如幻觉和思维障碍等。相较于没有幻觉的患者,有幻觉的精神分裂症患者在视觉感觉处理中高频活动更多[19]。故本研究以次级视觉皮质V2 区为目标脑区,通过观察神经振荡以及相位耦合的变化对DOI的致幻作用进行研究。
本研究结果显示,DOI可增加次级视觉皮质V2区γ 振荡的功率,氟利色林可以逆转DOI 的作用。γ 振荡是高频神经振荡,γ-氨基丁酸(γ-aminobutyric acid,GABA)能中间神经元参与γ 振荡的产生。当锥体神经元兴奋时,通过谷氨酸等兴奋性神经递质,使GABA 能中间神经元兴奋,后者通过缝隙连接和GABA突触形成一个产生γ节律性的中间神经元网络,并使锥体神经元也受到γ节律的调节,进而形成新一轮的γ 振荡[20]。大脑皮质上分布着大量的锥体神经元,5-HT2AR 激动剂激活5-HT2AR,诱导锥体神经元的兴奋性突触后电流增加[4,21-22],通过给予5-HT2AR 拮抗剂可消除该效应[23]。因此,DOI 可能是通过激活次级视觉皮质V2 区上的5-HT2AR,进而激活GABA 能中间神经元,导致γ 振荡功率增加。
θ 振荡是一种低频神经振荡,在大脑的多个部位都有发现。有文献报道,θ 振荡在空间上与视觉诱导的γ 振荡共宽,γ 振荡受θ 振荡的相位调制[24]。θ 节律下,抑制性神经元产生去极化和超极化的电流,激活或者抑制γ节律下的抑制性中间神经元;同样,作用于慢速GABAA受体的抑制性中间神经元也可以抑制作用于快速GABAA受体的抑制性中间神经元的活性,导致γ 节律的产生,因此θ 节律可以调节γ 节律[25]。而越来越多的研究表明,θ 振荡在视觉皮质中的存在与注意力机制有关[26]。在进行视觉刺激的选择性注意力的任务过程中,初级视觉皮质V1区的θ振荡以及θ振荡与γ振荡之间的相位振幅耦合随着注意力的变化而变化[24]。本研究结果表明,DOI 可以增强次级视觉皮质V2 区θ 振荡的功率以及降低θ 振荡与γ 振荡的相位振幅耦合,提示DOI可能是通过影响次级视觉皮质的神经网络电活动而发挥其药理作用。
幻觉是精神分裂症的主要症状之一,目前针对这类症状的治疗药物伴有严重的不良反应,探究这类疾病幻觉产生的机制显得尤为重要[27]。以往研究发现,这类疾病的患者在产生幻觉时均出现了γ 振荡的异常[28-29]。研究发现,应用θ 波脑刺激有助于精神分裂症患者的认知障碍的缓解[30]。目前电刺激使用的频率有θ 频率(4.5 和6 Hz)、α 频率(10 Hz)和γ 频率(40 Hz),电极放置的区域主要是背外侧前额叶皮质,如40 Hz 的交流电刺激可改善患者的阳性和阴性症状,也可改善患者的语言表达能力[31]。大多数5-HT2AR 激动剂(如DOI 等)都可以产生幻觉效应,以类似内源性精神病的方式改变认知[16]。对于这类药物研究的重要性在于能够用于精神病研究的实验建模[32]。因此,基于本研究中DOI 对次级视觉皮质V2 区γ 振荡的影响以及γ 振荡与θ 振荡之间相位振幅耦合的关系,可以更好地理解幻觉的形成机制。本研究结果可为精神疾病幻觉症状的治疗提供一定的思路。

