我国药品批发企业监督检查判定标准探索*
秦 媛,廖 均,宋 蕊
(四川省药品技术检查中心,四川 成都 610000)
《药品经营质量管理规范》(GSP)是国家对药品经营企业质量工作的规范性要求。实施GSP 对于提高药品经营企业质量管理水平,规范企业药品经营行为,保证药品质量极其重要[1]。但很多药品批发企业存在“重认证,轻管理”的心态,在GSP 认证检查上精心准备,耗费大量的人力、物力、财力,故在认证检查中很难发现企业存在的重大质量风险隐患,而企业一旦通过检查获得了“药品经营许可证”,在日后的经营过程中往往会放松GSP的要求[2-3]。监督检查可防止企业在换证后的5年时间里放松管理,监督企业规范化经营,落实主体责任,故监督检查必不可少。为进一步规范药品检查行为,推动药品监管工作尽快适应新形势,国家药品监督管理局(简称国家药监局)于2021年5月颁布了《药品检查管理办法(试行)》,各省级药监局也结合各地实际情况制订实施细则。在此,以《药品检查管理办法(试行)》中的常规检查(即监督检查)为研究主体,以现行药品批发企业监督检查为样本,通过制度研究、文献调研等,结合自身检查工作经验,探索新形势下的监督检查判定标准。
1 现行监督检查标准
1.1 相关文件
现行监督检查为质量管理规范符合性检查。按《中华人民共和国药品管理法》(以下简称《药品管理法》)、《中华人民共和国疫苗管理法》《中华人民共和国药品管理法实施条例》《药品经营质量管理规范》(总局令第28 号)、《总局关于与〈药品经营质量管理规范〉相关的冷藏、冷冻药品的储存与运输管理等修改5个附录文件的公告》(2016年第197号)、《药品经营质量管理规范现场检查指导原则(修订稿)》(食药监药化监〔2016〕160 号)(简称《指导原则》)、《药品检查管理办法(试行)》的规定对企业开展监督检查。
1.2 存在问题
《指导原则》监督检查结果判定标准已不适用:为贯彻实施《药品管理法》,国家药监局于2019年配套发布《国家药监局关于贯彻实施〈中华人民共和国药品管理法〉有关事项的公告》(以下简称《公告》)。《公告》规定,自2019年12月1 日起,取消药品的《药品生产质量管理规范》(GMP)和GSP 认证,不再受理GMP 和GSP 认证申请,不再发放药品GMP和GSP证书[4]。而《指导原则》为2016年发布,其监督检查结果判定标准包括,符合药品经营质量管理规范;违反药品经营质量管理规范限期整改;严重违反药品经营质量管理规范,撤销药品GSP 证书。这表明,《指导原则》的监督检查结果判定出现了明显滞后,已不适用于新法规下的监督检查判定。
参照《指导原则》认证检查结果判定标准不适用:《指导原则》中认证检查结果包括通过检查;限期整改后复核检查;不通过检查。但监督检查是由监管部门主动发起的一类检查,目的是帮助企业高质量发展,而认证检查是依企业申请而发起的一类检查,目的是发放(更换)证书。两类检查的目的属性不一致,也导致了认证检查结果判定标准不适用于监督检查。
现行《药品检查管理办法(试行)》判定标准缺乏指引:《药品检查管理办法(试行)》第二十八条规定了药品经营企业现场检查结论和综合评定结论的评定标准,其中未发现缺陷或缺陷质量安全风险轻微、质量管理体系较健全,检查结论为符合要求;发现一般缺陷、主要缺陷且有一定质量安全风险,但质量管理体系基本健全,检查结论为待整改后评定;发现严重缺陷,或发现的主要缺陷和一般缺陷涉及企业质量管理体系运行,可能引发较严重的质量安全风险,检查结论为不符合要求[5]。在以往的药品流通监督检查中,依靠严重缺陷或主要缺陷和一般缺陷的缺陷数量对检查结果进行判定,《药品检查管理办法(试行)》发布后,引入了风险判断的思维,除发现严重缺陷可直接判定检查结论为不符合要求外,对于某些主要缺陷和一般缺陷,检查组可根据风险识别划分风险等级,也可判定其为不符合要求。但检查组目前很难实现单一使用《药品检查管理办法(试行)》进行准确判定,究其原因,一是检查组在进行监督检查时无法像认证检查一般获取企业提供的申报资料,从而无法充分了解企业状况;二是尚未出台相应的指导性文件,对于可判定为不符合要求的情形,仍未确定统一的判定标准和判定尺度。
2 检查结论为不符合要求的情形
2.1 《指导原则》中的严重缺陷项目
《指导原则》中共涉及10条严重缺陷项目(见表1)。药品批发企业做到合法、诚信经营,质量管理制度的建立,计算机系统的应用,药品采购来源合法,票、账、货、款一致是保证企业经营药品质量的前提和基础,涉及此类缺陷往往表明企业存在重大质量风险,因此,一旦发现此类缺陷,即可判定企业不符合要求。
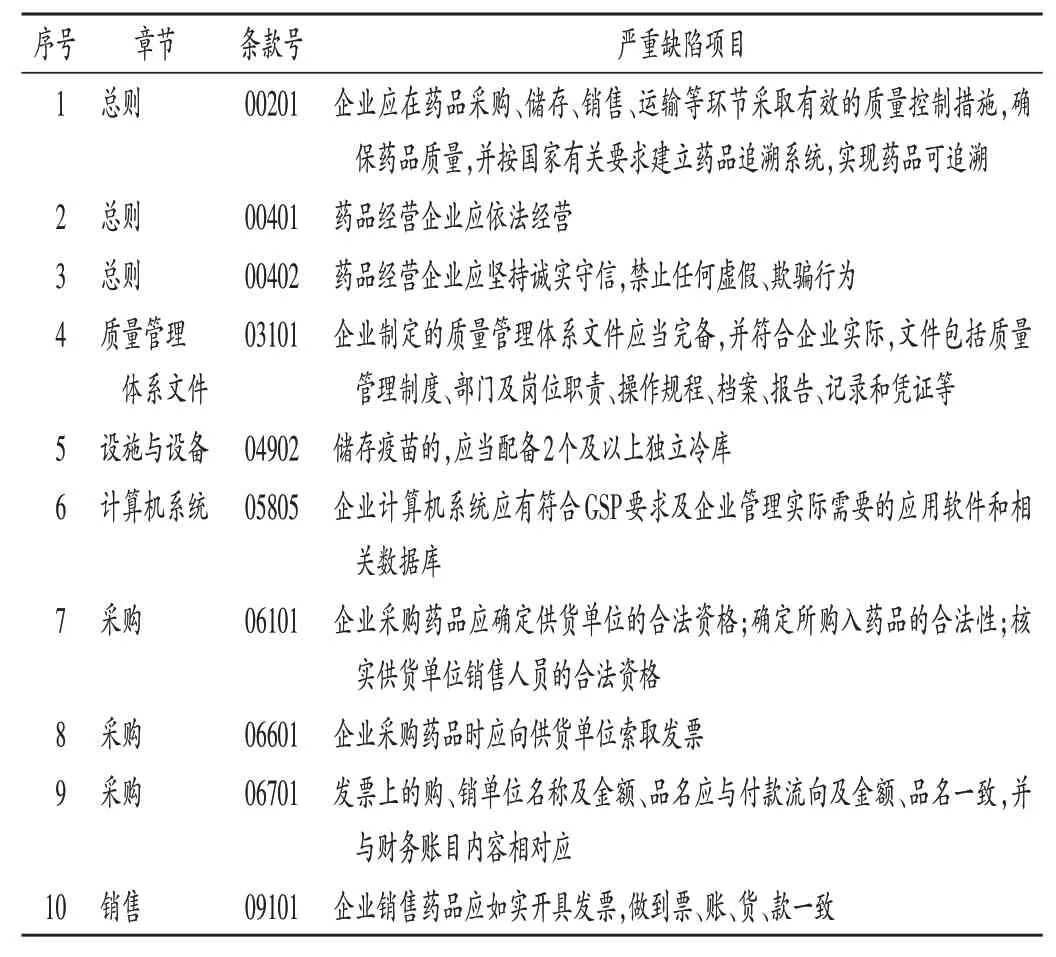
表1 严重缺陷项目表Tab.1 List of serious defective items
2.2 其他可能判定为不符合要求的情形
查阅省级GSP 认证检查或监督检查中的缺陷项目可发现,人员与培训、储存与养护方面出现的缺陷项均较频发[6-10];计算机系统作为批发企业保障经营信息准确和管理高效的基础,关系到企业GSP 的实施效果,对计算机系统进行监督检查,应当是目前药品监管部门进行检查的重点[11];冷链药品的运输和配送与其质量密切相关。故结合自己在检查过程中的经验从以上4 个方面分析,阐述不涉及严重缺陷项目但存在较高风险(即可判定为不符合要求)的情形(见表2)。

表2 可能判定为不符合要求的情形Tab.2 Cases that may not meet the requirements
此12条情形可能引发较严重的质量风险,符合《药品检查管理办法(试行)》中检查结论为不符合要求的条件。但若检查中发现上述12条情形,检查组仍需根据现场情况视情节轻重及产生的实际影响进行综合判定,不可一概而论地判定为不符合要求。
3 建议
3.1 与执法部门共同议定监督检查结果判定标准
查询全国31个省级行政区(除香港、澳门、台湾外)药监局官网可知,目前仅3 个省份出台了《药品检查管理办法(试行)》实施细则,分别为《河南省药品检查管理办法实施细则(试行)》《山西省药品检查管理实施细则(试行)》《贵州省药品检查管理办法实施细则(试行)》,以上实施细则中规定检查结论和综合评定结论均包括符合要求、基本符合要求、不符合要求。建议开展监督检查时,依据国家药监局和其他各省药监局办法的规定,给出结论。
在监督检查结果判定标准缺少具体细则指引时,建议根据《药品检查管理办法(试行)》要求,拟订具有一定操作性的结果判定指引。建议将《总局关于整治药品流通领域违法经营行为的公告》(2016年第94 号)[12]中列举的10 种药品流通领域违法经营行为、《指导原则》和企业典型违规行为结合起来,出台科学有效的判定标准细则,统一检查员结果判定的标准和尺度,更好地指导监督检查的开展。
3.2 与执法人员共同开展检查
按《药品检查管理办法(试行)》规定,检查组应由2 名执法人员和2 名检查人员构成。建议吸纳执法人员成为检查员,用检查员的思维开展符合性检查,参与各辖区的监督检查。当现场检查中发现违法违规行为,执法人员第一时间转换身份,合法取证,其余检查员做好技术支撑,并在现场检查报告中给出处置建议。从而促进检查更符合法规要求及稽查检查更好融合,使检查结果能更好地转化成稽查的利器,让监管落地,引导企业完善质量体系,促进企业高质量发展。
3.3 构建监督检查质量管理体系
建议构建统一的监督检查质量管理体系。按ISO9001∶2008 质量管理体系要求,涵盖现场检查前准备工作,现场检查工作的开展,检查报告审核与处置,检查现场突发情况的处置,检查计划、检查方案的制定、变更,检查报告的撰写,检查结果的移交;检查员的准入、培训、考核,检查员的层级认定,现场检查组的抽调、廉政教育及各类模板记录的制定等内容。由一个机构发起质量管理体系认证,各监管部门参照执行,保证监督检查工作有序开展。
4 结语
检查机构要紧密关注药品流通行业法律法规的出台情况,企业实际情况,以及监管机构的监管需求,争取在现行法规下和监管部门的支持下,制定一个既贴合监管需求,又符合企业实际状况的结果判定指引标准,从而实现为监管部门做好技术支撑,为企业做好服务,助力医药企业高质量发展的愿景。

