MCP-1基因对脓毒症急性肾损伤发生的作用研究
郭峻氚, 王静静, 郭仁楠, 肖 东, 刘 艳
(新疆维吾尔自治区人民医院重症医学科, 乌鲁木齐 830000)
急性肾损伤(Acute kidney injury,AKI)是引发慢性肾脏病的重要原因,尽管部分患者能够平安度过急性期,但其长期病死率仍居高不下[1]。近年来血液净化技术和重症监护治疗水平有了较大的进步,但AKI患者的临床治疗及预后效果仍有待改善。有报道显示,对于患有AKI的危重症患者而言,其预后受到AKI影响的概率高达40%[2-4]。近1/3患有AKI的危重症患者会在90 d内死亡,且其余危重症患者90 d后的归因死亡率约为10%。在诱发危重症患者形成AKI的全部因素中,脓毒症占比高达50%[5]。然而,目前临床上对于脓毒症所致AKI的病理生理机制尚未明确。基于此,本研究主要通过开展体外细胞生物学实验探讨单核细胞趋化蛋白-1(Monocyte chemotactic protein 1,MCP-1)基因表达与脓毒症所致AKI的相关性,旨在为临床明确脓毒症所致AKI发病机制提供参考。
1 资料与方法
1.1 一般资料选取2022年9月-2023年9月新疆维吾尔自治区人民医院重症医学科收治的50例脓毒症AKI患者作为AKI组,纳入同期50例健康受试者作为对照组。对照组男性27例,女性23例;年龄18~80岁,平均年龄(55.24±6.33)岁。AKI组男性28例,女性22例;年龄18~80岁,平均年龄(55.13±6.25)岁。高血压病史23例,肺部感染32例;急性生理与慢性健康状况评估Ⅱ(Acute physiology and chronic health evaluation,APACHE Ⅱ)评分12~20分,平均APACHE Ⅱ评分(15.98±0.52)分。本研究已获得医院伦理委员会批准(KY2021052616),受试者均知情同意。纳入标准:(1)均符合《拯救脓毒症运动:脓毒症与脓毒性休克治疗国际指南(2021版)》[6]中相关诊断标准,同时符合AKI相关临床诊断标准[7];(2)首次入住ICU。排除标准:(1)自身免疫性疾病或感染性疾病;(2)既往慢性肾功能衰竭;(3)各种肾病、糖尿病;(4)孕妇。
1.2 实验材料人MCP-1 酶联免疫吸附试验(Enzyme-linked immunosorbent assay,ELISA,上海科艾博生物技术有限公司);细胞角蛋白14(Cytokeratin 14,CK14)和细胞角蛋白18(Cytokeratin 18,CK18)抗体购自上海科敏生物科技有限公司;细胞增殖检测试剂盒(Cell counting kit-8,CCK8,北京博奥森生物技术有限公司);白细胞介素-1β(Interleukin-1β,IL-1β)、白细胞介素6(Interleukin 6,IL-6)、白细胞介素10(Interleukin 10,IL-10)、γ-干扰素(Interferon-γ,IFN-γ)和肿瘤坏死因子-α(Tumor necrosis factor α,TNF-α)抗体均购自上海酶联生物公司;细胞培养箱(上海市颐习仪器设备公司);酶标仪(江苏省常州市锐品密仪器有限公司);核糖核酸(Ribonucleic acid,RNA)提取试剂盒(批号:AM1900,美国Thermo Fisher Scientific公司);实时定量聚合酶链式反应(Polymerase chain reaction,PCR)仪(美国Applied Biosystems公司);离心机(美国Thermo Fisher Scientific公司);荧光显微镜(德国Leica公司);倒置显微镜(日本奥林巴斯光学工业股份有限公司)。
1.3 方法
1.3.1 ELISA法检测MCP-1在脓毒症AKI患者外周血中的表达 分别采集全部受试者清晨空腹上肢静脉血5 mL,以3 000 r/min离心15 min,取上清液,采用ELISA法测定AKI患者及健康人群血清中MCP-1表达。
1.3.2 尿液的收集和肾小管上皮细胞分离培养方法
1.3.2.1 尿液收集 先排空晨尿,饮用水后用无菌的15 mL离心管收集适量尿液,尽量取洁净的中段尿,密封后置于冰上并及时进行尿液细胞分离以防尿液细胞在尿液中留置过久而死亡。
1.3.2.2 尿液肾小管上皮细胞分离 将盛有尿液的离心管置于离心机中,以1 500 r/min离心5 min。弃去上清液,留置沉渣约1 mL,向沉渣中加入适量冲洗缓冲液,小心吹打混匀,室温下以1 500 r/min离心10 min。弃去上清液,留置沉淀约0.2 mL,向沉淀中加入1 mL尿液细胞初级培养液,吹打混匀后将其转移至由0.1%明胶溶液包被过的孔板中,再加入1 mL细胞初级培养液,将其置于培养箱内恒温培养。
1.3.2.3 肾小管上皮细胞传代 每天观察细胞的生长情况,3~7 d后出现小团的细胞克隆,每孔有5~20个小克隆,之后肾小管上皮细胞会进行稳定增殖。当细胞培养至80%~90%密度时,吸净培养液,用磷酸盐缓冲盐溶液(Phosphate buffered saline,PBS)洗涤2次,加入0.25%胰酶溶液在室温条件下消化约3 min,加入胰酶抑制剂终止消化,用枪头轻轻吹打使细胞从孔壁上脱落。将细胞悬液抽吸至15 mL离心管中,1 000 r/min离心5 min,弃去上清液,加入2 mL培养液,用吸管将细胞吹匀,在恒温条件下进行传代培养。当各代细胞生长至80%~90%密度时,继续按照上述方法进行传代。
1.3.3 免疫荧光法检测肾小管上皮细胞MCP-1的表达 按照AKI的风险损伤失效损失终末期肾脏疾病(Risk injury failure loss end stage kidney disease,RIFLE)诊断标准,收集AKI患者尿液,从尿液中分离出肾小管上皮细胞,用PBS进行漂洗,血清封闭,每张切片滴加50 μL适当浓度的特异性单克隆抗体MCP-1(鼠来源),4℃过夜后,用PBS漂洗数次,滴加用不同荧光素标记的二抗(分别是不同荧光素标记的抗鼠和抗兔的抗体),室温孵育1 h后用PBS冲洗,滴加抗荧光淬灭封片液,盖玻片封片后在荧光显微镜下观察并拍照。
1.3.4 MCP-1过表达载体构建和RNA干扰 根据前期克隆MCP-1测序获得的编码序列(Coding sequence,CDS)设计3条特异性小干扰RNA(Small interfering RNA,siRNA),送生物公司合成。按照说明书要求用无RNA酶水稀释至100 nmol/L后用于验证和功能研究。利用前期克隆的MCP-1序列设计引物,结合pcDNA3.1载体酶切位点和MCP-1序列分析,引入酶切位点,PCR扩增、连接、转化及测序鉴定,构建MCP-1过表达载体pcDNA3.1-MCP-1。将siRNA和pcDNA3.1-MCP-1转染肾小管上皮细胞,检测MCP-1最佳过表达条件和干扰序列。按此法分为:阴性对照组(Negative control,NC)、MCP-1组(过表达MCP-1基因)、siRNA组(干扰MCP-1基因)。
1.3.5 CCK8细胞增殖检测试剂盒检测细胞增殖 将细胞按150 μL、1 500个/孔接种于96孔板中,置于37℃、5%CO2培养箱培养24 h后,替换为不含血清的培养基。加入pcDNA3.1-MCP-1和MCP-1特异siRNA并设阴性对照孔。测定每孔pH值后放入培养箱,分别培养12、24、36、48、72 h。每孔加入10 μL CCK-8溶液孵育2 h,用酶标仪测定吸光度值。
1.3.6 RT-qPCR方法检测细胞中MCP-1的表达 取分离好的肾小管上皮细胞,用Trizol试剂提取总RNA,经紫外分光光度计(A260/A280为1.8~2.0)和凝胶电泳鉴定后进行定量,用逆转录试剂盒进行逆转录合成cDNA模板,随后进行PCR反应,在美国国家生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库上获得MCP-1、炎性细胞因子白细胞介素-1β(IL-1β)、白细胞介素6(IL-6)、白细胞介素10(IL-10)、γ-干扰素(IFN-γ)、肿瘤坏死因子α(TNF-α)和内参GAPDH的mRNA序列,设计引物进行聚合酶链反应,建立25 μL PCR反应体系,94℃ 4 min、94℃ 50 s、60℃ 50 s、72℃ 80 s、72℃ 10 min,循环数35次,最后取6 μL PCR产物凝胶电泳分析。采用Real-TimePCR仪进行检测,采用2-ΔΔCt法分析MCP-1表达情况。
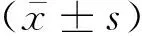
2 结果
2.1 MCP-1在AKI外周血和尿液中的表达ELISA检测结果显示,与对照组相比,AKI组患者外周血和尿液中的MCP-1表达量显著升高(P均<0.05),见表1。
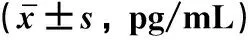
表1 两组外周血与尿液中MCP-1表达水平比较
2.2 肾小管上皮细胞原代培养和鉴定基于收集的尿液样本,首先采用percol梯度离心法联合差速贴壁法获得AKI患者的肾小管上皮细胞,然后利用CK14和CK18抗体进行细胞免疫荧光监测,对原代培养的肾小管上皮细胞进行鉴定。肾小管细胞培养24 h,分离培养的上皮细胞呈现多边形,具有较强立体感,形态正常。培养至72 h,细胞汇合度达到90%,生长速度正常(图1)。通过细胞免疫荧光鉴定(图2),选择上皮细胞标志物CK14和CK18,对细胞进行原代培养24 h,90%以上的细胞表达细胞标志物CK18,约84%的细胞表达CK14,表明分离获得肾小管上皮细胞的纯度较高。

原代培养24 h(10×) 原代培养72 h(10×)
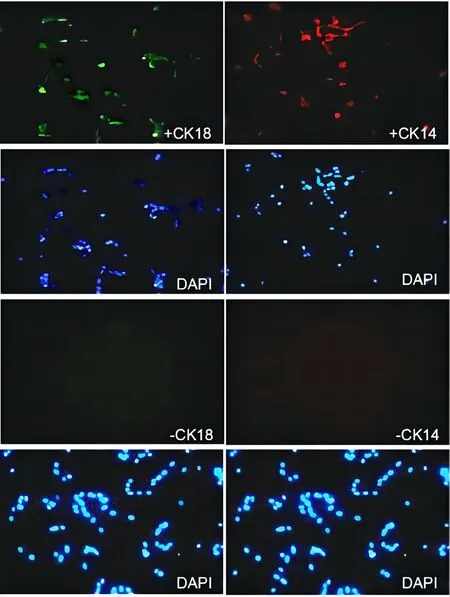
图2 肾小管上皮细胞鉴定图
2.3 MCP-1基因对肾小管上皮原代细胞增殖的影响利用原代培养的肾小管上皮细胞,通过过表达和干扰MCP-1基因的表达,利用CCK8细胞增殖检测试剂盒检测细胞增殖的变化。结果显示,MCP-1组在24、48、72 h的细胞数量分别为(184.12±4.32)×1012个/L、(281.35±7.35)×1012个/L、(709.8±5.41)×1012个/L;siRNA组在24、48、72 h的细胞数量分别为(221.65±5.61)×1012个/L、(424.23±8.25)×1012个/L、(786.52±6.28)×1012个/L;NC组在24、48、72 h的细胞数量分别为(209.34±6.37)×1012个/L、(382.24±6.32)×1012个/L、(800.29±7.56)×1012个/L。与NC组相比,siRNA组在24、48 h细胞数量增加(P均<0.05);与MCP-1组相比,siRNA组在24、48、72 h的细胞数量增加(P均<0.05)。
2.4 MCP-1基因对肾小管上皮原代细胞炎性因子表达的影响利用RT-qPCR检测过表达和干扰MCP-1基因后,肾小管上皮细胞炎性因子的表达变化。结果显示,NC组的IL-1β、IL-6、INF-γ因子的表达水平随着时间的推移逐渐升高。MCP-1组的IL-1β、IL-6、IL-10、INF-γ和TNF-α因子表达水平随着时间的推移逐渐升高。siRNA组的IL-1β、IL-6、INF-γ因子无显著升高趋势。提示MCP-1显著促进了肾小管上皮细胞的炎症反应,见图3。
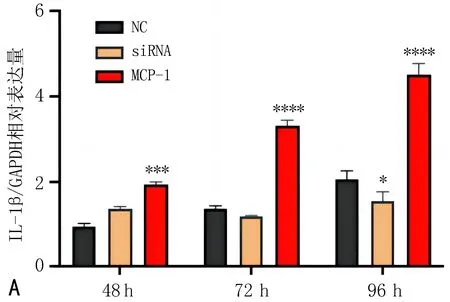
注:与NC组比较, *P<0.05, **P<0.01, ***P<0.001, ****P<0.000 1。
3 讨论
脓毒症导致AKI的病理生理学机制是多方面的,且不同的患者之间可能不同[8-10]。研究表明,脓毒症所致的AKI是肾小管上皮细胞对炎性损伤信号的适应性应答[11-12]。免疫细胞激活后所合成或由病原体直接产生的炎性介质(也称损害或病原体相关分子模式,DAMPs及PAMPs)被免疫系统识别后可对抗感染,然而该过程也会损伤宿主细胞。肾小管上皮细胞可通过与Toll样受体4(TLR4)、骨髓分化因子88等受体结合,对DAMPs及PAMPs进行识别,从而诱发核因子κB(NF-κB)及肿瘤坏死因子α(TNF-α)的过度表达[13-15],进而可能对肾小管上皮细胞造成损伤。尽管目前临床对于脓毒症所致AKI的病理生理学已有了初步的认识,但其具体作用机制仍需进一步探讨。
MCP-1为一种重要的炎症因子,主要由单核细胞、巨噬细胞、肾脏固有细胞如肾小管上皮细胞、内皮细胞、系膜细胞、间质细胞和足细胞等受各种理化因素的刺激后合成和分泌[16]。MCP-1可以通过调控炎症细胞运输来控制炎症反应,并能够对组织损伤中白细胞的募集进行调节[17]。MCP-1可通过多种途径导致不同程度的肾脏损伤。有文献显示,在肾小球肾炎模型和糖尿病模型中发现MCP-1通过促进肾脏巨噬细胞浸润及肾间质损伤从而参与肾损伤过程[18]。然而,目前关于MCP-1是否在脓毒症所致AKI中发挥作用尚缺乏研究。有关研究表明,在脓毒症小鼠模型中抑制或拮抗MCP-1均可引起TNF-α、IL-1β等炎性细胞因子水平下降,从而改善小鼠预后[19]。本研究结果显示,AKI患者外周血及尿液中的MCP-1表达量均显著升高(P<0.05),与杨晓玲等[20]的研究结论一致,提示MCP-1作为促炎介质可能在脓毒症所致AKI的发生中发挥重要作用。本研究结果显示,过表达MCP-1基因后,肾小管上皮细胞的增殖速度下降,表明MCP-1基因可能对肾小管上皮细胞的生长和增殖具有抑制作用。而干扰MCP-1基因后,肾小管上皮细胞的增殖速度显著增加,说明MCP-1基因对肾小管上皮细胞的增殖具有负向调控作用。而过表达MCP-1基因后,IL-1β的表达水平显著增加,表明MCP-1可能通过调节IL-1β的表达来影响肾小管上皮细胞的生长和增殖。IL-1β可以促进炎症反应和组织损伤[21]。因此,MCP-1可能通过促进IL-1β的表达来加重肾脏的炎症反应和组织损伤,进而促进AKI的发生。此外,通过过表达和干扰MCP-1基因,本研究所选取肾小管上皮细胞炎性因子IL-6和INF-γ 的表达趋势均与IL-1β的表达趋势一致,表明MCP-1还可能通过调节其他炎性因子的表达来影响肾小管上皮细胞的炎症反应。由上述结果推断,脓毒症患者可能由于肾脏中MCP-1表达上调,从而引起巨噬细胞的过度活化,促进IL-1β、IL-6、IL-10、INF-γ等炎症因子的合成及分泌,进而引发AKI。
本研究结果表明,MCP-1基因在脓毒症所致AKI中可能发挥重要作用,因此以MCP-1为靶点的治疗策略有望成为脓毒症所致AKI的临床治疗新方向。例如,临床或许可以通过抑制脓毒症患者MCP-1的表达,多靶点调控炎症因子,阻断炎症细胞因子的级联反应,从而减轻患者肾脏的炎症反应,以期缓解患者肾脏损伤,以防AKI发生或改善脓毒症所致AKI患者的预后。然而,上述治疗策略具体实施方案及应用于防治脓毒症所致AKI的安全性及有效性仍需开展大量临床研究进行构建及验证。

