糖肾灌肠方联合缬沙坦治疗2型糖尿病肾病的效果及对大鼠肾脏组织TLR2和TLR4表达的影响
李 晶, 冯 涛, 陈 晨, 马 丽
(新疆医科大学附属中医医院1内分泌科, 2普外二科, 乌鲁木齐 830000)
2型糖尿病肾病为一种糖尿病微血管并发症,2型糖尿病肾病患者体内存在一种持续性的微炎症状态[1]。微炎症状态与病原体感染有所区别,以全身循环低水平、持续性的炎症因子水平升高为主要表现[2]。微炎症状态始于2型糖尿病肾病早期,其伴随病情进展不断加重,最终造成患者肾功能障碍及肾实质损伤。因此,对微炎症状态加以控制,为延缓糖尿病肾病疾病进展提供了新思路。目前,西医多以降压、降糖、降脂等方式对糖尿病肾病患者进行治疗。而中医则基于整体视角进行辨证施治,对2型糖尿病肾病具有独特疗效。中药灌肠疗法是基于中医药基本理念而形成的一类中国特色传统外治法。作为一种经验药方,糖肾灌肠方在临床上已被证明可明显缓解糖尿病肾病患者肢体浮肿、腰膝酸困、面色晦暗、乏力、恶心等症状,从而提升其生活质量。缬沙坦是现阶段临床上用于控制2型糖尿病肾病患者血压水平的一种常见药物。基于此,本研究针对糖肾灌肠方联合缬沙坦对2型糖尿病肾病的临床疗效及大鼠肾脏组织TLR2 和 TLR4表达的影响进行观察,现报道如下。
1 资料与方法
1.1 材料
1.1.1 实验动物 选取SPF级8周龄SD雌性大鼠60只[来源:辽宁长生生物技术股份有限公司;动物许可证号:SCXK(辽)2020-0001],饲养于新疆维吾尔自治区中医药研究院。饲养条件[动物适应环境 7 d,自由饮水饮食,室温(22±1)℃,湿度(40±10)%,光照周期 12 h/12 h],适应性喂养7 d后,将大鼠进行分组。本研究通过新疆医科大学实验动物伦理委员会审批(批号:IACUC-20201002-9)。
1.1.2 实验试剂及仪器 水合氯醛(厂家:济南嘉格生物科技有限公司)、链脲佐菌素(厂家:美国Sigma公司)、血糖仪及血糖试纸(厂家:美国强生)、-80℃冰箱(厂家:中国荣事达;型号:BCD-245F)、大鼠麻醉机(厂家:上海玉研科学仪器有限公司)、全自动生化分析仪(厂家:日本日立公司;型号:7080)、电子天平(厂家:德国Sartorius公司)、血液基因组柱式提取试剂盒(厂家:康为世纪生物科技有限公司);苏木精-伊红染色试剂 盒(厂家:北京索莱宝生物科技有限公司)。
1.1.3 药物配置 糖肾灌肠方(新疆维吾尔自治区中医药研究院提供):生大黄30 g、煅牡蛎50 g、泽泻30 g、丹参15 g、槐花30 g、黑顺片15 g、黄芩30 g。总方200 g加入10倍量水煎煮浓缩至150 mL,灌肠给予0.13 mL/10 g/只。缬沙坦胶囊(厂家:北京诺华制药有限公司;批准文号:国药准字H20040217;规格:80 mg)。240 mg加入100 mL生理盐水,配置成2.4 mg/mL,0.12 mg/10 g/只。
1.2 方法
1.2.1 分组 将60只SD雌性大鼠,随机选取10只作为空白对照组,其余50只进行右侧肾脏摘取手术,构建2 型糖尿病肾病大鼠模型,造模过程中死亡10只,将造模成功的40只大鼠随机分为模型组、糖肾灌肠方干预组、缬沙坦干预组、缬沙坦+糖肾灌肠方干预组,并对糖肾灌肠方干预组采用糖肾灌肠方治疗,对缬沙坦干预组采用缬沙坦治疗,对缬沙坦+糖肾灌肠方干预组采用糖肾灌肠方联合缬沙坦治疗。
1.2.2 右肾摘除 (1)用麻醉机麻醉大鼠并仰卧固定放置;(2)备皮,靠右侧开口;(3)游离大鼠右肾,结扎血管,输尿管,摘除右肾;(4)逐层缝合,碘伏消毒后,将大鼠放回笼中,术后观察1周 。右肾摘除手术过程,见图1。
图1 右肾摘除术手术过程
1.2.3 构建2型糖尿病肾病模型 (1)构建2型糖尿病大鼠模型:肾摘除模型造模成功后,大鼠高糖高脂喂养30 d后,禁食24 h,精确称量体重,按照40 mg/kg的剂量予大鼠腹腔注射1%链脲佐菌素(Streptozocin,STZ)溶液,连续注射3 d。注射72 h后,剪掉大鼠尾部尖端少许,用血糖仪测量大鼠血糖,血糖高于16.7 mmol/L视为造模成功;(2)构建2 型糖尿病肾病模型:2型糖尿病模型造模成功后,大鼠用代谢笼收集24 h尿液并进行测定,尿量>原尿量50% h、 尿蛋白排泄率>30 mg/24 h视为2型糖尿病肾病模型制备成功。
1.3 药物干预造模成功后,空白对照组、模型组给予等量生理盐水;糖肾灌肠方干预组给予0.13 mL/10 g糖肾灌肠方溶液;缬沙坦干预组给予缬沙坦片溶液0.12 mg/10 g;缬沙坦+糖肾灌肠方干预组给予0.13 mL/10 g糖肾灌肠方溶液和0.12 mg/10 g缬沙坦溶液;各组大鼠均每天1次,连续灌肠4周。见图2。

空白对照组
1.4 取材(1)腹腔注射10%水合氯醛以麻醉大鼠,注射剂量330 μL/100 g;(2)剪开大鼠胸腔,由心脏采血后将血液置入离心管,静置30 min后,3 000 r/min离心10 min,吸取上层血清冻存;(3)取肾脏,一半4%多聚甲醛固定 一半冻存;(4)取粪便冻存。
1.5 观察指标与方法
1.5.1 血糖水平测量 采用血糖仪分别测量并记录造模后给药前大鼠的尾静脉空腹血糖水平,空腹血糖水平>16.7 mmol/L视为2型糖尿病大鼠模型构建成功。
1.5.2 肾脏病理学检查 大鼠麻醉处死后立刻剖腹游离出肾脏,用冰盐水对肾脏进行灌洗,分离肾皮质,进行常规脱水、石蜡包埋、切片、脱蜡、苏木精-伊红(Hematoxylin-eosin staining,HE)染色、脱水、封片等操作处理,并在光镜下对大鼠肾脏组织的形态学改变情况进行观察。
1.5.3 24 h尿量、尿蛋白、BUN、Cr测定 2型糖尿病模型造模成功后,用代谢笼收集各组大鼠24 h尿液进行测定,尿量>原尿量50%、 尿蛋白排泄率>30 mg/24 h ,视为2型糖尿病肾病模型制备成功;采用自动生化分析仪分别测定各组大鼠BUN、Cr。
1.5.4 肾湿质量、肾脏肥大指数测定 大鼠麻醉处死后,立即剖腹游离出肾脏,用滤纸将上面的血迹吸干,采用电子天平称量肾湿质量,并计算出肾脏肥大指数(Kidney hypertrophy index,KI)。计算公式如下:KI=右肾湿质量/体质量
1.5.5 TLR2、TLR4mRNA水平测定 采用实时定量聚合酶链式反应(Polymerase chain reaction,PCR)技术测定大鼠肾组织中的TLR4 mRNA水平。用总RNA抽提试剂(Total RNA extraction reagent,TRIZOL)从新鲜分离的大鼠肾组织中提纯总RNA,采用互补DNA(Complementary DNA,cDNA)合成试剂盒获得第一链cDNA,然后进行定量PCR反应,以甘油醛-3-磷酸脱氢酶(Glyceraldehyde-3-phosphate dehydrogenase,G3PDH)作为内参,采用2-△△Ct法得出结果并进行计算。基因引物序列如下:TLR4的正向引物序列为CATGGATCAGAAACTCAGCAAAGTC,反向引物序列为CATGCCATGCCTTGTCTTCA;TLR2的正向引物序列为TGGAGGTCTCCAGGTCAAATCT,反向引物序列为TGTTTGCTGTGAGTCCCGAG。
1.5.6 TLR2 和 TLR4蛋白表达水平测定 采用免疫印迹法(Western blotting,WB)测定大鼠肾组织中的TLR2、TLR4蛋白表达水平。取大鼠肾组织,加入组织裂解液后匀浆,离心后分离出上清液并,完成电泳后转移至聚偏二氟乙烯(Polyvinylidene fluoride,PVDF)膜,在4℃的环境下应用脱脂干奶(5%)封闭保存60 min, 然后经TLR2、 TLR4(1∶1 000稀释)抗体及山羊抗兔二抗(1∶2 000稀释)孵育,采用化学发光试剂盒在凝胶成像仪中成像,以G3PDH作为内参,使用ImageJ软件进行条带定量分析。
2 结果
2.1 各组大鼠空腹血糖水平及尿蛋白含量比较与空白对照组比较,各造模组血糖和尿蛋白含量均显著升高(P<0.05);与模型组比较,糖肾灌肠、缬沙坦干预组与缬沙坦+糖肾灌肠方干预组的血糖降低但差异无统计学意义(P>0.05),糖肾灌肠方干预组、缬沙坦片干预组及缬沙坦+糖肾灌肠方干预组的尿蛋白含量下降(P<0.05),且缬沙坦+糖肾灌肠方干预组的尿蛋白含量显著下降(P<0.05)。见表1。
表1 各组大鼠血糖、尿蛋白含量比较
2.2 各组大鼠肾组织病理学检查结果比较与空白对照组比,模型组肾组织病变显著,如肾小管扩张、纤维化、炎性细胞浸润及坏死细胞脱落;与模型组比较,糖肾灌肠干预方组和缬沙坦片干预组的大鼠肾小管扩张程度、炎性细胞浸润及坏死细胞脱落情况有所减轻。缬沙坦+糖肾灌肠方干预组的大鼠肾小管基本无扩张,仅有少量炎性细胞浸润及坏死细胞脱落,肾脏结构接近空白对照组。见图3。

(HE,×100) (HE,×200)
2.3 各组大鼠血清及粪便BUN、Cr含量比较与空白对照组比较,模型组血清Cr含量、粪便Cr含量、血清BUN含量及血/粪BUN比值显著升高(P<0.05);与模型组比较,糖肾灌肠方干预组、缬沙坦干预组及缬沙坦+糖肾灌肠方干预组的血清Cr含量、粪便Cr含量、血清BUN含量及血/粪BUN比值下降(P<0.05)。见表2,图4。
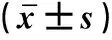
表2 各组大鼠血清及粪便BUN、Cr含量及比值比较

注:1,空白对照组;2,模型组;3,糖肾灌肠方干预组;4,缬沙坦干预组;5,缬沙坦+糖肾灌肠方干预组。
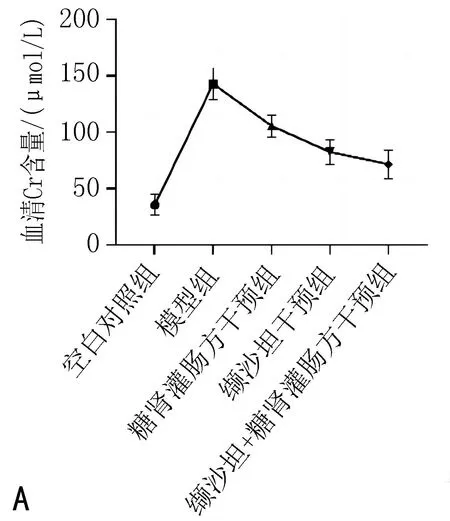
注:与空白对照组比较, *P<0.05; 与模型组比较, #P<0.05; 与糖肾灌肠方干预组比较, $P<0.05; 与缬沙坦干预组比较, &P<0.05。
2.4 各组大鼠肾湿质量及肾脏肥大指数比较与空白对照组比较,模型组的肾湿质量及肾肥大指数显著增加(P<0.05);与模型组比较,糖肾灌肠方干预组、缬沙坦干预组及缬沙坦+糖肾灌肠方干预组的肾湿质量及肾肥大指数降低(P<0.05),且缬沙坦+糖肾灌肠方干预组的肾湿质量及肾肥大指数明显低于糖肾灌肠方干预组、缬沙坦干预组(P<0.05)。见表3。
表3 各组大鼠肾湿质量及肾肥大指数比较
2.5 各组大鼠TLR2mRNA、TLR4mRNA、TLR2蛋白、TLR4蛋白表达水平比较与空白对照组比较,模型组TLR2mRNA、TLR4mRNA、TLR2蛋白、TLR4蛋白表达均显著上升(P<0.05);与模型组比较,糖肾灌肠方干预组、缬沙坦干预组以及缬沙坦+糖肾灌肠方干预组的TLR2mRNA、TLR4mRNA、TLR2蛋白、TLR4蛋白表达均下降(P<0.05)。见表4、图4。
表4 各组大鼠TLR2mRNA、TLR4mRNA、TLR2蛋白、TLR4蛋白表达水平比较
3 讨论
2型糖尿病肾病是由糖尿病所引发的一类临床常见肾脏疾病,以少尿、蛋白尿、血肌酐上升等为肾脏受损典型症状,其发生发展与遗传、肾脏血流动力学变化、糖代谢异常、血压升高等多种因素密切相关[3-6]。糖肾灌肠方为临床上治疗2型糖尿病肾病的一种中医特色疗法,以生大黄、丹参、泽泻、黄芩等药物为主要成分。相关研究表明,大黄不仅可以有效降低2型糖尿病肾病大鼠的血清尿素、肌酐水平,明显改善肾脏的病变组织,还能够对2型糖尿病肾病肾脏肥大及系膜细胞的增殖发挥抑制作用,从而对肾脏进行有效保护[7-8]。大量研究表明,采用中药灌肠方式治疗2型糖尿病肾病,既能有效降低患者的血清尿素、肌酐水平,又能抑制病情的进一步发展。另有研究发现,中药液在肠腔存留的时间越久,则血清肌酐水平下降越显著,对肾功能的改善作用也愈加明显[9-12]。有研究表明缬沙坦可以通过扩张血管来缓解肾小球的高滤过状态,从而使患者的蛋白尿情况得到有效改善。此外,缬沙坦还可以促进肾血流对局部炎症的代谢,从而降低机体的炎性反应,并尽量减少炎症反应对肾功能的损伤[13-15]。
2型糖尿病肾病患者的肾小球细胞受到损伤,会引起肾小球滤过功能下降,从而引发尿量减少及尿蛋白升高等病理性改变;BUN、Cr主要通过肾脏排泄[16-17]。当机体肾功能减退、肾小球滤过能力减弱时,血清中的BUN、Cr含量会明显升高。因此,BUN、Cr可被视为肾脏实质损害的重要标志物,对于临床评估肾功能意义重大。Toll样受体为一类蛋白质分子,其能参与机体非特异性免疫应答并促进炎症因子的合成及分泌[18]。研究表明,与健康人群比较,2型糖尿病肾病患者的血清TLR2、TLR4水平明显升高,提示TLR2、TLR4在2型糖尿病肾病疾病进展中发挥重要作用[19]。有研究表明TLR2、TLR4为Toll样蛋白受体家族中的重要成员,能够促进炎性因子释放,从而激活炎症信号路径,诱导肾小管间质纤维化,使肾小球发生硬化,进而引发肾功能障碍[20]。
本研究发现,与模型组比较,糖肾灌肠干预组、缬沙坦干预组与缬沙坦+糖肾灌肠方干预组的血糖降低,尿蛋白含量下降,且缬沙坦+糖肾灌肠方干预组的尿蛋白含量显著下降,糖肾灌肠干预方组和缬沙坦片干预组的大鼠肾小管扩张程度、炎性细胞浸润及坏死细胞脱落情况有所减轻;缬沙坦+糖肾灌肠方干预组的大鼠肾小管基本无扩张,仅有少量炎性细胞浸润及坏死细胞脱落,肾脏结构更接近于空白对照组。提示糖肾灌肠方干预组、缬沙坦干预组以及联合干预组在血糖、尿蛋白以及肾组织病理改变上的改善,表明这些干预措施对糖尿病肾病具有治疗作用。其中,联合干预的效果更佳,说明两种药物可能具有协同作用。
本研究发现,与空白对照组比较,各造模组的TLR2、TLR4蛋白及mRNA表达水平均明显升高。结果提示,2型糖尿病肾病大鼠模型的炎症反应较为明显。与模型组比较,糖肾灌肠、缬沙坦干预组与缬沙坦+糖肾灌肠方干预组的血清Cr含量、粪便Cr含量、血清BUN含量、血/粪BUN比值、肾湿重、肾肥大指数、TLR2mRNA、TLR4mRNA、TLR2蛋白及TLR4蛋白表达均降低,且缬沙坦+糖肾灌肠方干预组的降幅最大,证实了药物干预对糖尿病肾病大鼠肾功能和炎症反应的改善作用。且糖肾灌肠方和缬沙坦在抑制炎症反应方面具有协同作用。原因为糖肾灌肠方中的生大黄、丹参等成分具有显著的抗炎和抗氧化作用,可以抑制炎症因子的合成及分泌。缬沙坦则能够通过抑制肾素-血管紧张素系统来缓解肾小球的高滤过状态,从而改善机体的炎症反应。二者的联合应用不仅在改善肾功能方面表现出更好的效果,还在抑制肾脏组织的TLR2、TLR4蛋白及mRNA的表达方面具有协同作用。这一发现对于2型糖尿病肾病的治疗具有重要的意义。通过抑制TLR2、TLR4的表达,可以进一步抑制炎症反应,从而减轻肾组织损伤,改善肾功能。此外,这种联合用药的方法还可以为2型糖尿病肾病的临床治疗提供新的思路和方法。
综上,糖肾灌肠方联合缬沙坦治疗2型糖尿病肾病效果更佳,并能抑制大鼠肾脏组织TLR2、TLR4表达,值得在临床上推广应用。

