阻塞性睡眠呼吸暂停和前列腺癌发生风险:一项队列研究的Meta分析
张凯歌, 卜 珂, 姚 淼, 安恒庆
(新疆医科大学1第一附属医院, 乌鲁木齐 830054; 2公共卫生学院, 乌鲁木齐 830017)
阻塞性睡眠呼吸暂停(OSA)的特征是在睡眠期间咽部气道反复塌陷,主要特征是低通气和呼吸暂停[1]。过去20年,OSA的全球患病率大幅度增加,近10亿人受到影响[2],相关研究显示未经治疗的OSA与心血管疾病、糖尿病、认知功能障碍和早期死亡有关[3-5]。近年来有证据表明OSA增加了癌症的发病率和死亡率[6],其原因可能是OSA引起的间歇性低氧和睡眠破碎[7],它们可能促进多个信号体和转录因子的变化,从而促进血管生成、改变肿瘤微环境、破坏免疫监视,进而加速肿瘤的增殖、侵袭、外渗和转移[8-10]。
前列腺癌是男性最常见的癌症之一,全球相关死亡人数每年超过35万人,是男性癌症死亡的主要原因之一[11]。因此,识别潜在的可改变的风险和预后因素,对于前列腺癌的早期诊断和干预具有重要意义。有研究表明[12-13]OSA和前列腺癌、结肠癌、乳腺癌、甲状腺癌、肺癌之间存在潜在的相互作用,主要原因与间歇性低氧和睡眠破碎有关。然而,OSA是否与前列腺癌的高风险独立相关仍不清楚。Sillah等[14]的队列研究数据表明,OSA与前列腺癌风险之间没有联系,但Fang等[15]的队列数据研究显示睡眠障碍患者患前列腺癌的风险是对照组的3.6倍,两项研究都采用队列研究而关联结果却展现出不一致性。目前,有的Meta分析仅评估了OSA与总体癌症发病率的关联[14-17],但不同的癌症类型间差异明显,未见OSA与前列腺癌相关性的研究[18-19]。基于此,本文进行一项队列研究的Meta分析,明确OSA是否为前列腺癌临床结局产生不利影响的潜在风险因素和预后因素,现报道如下。
1 资料与方法
本研究遵循Cochrane′s Handbook中观察性研究的Meta分析,设计和报告这项研究。该研究已在PROSPERO平台完成注册(CRD42023389459)。
1.1 数据库检索由2名评价员独立全面的检索了PubMed、EMBase、Web of Science、The Corchrane Library、中国知网(CNKI)、中国生物医学文献(CBM)、万方(Wanfang)数据库,再根据已发表文献中的参考文献追溯进行手工检索,检索年限均自建库至2023年12月。中文主题词由中国生物医学文献服务系统确定,英文主题词由Pubmed数据库Mesh检索确定。中文检索主题词包括:癌症、前列腺癌、前列腺肿瘤、睡眠呼吸暂停、睡眠障碍、睡眠呼吸暂停综合症、发病风险、队列研究;英文检索主题词包括:prostate cancer、prostate neoplasm、OSA、sleep apnea、obstructive sleep apnea、obstructive sleep apnea-hypopnea syndrom、incidence、risk、cohort。本研究对出版物的类型或语言没有任何限制,为了找到更多符合条件的研究,还进行了人工搜索登记研究的参考文献。
1.2 研究选择基于标题和摘要进行筛选,最后通过查看全文获得合格的研究。纳入标准:(1)队列研究;(2)纳入基线无前列腺癌的男性;(3)根据呼吸暂停指数(AHI)、呼吸紊乱指数(RDI)或OSA的临床诊断(如国际疾病分类(ICD)诊断代码)作为OSA的诊断标准;(4)报告了睡眠呼吸暂停与前列腺癌发病率的关系,并与无OSA的对照组患者进行比较;(5)报告了调整后的危险比(Hazard Ratio,HR)和95%置信区间(CI)。排除标准:(1)病例报告、摘要、综述、会议文章等;(2)未能提供完整资料、文献中未提供或经过计算无法得出相关指标;(3)重复发表文献。
1.3 数据提取与质量评价数据提取和研究质量评估是根据预定义的纳入标准独立进行。以下数据被提取到标准化电子表格模板中:作者姓氏;出版年份;国家;研究设计;总样本量;男性平均年龄和基线人数、研究队列中的癌症总数;随访时间;OSA诊断方法;混杂因素调整。每项研究采用Newcastle-Ottawa队列研究质量评估量表[20]对纳入研究的质量进行评估。
1.4 统计学分析采用HR来衡量OSA与前列腺癌发病率之间的纵向关联,HR和95%CI在分析前进行对数转换。纳入研究之间的异质性采用Q检验进行统计分析(检验水准为α=0.10),同时结合I2统计量来判断异质性大小,显著性水平设为P<0.05。当I2值>50%时,认为研究间存在较大的异质性,采用随机效应模型计算总RR和95%CI;反之则采用固定效应模型。对于具有显著异质性的结果再进行亚组分析,包括基线男性年龄、研究设计、OSA诊断方法、队列随访时间、肥胖调整、研究地区,进一步寻找异质性的来源。通过评估漏斗图的对称性来评估潜在的发表偏倚。所有数据均使用RevMan5.4软件进行分析,P<0.05为差异具有统计学意义。
2 结果
2.1 文献检索初检共获得相关文献2 165篇,排除了553篇重复结果,通过标题和摘要的筛选排除了1 555篇文章。随后,详细阅读56篇全文,经逐层筛选后,最终纳入7篇文章[14-15,21-25]。文献筛选流程见图1。
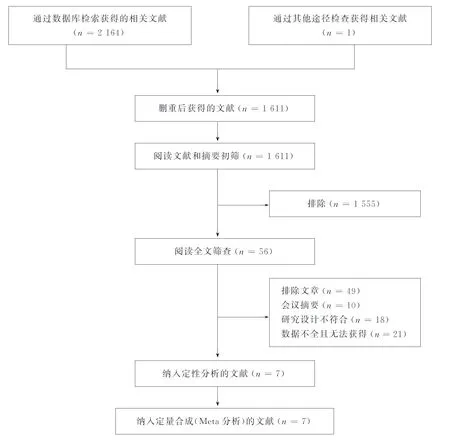
图1 文献筛选流程图
2.2 研究特征和质量评价本研究共纳入7项队列研究,由3 219 540名男性参与者组成。纳入研究的基本特征见表1。7项研究均为队列研究,在2015-2022年间发表。其中有4项研究在美国[14,21-22,25],1项在加拿大[23],1项在中国[15],1项在韩国进行[24]。4项研究是靠国际疾病分类(ICD)代码来诊断OSA[21-22,24-25],3项研究是基于多导睡眠图的临床评估来诊断OSA[14-15,23]。中位随访时间为3.2~11年。所有研究均调整了协变量,大多数研究调整了年龄和肥胖,而收入、地区、种族、吸烟、体质指数在纳入的研究中也进行了不同程度的调整。入选研究的NOS范围为6~8分(表2),表明入选研究的质量较好。
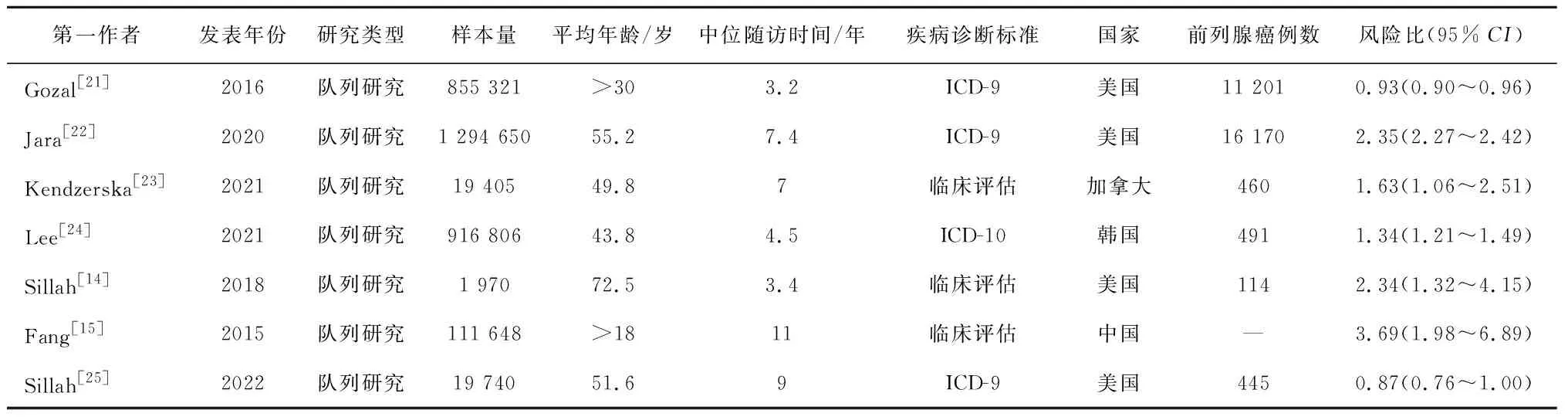
表1 纳入研究的基本特征
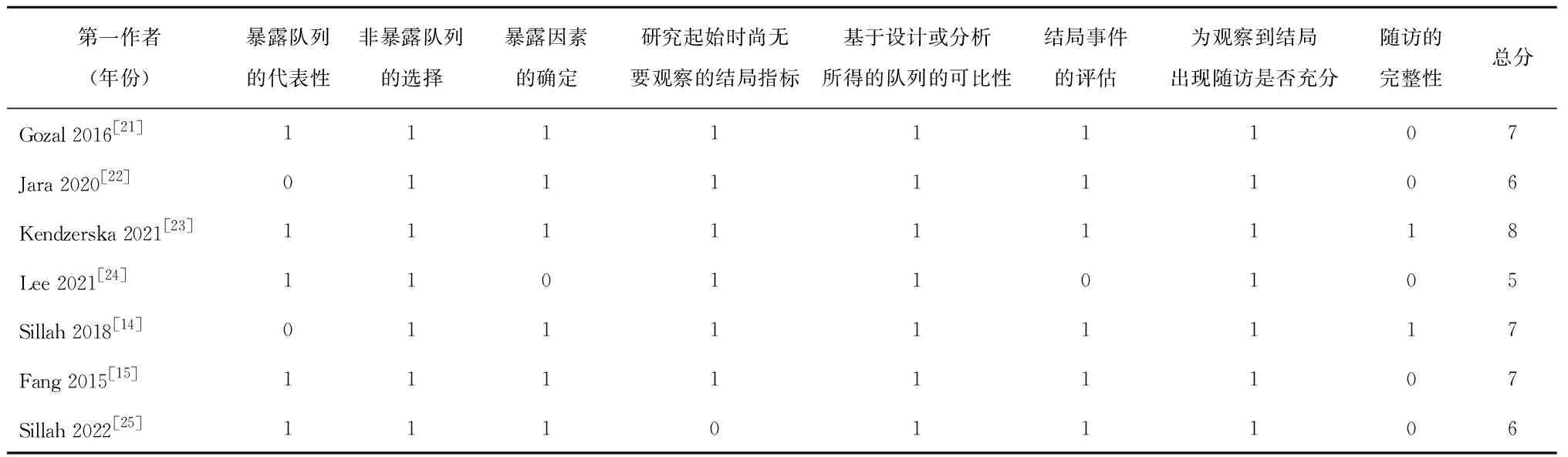
表2 通过纽卡斯尔-渥太华量表进行质量评价的详细信息
2.3 Meta分析结果本研究纳入的7项队列研究中观察到显著的异质性(Cochrane′sQ检验P<0.001,I2=99%)。因此采用随机效应模型进行合并分析,合并后的效应量(HR:1.61,95%CI:1.02~2.53),且具有统计学意义(Z=2.05,P<0.05),说明诊断为OSA的男性患者前列腺癌的发病率是未诊断为OSA男性患者的1.61倍。本研究共纳入7个队列研究,排除任意一个研究,剩余研究的合并结果都具有统计学意义,与Meta分析结果一致。提示:纳入研究合并后,具有比较稳健的结果,说明Meta分析结果具有较好的稳定性。亚组分析结果表明,与非老年男性相比(调整HR:1.15,95%CI:1.32~1.72,P<0.01),患有OSA的老年男性的前列腺癌风险显著增加(调整HR:2.57,95%CI:2.18~3.03,P<0.01);且亚组内无异质性(I2=0,P>0.1)。各亚组间效应量差异有统计学意义(I2=95.9%,P<0.1),说明年龄差异可能是产生异质性的潜在原因。而其他亚组研究,如OSA诊断方法、调整肥胖变量、队列的随访时间以及不同地区均未发现OSA和前列腺癌发病率之间的显著相关性(图2~4)。
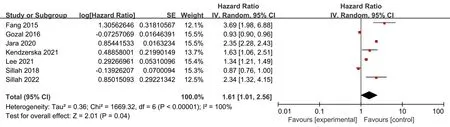
图2 OSA与前列腺癌症发病关系的Meta分析森林图
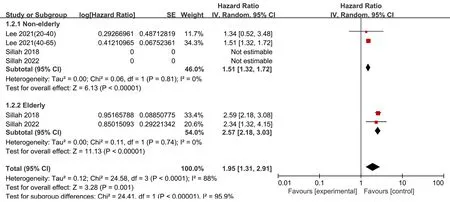
图3 基于基线年龄的亚组分析结果的Meta分析森林图
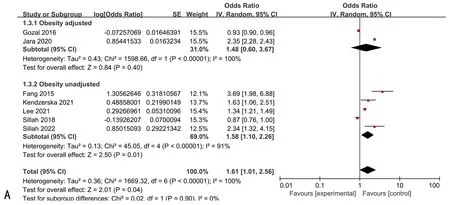
注:(A)是否调整肥胖变量的亚组分析结果森林图;(B)随访时间为5年的亚组分析结果森林图;(C)不同地区的亚组分析结果森林图。
2.4 发表偏倚运用RevMan 5.4绘制漏斗图直观评估相关性研究的发表偏倚,部分圆点分布在漏斗图边缘,但总体分布呈中线两侧大致对称,提示无明显的发表偏倚,见图5。
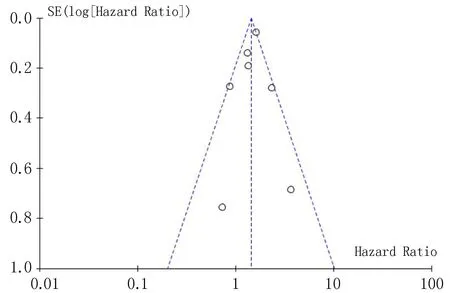
图5 OSA与前列腺癌症相关性Meta分析的漏斗图
3 讨论
在这项包含7项研究,超过320万名患者的联合队列的Meta分析中,对关键混杂因素进行了多重调整后,我们发现阻塞性睡眠呼吸暂停患者有更高患前列腺癌的风险,这种效应在老年男性中更为显著。
OSA与前列腺癌之间的相关性目前尚不清楚,但此前的研究也提出一些假设来解释相关性。OSA导致的间歇性缺氧会引起肿瘤标志物的上调从而影响前列腺癌的发展[26],已证实缺氧会导致缺氧诱导因子-1(HIF-1)的激活[27],缺氧和HIF可通过激活代谢基因或致癌基因诱导肿瘤发生[28],调节参与血管生成、糖酵解代谢、参与肿瘤的发生和发展[26,29]。另外,缺氧可上调程序性细胞死亡受体1(PD-1)及其配体(PD-L1)的表达,这种机制在前列腺癌的发展中发挥重要作用[28,30]。PD-L1和PD-1分别在单核细胞和CD8+ T细胞中过表达,且与OSA有较强依赖性[31]。此外,缺氧增加了生长因子的分泌,激活基质中更多的细胞,促进肿瘤生长。低氧对肿瘤和相关基质细胞进行重组,增强了肿瘤的转移潜能。间歇性缺氧和睡眠破碎诱导肿瘤相关巨噬细胞极性向M2表型转移以及在肿瘤内的浸润增加可能促进了肿瘤进展的加速[32],并且可以促进交感神经系统的激活,加强对肿瘤部位β-肾上腺素能受体的刺激,从而促进肿瘤细胞增殖、血管生成,同时引起全身炎症反应和免疫失调,进而促进癌变[6,33]。未来这些理论可能在相关的前列腺癌生物学模型中得到证实,相关参与的分子机制和信号通路也需进一步深入研究。
因为观察到较大的异质性,我们进行了一系列探索性的亚组分析,老年OSA男性患者亚组对于OSA与前列腺癌发病率之间表现出更强的相关性,而在进一步的亚组分析中,调整肥胖变量、队列随访时间和不同地区均未发现OSA和前列腺癌发病率之间的显著相关性。如果OSA是前列腺癌独立的危险因素,这些研究证据可能还不够充分,虽然有证据表明肥胖与晚期和致命的前列腺癌之间存在关联,但与前列腺癌发病率的关联目前仍不确定[34-35],因此需要更多的研究来确定肥胖的混杂效应。以5年的随访时间为截点并未发现差异,未来的研究应该考虑实施更长的随访时间去确定OSA和前列腺癌之间更清晰的流行病学联系。前列腺癌全球发病率较高地区在北美和西欧,但亚洲地区前列腺癌发病率也呈上升趋势[36-37],由于亚洲地区样本数据的缺乏,亚组分析的结果不能具备良好的代表性。
本Meta分析中纳入超过320万人患者的大型队列,并且只纳入了进行多变量分析的队列研究,这使得结果更加具有可信度。鉴于前列腺癌发病率的逐年升高和治疗的复杂性,预防显得尤为重要,因此本研究显示加强OSA男性患者的前列腺癌监测可能会对肿瘤的预防有一定的临床意义。
本研究的局限性:第一,虽然只纳入了进行多变量分析的研究,但是残留的干扰混杂因素可能仍然存在,例如家族史、种族和遗传综合征与前列腺癌相关的危险因素,尽管它们与OSA之间的关系尚不清楚[37]。第二,研究中没有评估OSA的严重程度分级,因此无法探究不同程度OSA患者的前列腺癌发生率之间的差异。第三,我们只纳入了观察性研究,因此无法确切地得出OSA与前列腺癌发生风险的因果论证。第四,由于缺乏原始数据,我们没有对前列腺癌具体不同的病理分级和临床分期进行亚组分析。另外,年龄增大是前列腺癌和OSA的共同危险因素,不能在研究中排除年龄这一混杂因素。
综上,本Meta分析显示出OSA可能是前列腺癌的危险因素。未来的研究应该探讨OSA对不同分级、年龄差异的前列腺癌患者发病率、病死率和预后的影响,并且加强在OSA患者中进行前列腺癌的早期筛查是有意义的。

