寒喘祖帕单煎配方与配伍合煎对16HBE细胞抗炎活性及非靶向代谢组学差异的研究
曹万萍, 李新霞,2, 李乔乔, 马雪红,4,闫 冬,4
(1新疆医科大学药学院; 2新疆天然药物活性组分与释药技术重点实验室, 乌鲁木齐 830017;3西安高新医院药剂科, 西安 710075; 4新疆医科大学实验室与设备管理处, 乌鲁木齐 830017)
寒喘祖帕颗粒是寒喘祖帕散的中药复方制剂,出自经典医著《如意处方》,主要由小茴香、芹菜子、神香草、玫瑰花、芸香草、胡芦巴、铁线蕨、甘草浸膏、荨麻子9味药材组成,具有化痰平喘、润肺止咳的功效,在临床上用于急性感冒,寒性所致的咳嗽及哮喘的治疗[1]。现代医学研究表明,寒喘祖帕颗粒在联合用药发挥抗炎活性改善肺功能方面优于常规疗法[2-4]。传统中药饮片配伍合煎是以充分发挥方药多种成分的综合疗效达到中医辨证施治效果,但该方法需浸泡煎煮,药物煎煮器具或方式选择不当可产生降低药效甚至中毒等不良后果,在一定程度上限制了传统中药的应用[5-6]。中药单煎配方颗粒是将单味中药饮片加工提取后浓缩干燥制粒,临床可直接配方应用的颗粒状中药,具有便于储存、服用方便、免煎煮及配伍灵活的优点[7-10]。由于单煎配方缺少传统组方中药物“共煎”的过程,缺少复方药物中有效成分的相互作用规律,会使一些成分的含量发生变化[11-12]。目前临床使用的中药单煎配方尚无统一的国家标准,质量评价体系尚不完善,导致同品种中药单煎配方颗粒在临床应用过程中的疗效存在差异[13]。寒喘祖帕颗粒被证明在改善哮喘患者的肺功能和减少气道炎症方面发挥着重要作用[14-15]。本研究采用细胞炎症模型考察寒喘祖帕传统配伍合煎与单煎配方的抗炎活性差异,现报道如下。
1 材料
1.1 试药甘草浸膏(批号20191204)、玫瑰花(批号 20191009-104)、葫芦巴(批号 20191025-111)、芹菜子(批号 20191001-113)、神香草(批号 20190802-095)、铁线蕨(批号 20190925-098)、荨麻子(批号 20201229-001)、芸香草(批号 20200617-026)、小茴香(批号20190814-106),药材均购自新奇康药业股份有限公司。亮氨酸-脑啡肽(美国 Waters 公司),甲酸钠(美国 Sigma 公司),乙腈(LC-MS,美国 Fisher 公司),甲酸(上海麦克林生化科技有限公司),纯化水(屈臣氏有限公司),地塞米松磷酸钠(遂成药业股份有限公司),LPS(奥默生物技术有限公司)。
1.2 仪器Xevo G2-XSQ-TOF型四极杆飞行时间质谱仪(美国Waters公司);ACQUITY UPLC BEHC18(100 mm×2.1 mm,1.7 μm)色谱柱(美国 Waters 公司);Heracell型CO2细胞培养箱(美国Thermo Scientific公司);Qu-antStudio型实时荧光定量PCR仪(美国Thermo Fisher公司);Multiskan型GO全自动酶标仪(美国Thermo Scientific公司)。
1.3 细胞人支气管上皮细胞(16HBE细胞),购自武汉普诺赛生命科技有限公司。
2 方法
2.1 样品的制备寒喘祖帕配伍合煎:分别称取神香草(75 g)、铁线蕨(75 g)、甘草浸膏(70 g)、小茴香(125 g)、 芹菜子(125 g)、 葫芦巴(75 g)、 芸香草(75 g)、玫瑰花(75 g)、荨麻子(70 g),加入8倍量的水煎煮3次,每次1.5 h,合并煎液,滤过,滤液浓缩至相对密度为 1.32~1.35 g/cm3(60℃)的浸膏,真空干燥。寒喘祖帕单煎配方:除甘草浸膏外,分别称取其他8味药材各40 g,煎煮方法与配伍合煎一致,得到8种药材提取物,常温阴凉处储藏;将9种药材提取物按寒喘祖帕颗粒配方比例混匀,备用。
2.2 16HBE细胞炎症模型的建立将16HBE细胞按1×105个/孔的密度接种到6孔板中,贴壁24 h后将培养基更换为无血清 DMEM饥饿24 h,采用0.1 μg/mL的LPS刺激48 h,以RT-PCR检测炎症因子的表达,建立细胞胞炎症模型。
2.3 寒喘祖帕配伍合煎和单煎配方对LPS诱导的16HBE细胞存活率的影响将16HBE细胞按5×104个/孔的密度接种到96孔板中,分为空白组(培养基)、正常组(16HBE细胞+培养基)、模型组(16HBE细胞+培养基+0.1 μg/mL LPS)、LPS诱导后加入不同浓度单煎配方(12.5、25、50、100、200、400、800 μg/mL)和配伍合煎(12.5、25、50、100、200、400、800 μg/mL)处理的细胞为各剂量单煎配方组和配伍合煎组。将接种细胞培养24 h后向模型组、单煎配方组配伍合煎组中加入0.1 μg/mL的LPS作用48 h,诱导炎症损伤,构建细胞炎症模型,随后将各剂量单煎配方组和配伍合煎组更换含不同浓度单煎配方和配伍合煎的DMEM完全培养基继续培养24 h,采用CCK-8法测定各孔450 nm处OD值,计算各组细胞存活率。每组设立6个复孔,重复3次实验。细胞存活率/%=(A单煎配方组/配伍合煎组-A空白组)/(A正常组-A空白组)×100%。
2.4 不同浓度的单煎配方对LPS刺激的16HBE细胞炎症因子的表达将16HBE细胞按1×105个/孔的密度接种到6孔板中,分为正常组(16HBE细胞+培养基)、模型组(16HBE细胞+培养基+0.1 μg/mL LPS )、单煎配方低剂量组(16HBE细胞+培养基+0.1 μg/mL LPS+50μg/mL单煎配方)、单煎配方高剂量组(16HBE细胞+培养基+0.1 μg/mL LPS+100 μg/mL单煎配方)。将接种细胞培养24 h后向模型组、单煎配方组配伍合煎组中加入0.1 μg/mL的LPS作用48 h,构建细胞炎症模型,后将各剂量单煎配方组更换含不同浓度单煎配方的DMEM完全培养基继续培养24 h,进行RT-PCR检测。以Actin为内参,以2-△△Ct法计算基因的相对表达量,重复3次实验。相关引物序列见表1。

表1 引物序列信息
2.5 寒喘祖帕配伍合煎和单煎配方对LPS刺激的16HBE细胞炎症因子的表达将16HBE细胞按1×105个/孔的密度接种到6孔板中,分为正常组(16HBE细胞+培养基)、模型组(16HBE细胞+培养基+0.1 μg/mL LPS)、寒喘祖帕单煎配方组(16HBE细胞+培养基+0.1 μg/mL LPS +50 μg/mL单煎配方)、寒喘祖帕配伍合煎组(16HBE细胞+培养基+0.1 μg/mL LPS+50 μg/mL配伍合煎)。将接种细胞培养24 h后向模型组、单煎配方组配伍合煎组中加入0.1 μg/mL的LPS作用48 h,构建细胞炎症模型,后将单煎配方组和配伍合煎组更换含50 μg/mL浓度单煎配方和50 μg/mL浓度配伍合煎的DMEM完全培养基继续培养24 h,进行RT-PCR检测。以Actin为内参,2-(△△Ct)法计算IL-6、IL-8、TNF-α mRNA的相对表达量。每组3个复孔,重复3次实验。计算公式:△CT(正常组)=(CT(目的基因)- CT(内参基因))/n;2-(△△Ct)= 2[CT(目的基因)-CT(内参基因)-△CT(正常组)]。
2.6 代谢物指标的测定将16HBE细胞分为4组:正常组(16HBE细胞+培养基)、模型组(16HBE细胞+培养基+0.1 μg/mL LPS)、寒喘祖帕单煎配方组(16HBE细胞+培养基+0.1 μg/mL LPS+50 μg/mL单煎配方)、寒喘祖帕配伍合煎组(16HBE细胞+培养基+0.1 μg/mL LPS+50 μg/mL配伍合煎),将接种细胞培养24 h后向模型组、单煎配方组配伍合煎组中加入0.1 μg/mL的LPS作用48 h,构建细胞炎症模型,后将单煎配方组和配伍合煎组更换含50 μg/mL浓度单煎配方和50 μg/mL浓度配伍合煎的DMEM完全培养基继续培养24 h,后用预冷的80%乙腈裂解4组细胞后置在-80℃反复冻融3次,4℃下14 650 r/min离心10 min,取上清液氮气吹干,沉淀用100 μL的50%乙腈复溶,涡旋2 min,4℃下17 900 r/min离心10 min,取上清液置EP管中,4℃下17 900 r/min再次离心10 min;采用UPLC-Q-TOF/MS,检测条件为:(1)色谱条件:柱温:35℃;自动进样器温度:10℃;流动相:0.1%甲酸水(A)-乙腈(B);梯度洗脱程序:0~0.5 min,2%~7%B,0.5~15 min,7%~40%B,15~22 min,40%~67%B,22~25 min,67%~100%B,25~40 min,100%~2%B;流速:0.3 mL/min;进样量:5 μL;运行时间:40 min。(2)质谱条件:离子源为电喷雾离子化源(ESI),灵敏度模式下,分别采用正、负离子检测模式(ESI+、ESI-);扫描范围:50~1 200 Da;扫描时间:1 s;锥孔电压:30 V;碰撞能量(CE):6 V。测定4组样品,同步制备质量控制(Quality control,QC)样品进样分析。
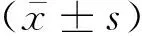
3 结果
3.1 配伍合煎及单煎配方对LPS诱导的16HBE细胞存活率的影响与正常组比较,模型组细胞存活率为(97.40±2.99)%,差异无统计学意义(P>0.05);单煎配方组在给药浓度<50 μg/mL时,细胞存活率未受到影响,差异无统计学意义(P>0.05);在给药浓度≥100 μg/mL时,细胞存活率下降,差异有统计学意义(P<0.01);配伍合煎组在给药浓度0~400 μg/mL范围时,细胞存活率未受到影响,差异无统计学意义(P>0.05),在给药浓度≥800 μg/mL时,细胞存活率下降,差异有统计学意义(P<0.05),见表2、3。
表2 不同浓度的单煎配方对LPS诱导的16HBE细胞存活率的影响

表3 不同浓度的配方合煎对LPS诱导的16HBE细胞存活率的影响
3.2 不同浓度单煎配方对LPS刺激的16HBE细胞炎症因子表达的影响与正常组比较,模型组 IL-6、IL-8、TNF-α mRNA的表达升高,差异有统计学意义(P<0.05);与模型组比较,单煎配方高、低剂量组IL-6、IL-8及TNF-α mRNA的表达均降低,差异有统计学意义(P<0.05),其中在浓度50 μg/mL时的抗炎效果强于100 μg/mL,故采用50 μg/mL浓度进行后续试验,见表4。

表4 单煎配方不同剂量对LPS诱导的16HBE细胞炎症因子的影响
3.3 寒喘祖帕配伍合煎及单煎配方对LPS刺激的16HBE细胞炎症因子表达的影响与正常组比较,模型组 IL-6、IL-8、TNF-α mRNA表达升高,差异有统计学意义(P<0.001);与模型组比较,配伍合煎组、单煎配方组、地塞米松组IL-6、IL-8、TNF-α mRNA表达均降低, 差异有统计学意义(P<0.001);与单煎配方组比较,配伍合煎组IL-6、IL-8 mRNA表达降低,差异有统计学意义(P<0.05),见图1。
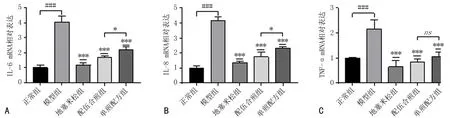
注: 与正常组比较, ###P<0.001; 与模型组比较, ***P<0.001; 与配伍合煎组比较, *P<0.05。
3.4 代谢组学分析
3.4.1 不同组间细胞代谢组学轮廓分析 比较正常组、模型组、配伍合煎组及单煎配方组细胞样本分别在质谱正、负离子模式下总离子图,各组峰型及峰面积存在一定差异,表明各组样品代谢物浓度存在一定差异,见图2。

注:A为正离子模式;B为负离子模式。
3.4.2 代谢产物的PCA分析和OPLS-DA分析 本实验的QC样本在 PCA 得分图上具有较好的集中度,表明所建方法的重复性和稳定性良好,所得差异物能反映样本之间的生物学差异。正常组与模型组各组样本点相对集中,两组之间分离良好,说明造模后,内源性代谢产物存在显著差异。对空白组和模型组进行PCA分析,显示两组在组内聚集良好,并且两组之间有明显的分离趋势,见图3。

注:正常组(a)、模型组(b)、配伍合煎组(c)、单煎配方组(d)、QC组(e)。
进一步对模型组和配伍合煎组、模型组和单煎配方组进行OPLS-DA分析,正、负离子模式下,样本间横向距离越远表明组间差异越大,纵向距离越近表明组内重复性越好,配伍合煎组和单煎配方组与模型组分布于不同象限区域内,组内样品点聚集良好,样本全部处于95%置信区间内,所得代谢组的模型参数为正常组与模型组之间ESI+:R2X=0.885;R2Y=1;Q2=0.998;ESI-:R2X=0.935;R2Y=1;Q2=0.992;模型组与配伍合煎组之间ESI+:R2X=0.919;R2Y=0.999;Q2=0.995;ESI-:R2X=0.952;R2Y=0.999;Q2=0.998;模型组与单煎配方组之间ESI+:R2X=0.929;R2Y=1;Q2=0.999;ESI-:R2X=0.931;R2Y=1;Q2=0.777,表明建立炎症模型给药后,代谢物发生显著性变化,见图4。
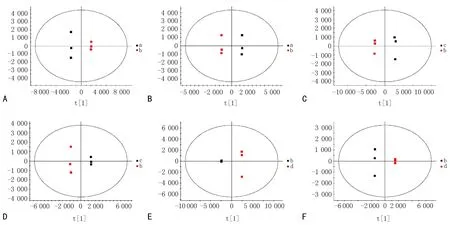
注: a为正常组, b为模型组, c为LPS+配伍合煎组, d为LPS+单煎配方组。 A为正常组和模型组的正离子图, B为正常组和模型组的负离子图, C为模型组和LPS+配伍合煎组的正离子图, D为模型组和LPS+配伍合煎组的负离子图, E为模型组和LPS+单煎配方组的正离子图, F为模型组和 LPS+单煎配方组的负离子图。
3.4.3 内源性差异代谢物的筛选 在OPLS-DA模型的基础上,以变量投影重要性(VIP)>1、P<0.05且差异倍数(fold change)≥1.5筛选内源性差异代谢物,根据潜在生物标志物色谱峰的保留时间、一级、二级质谱等信息并结合HMDB在线数据库进行鉴定,模型组与配伍合煎组间识别出内源性差异代谢物68个,见表5;模型组与单煎配方组识别出内源性差异代谢物62个,见表6。

表5 模型组与配伍合煎组内源性差异代谢物(前20名)

表6 模型组与单煎配方组内源性差异代谢物(前20名)
3.4.4 模型组与配伍合煎组、模型组与单煎配方组代谢物的代谢通路富集分析结果 分别将模型组与配伍合煎组、模型组与单煎配方组筛选得到的差异代谢物进行代谢通路富集分析,配伍合煎组主要富集到的代谢通路分别为色氨酸代谢、甘油磷脂代谢、嘧啶代谢等;单煎配方组主要富集到的代谢通路有甘油磷脂代谢、精氨酸和脯氨酸代谢、乙醚脂类等,见图5。与空白组对比,模型组中色氨酸含量降低;与模型组比较,配伍合煎和单煎制剂中色氨酸含量升高,见图6。

注: A为模型组和LPS+配伍合煎组; B为模型组和LPS+单煎配方组。

注: a为正常组; b为模型组; c为LPS+配伍合煎组; d为LPS+单煎配方组。
4 讨论
本研究通过分析配伍合煎和单煎配方寒喘祖帕对LPS诱导的炎症细胞模型的抗炎活性作用,结果表明在同样的给药浓度及给药时间条件下,配伍合煎组的细胞毒性远小于单煎配方,实验结果与传统中医药中配伍协同、增效减毒的理论一致;配伍合煎组和单煎配方组均具有降低LPS诱导的细胞炎症因子即IL-6、IL-8和TNF-α的mRNA的表达水平,但配伍合煎组降低IL-6和IL-8两个炎症因子的活性作用相比于单煎配方更加显著。
非靶向代谢组学结果显示正常组与模型组内源性差异代谢物存在显著性差异,且各组样本聚集良好,给药加寒喘祖帕干预后,配伍合煎组轮廓趋向于正常状态;代谢通路富集分析显示,配伍合煎组中主要富集到色氨酸代谢、甘油磷脂代谢、嘧啶代谢三条代谢通路,单煎配方组中主要富集到甘油磷脂代谢、精氨酸和脯氨酸代谢通路。甘油磷脂代谢和色氨酸代谢显著影响炎症细胞代谢水平,甘油磷脂是组成细胞膜的主要成分,可释放TNF-α和IL-6等炎症因子[16];文献研究表明色氨酸代谢产生的多种生物活性化合物可以调节各种生理功能[17-19],可加重或预防与炎症相关的疾病[20-22]。差异代谢物色氨酸的含量在配伍合煎组中变化显著,提示配伍合煎组可能通过上调色氨酸等相关代谢物来发挥抗炎作用。
综上,本研究采用LPS诱导16HBE细胞建立炎症细胞模型,对寒喘祖帕单煎配方与配伍合煎两种方式的抗炎活性进行了分析,结果表明两种方式的抗炎活性存在差异;代谢组学分析寒喘祖帕单煎配方与配伍合煎抗炎活性的差异可能是由于作用于不同的代谢通路。后续本研究将进一步对入细胞成分进行分析,明确寒喘祖帕抗炎活性的药效物质基础,为寒喘祖帕颗粒的进一步研究提供数据支持。

