放化疗联合贝伐珠单抗靶向治疗晚期卵巢癌患者的临床效果研究
高利波,候宪芹
(沂南县人民医院,山东 临沂 276300)
据统计,在我国女性人群中,约有半数受到妇科疾病的困扰,而子宫癌、卵巢癌作为常见的妇科肿瘤,其发病率逐年递增,并对广大女性造成了严重的威胁。在众多的妇科肿瘤疾病中,卵巢癌的致死率目前已跃居首位[1]。大多数患者在确诊后都会选择相应的治疗方案改善其临床症状,如肿瘤细胞减除术、术后铂类药物化疗等,并将其作为妇科肿瘤患者的主流治疗方案,从而有效抑制肿瘤细胞的增殖与分化,提高细胞的灭活率[2-3]。但一些病情已经发展至晚期的患者,因自身机体的耐受性不足,从而导致手术疗效不佳,再加上晚期患者的放化疗效果有限,甚至在长期接受放化疗后导致耐药性增加,使其临床效果大打折扣[4]。贝伐珠单抗是临床上常用的靶向抗体药物,随着该药物其在临床上的广泛应用,一些临床工作者发现其可对机体血管内皮因子的表达水平产生抑制作用[5]。随着晚期卵巢癌治疗临床研究工作的不断深入,放化疗与贝伐珠单抗靶向治疗联合方案应用于晚期卵巢癌患者的临床治疗中与常规放化疗对比存在哪些差异,目前还不清楚,需要进行具体的探究。
1 资料与方法
1.1 一般资料
参与此次临床研究的病例数量为50 例,均为本院肿瘤内科2020 年1 月至2022 年1 月收治的晚期卵巢癌患者,分组方式为双盲分组法,组别设定为对照组25例与研究组25 例,两组患者的临床资料分布情况见表1。
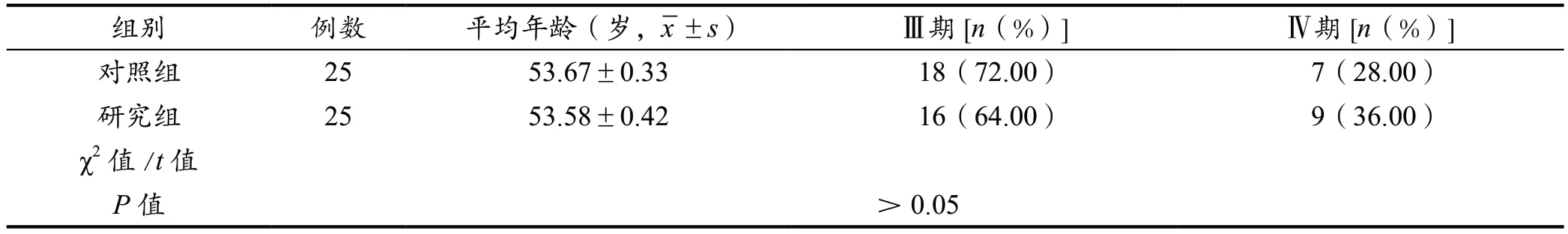
表1 两组临床资料统计情况
纳入标准:(1)经病理组织检查、影像学检查,结合《2020 年NCCN 卵巢癌临床实践指南》[6]中卵巢癌诊断依据筛选病例;(2)无严重精神、意识、认知功能及沟通障碍;(3)无严重负性情绪及自杀倾向;(4)未出现肿瘤转移;(5)详细阅读并签署知情同意书;(6)符合伦理学审核标准。
排除标准:(1)合并其他恶性肿瘤;(2)伴有精神、认知功能及沟通障碍;(3)中途退出此次临床研究者。
1.2 方法
(1)对照组。放疗:采用X 射线加速器,选择能量为6 MeV 的X 射线,以患者的横膈与骨盆中间位置为放疗区域进行照射,其间需遮挡患者的直肠、膀胱、双肾等危及器官,给予放疗剂量40 Gy/次,2 Gy/次,共照射30 次。之后将原定的照射区域缩至肿瘤区域外扩2 ~3 cm,局部剂量10 ~20 Gy/次。放疗过程中须督促患者定期检查血常规,一旦患者出现恶心、呕吐等不良反应即采取对症治疗。化疗(紫杉醇联合卡铂)所用药物为紫杉醇注射液(生产厂家:辰欣药业股份有限公司:国药准字号:H20057254;规格:5 mL∶30 mg)、卡铂注射液(生产厂家:齐鲁制药有限公司;国药准字号:H20020180;规格:10 mL∶100 mg),化疗第一天设定剂量为175 mg/m2,并将其与0.9%氯化钠注射液500 mL 混合,采取静脉滴注的方式给药,持续给药时间为3 h;而卡铂以5.0 mg/mL 的剂量进行标准治疗,给药途径为静脉滴注。疗程为3 周,初始治疗为2 个疗程,之后间隔3 周以原疗程方案治疗,共计6 个月。
(2)研究组。在对照组的基础上联合贝伐珠单抗治疗,具体方案如下:贝伐珠单抗注射液(生产厂家:齐鲁制药有限公司;批准文号:国药准字 S20190025)给药剂量设定为7.5 mg/kg,将其混合于0.9%氯化钠溶液中,采用静脉滴注的给药方式,给药频次为2 周/次,连续治疗6 个月。
1.3 观察指标
(1)疗效。以患者病灶、肿瘤标志物水平作为临床疗效的评估依据,按照其疗效差异性,进行下述的详细划分。完全缓解:原病灶消失、无新病灶生成、肿瘤标志物水平正常,上述表现持续4 周以上未改变;部分缓解:病灶面积缩小30%,甚至长达4 周未出现病灶扩散及新病灶生成;病情稳定:病灶面积缩小不足30%;进展:有新病灶生成。总有效率计算公式为(完全缓解例数+部分缓解例数+病情稳定例数)/25 例×100%。
(2)药物毒副作用。统计两组患者出现脱发、肝肾功能损伤、胃肠道反应三种毒副作用的情况。
(3)无进展生存率。分别于治疗后6 个月、9 个月、12 个月、18 个月、24 个月对所有患者进行随访,统计其无进展生存率。
(4)肿瘤标志物。检测步骤:采集患者的空腹外周静脉血3 mL,进行离心处理,将血清冷藏待测;检测指标:血管内皮生长因子(VEGF)、白介素-6(IL-6)、血清甲胎蛋白(AFP)。检测方法:VEGF、IL-6 采用酶联免疫吸附法,AFP 采用化学免疫分析法。
1.4 统计学分析
专项数据库的建立与数据的统计学处理均借助SPSS 23.0 完成;所得临床数据包括两组的临床疗效、药物毒副作用、无进展生存率及治疗前后的肿瘤标志物;计量资料用均数±标准差(±s)表示,采用t检验,计数资料用百分比(%)表示,采用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组疗效临床比较结果
据统计,对照组的总有效率为76%,研究组的总有效率为96%,数据差异有统计学意义,研究组疗效显著优于对照组(P<0.05)。见表2。
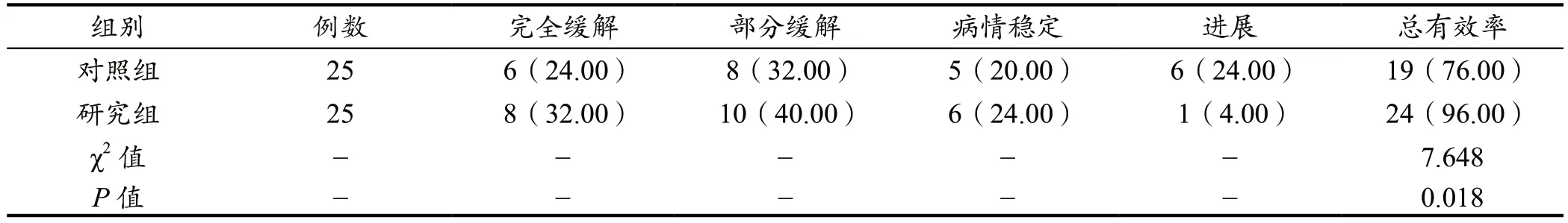
表2 两组疗效临床比较结果[n(%)]
2.2 两组药物毒副作用比较结果
据统计,对照组的药物毒副作用发生率为20%,研究组的药物毒副作用发生率为4%,数据差异有统计学意义,研究组显著低于对照组(P<0.05)。见表3。

表3 两组药物毒副作用比较结果[n(%)]
2.3 两组无进展生存率比较
研究组的无进展生存率较对照组明显提升(P<0.001)。见表4。
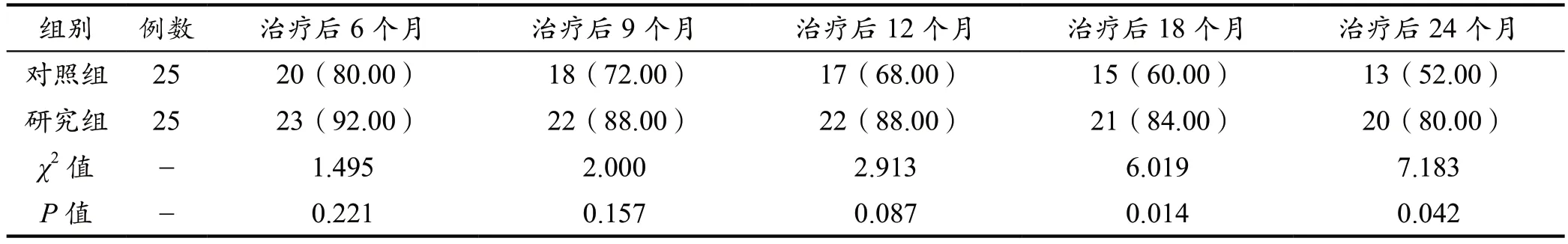
表4 两组无进展生存率比较结果[n(%)]
2.4 两组治疗前后的肿瘤标志物水平比较结果
两组治疗前的肿瘤标志物水平差异无统计学意义(P>0.05),治疗后,两组的肿瘤标志物水平有显著差异,研究组显著低于对照组(P<0.001)。见表5。
表5 两组治疗前后的肿瘤标志物水平比较结果(±s)
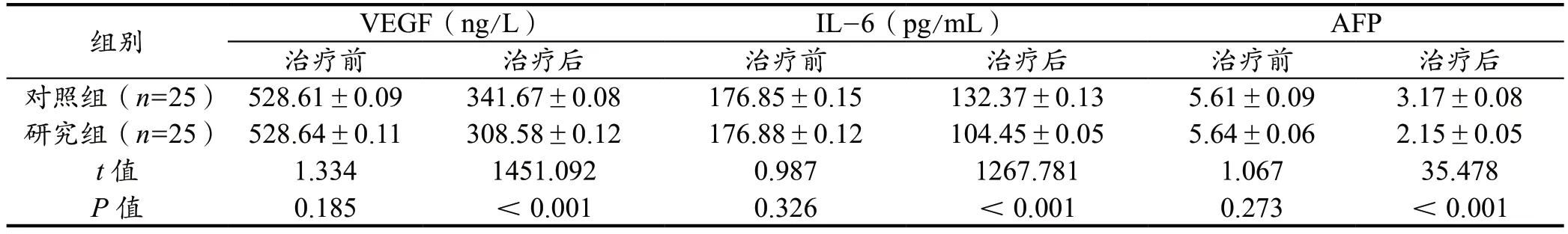
表5 两组治疗前后的肿瘤标志物水平比较结果(±s)
组别 VEGF(ng/L) IL-6(pg/mL) AFP治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组(n=25) 528.61±0.09 341.67±0.08 176.85±0.15 132.37±0.13 5.61±0.09 3.17±0.08研究组(n=25) 528.64±0.11 308.58±0.12 176.88±0.12 104.45±0.05 5.64±0.06 2.15±0.05 t 值 1.334 1451.092 0.987 1267.781 1.067 35.478 P 值 0.185 <0.001 0.326 <0.001 0.273 <0.001
3 讨论
近年来,我国妇科肿瘤疾病的高发让无数女性深感痛苦。卵巢癌作为妇科临床上一种常见的恶性肿瘤疾病,导致患者生活质量显著下降。虽然我国临床医学得到了快速发展,卵巢癌患者在及时接受手术治疗后可有效杀灭肿瘤细胞,但病灶的残留仍然是众多临床机构无法攻克的难题,因此有着较高的复发率,导致卵巢癌患者的预后效果不佳[7-8]。如何制定高效、安全的临床治疗方案引起了妇科临床工作者的广泛关注。
贝伐珠单抗作为临床上广泛应用的靶向治疗肿瘤药物,其属性为人工重组单克隆抗体,主要来源于机体的血管内皮生长因子,可选择性地结合机体的血管内皮生长因子,并对受体产生抑制作用,从而抑制血管内皮生长因子的活动,并抑制新血管的生成,对抗肿瘤的转移与侵袭[9-10]。在临床上,针对肿瘤患者的临床诊断,血管内皮生长因子是一种重要的标志物,其在机体中的含量越高,代表患者的病情越严重,肿瘤侵袭度越高,预后效果越差[11-12]。随着临床研究工作的深入,一些临床工作者也发现了贝伐珠单抗治疗可阻断血管内皮生长因子信号的传输,并促进肿瘤血管趋于正常发展,降低其耐药性,有效抑制肿瘤细胞的生成与增殖分化[13]。
通过对此次临床研究结果的分析总结得知,部分晚期卵巢癌患者在应用贝伐珠单抗联合放化疗治疗方案后,病情得到了明显控制,同时其药物的副作用发生率明显下降,无进展生存率也增加至(11.82±0.18)个月。上述各项临床指标充分肯定了贝伐珠单抗联合放化疗治疗在晚期卵巢癌患者临床治疗中的重要应用价值。
综上所述,放化疗联合贝伐珠单抗靶向治疗可作为晚期卵巢癌患者的临床推荐治疗方案,其在控制疾病进展的同时,可减轻药物的毒副作用,提升临床安全性,为广大晚期卵巢癌患者带来福音。

