植物乳杆菌发酵核桃粕制备多肽及其抗氧化活性分析
何彩玲,颜玲,刘长虹*,马爱进,郑磊
(1.合肥工业大学食品与生物工程学院,安徽合肥 230031;2.北京工商大学食品与健康学院,北京 100048)
核桃又名胡桃,是胡桃科胡桃属的落叶乔木植物,世界四大坚果之一[1]。核桃仁含有丰富的油脂、蛋白质、维生素等营养成分,具有健脑益智、抗氧化、润肠通便等功效[2]。核桃粕是核桃仁脱脂后的副产物,优质蛋白含量达到50%以上[3]。目前对核桃粕的利用大多停留在加工动物饲料和肥料上[4],只有少量的核桃粕用于生产核桃蛋白粉、蛋白乳[5]等初级产品,对于核桃粕中的优质蛋白利用尚不够充分。
通过酶解[6]或微生物发酵[7]核桃粕制备出的生物活性肽具有抗炎[8-9]、改善记忆损伤[10]、抗疲劳[11]等多种生理功能,可实现对核桃粕优质蛋白资源的充分利用。与单一的酶水解相比,微生物产生的蛋白酶多种多样,在多种酶的共同作用下,效率更高[12],发酵法制备的多肽种类更多,生物活性潜力也更大。目前的研究中对于核桃活性多肽的制备大多利用酶解法,微生物发酵法制备核桃活性肽的研究相对较少。因此,本文以核桃仁低温榨油脱脂后的核桃粕为原料,以植物乳杆菌为发酵菌株,利用单因素试验和正交试验优化植物乳杆菌发酵核桃粕制备核桃多肽的工艺条件,并通过超滤法将核桃多肽分为不同分子量多肽,对核桃多肽进行体外抗氧化活性和氨基酸组成测定,以期为微生物发酵制备核桃多肽及其功能性开发提供参考。
1 材料与方法
1.1 材料与仪器
植物乳杆菌CICC20242:中国工业微生物菌种保藏管理中心。
生核桃仁(蛋白质含量20.40%):市售,原产地新疆阿克苏地区;MRS 培养基:合肥工业大学食品与生物工程学院实验室自制;无水三氯化铁:上海麦克林生化科技有限公司;过二硫酸钾、铁氰化钾:国药集团化学试剂有限公司;邻苯三酚:上海阿拉丁生化科技股份有限公司;还原型谷胱甘肽:生工生物工程(上海)股份有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH):梯希爱(上海)化成工业发展有限公司;2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸[2,2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS]:上海源叶生物科技有限公司;三羟甲基氨基甲烷:北京索莱宝科技有限公司。以上试剂均为分析纯。
BSC-400 培养箱:上海博迅医疗生物仪器股份有限公司;HGZF-11 数显鼓风干燥箱:上海跃进医疗器械有限公司;GENESYS 10S 紫外可见分光光度计、VarioSkan Flash 酶标仪:美国赛默飞世尔科技公司;SCIENTZ-12N 真空冷冻干燥机:宁波新芝生物科技股份有限公司;URT210-C 氨基酸自动分析仪:上海紫越网络科技股份有限公司。
1.2 方法
1.2.1 工艺流程

1.2.2 核桃粕制备
1.2.2.1 核桃仁榨油制备核桃粕核桃仁低温(65 ℃)榨取油脂,再用正己烷浸泡脱脂后烘干。脱脂核桃粕粉碎过60 目筛[13]备用。
1.2.2.2 发酵菌悬液制备
植物乳杆菌活化三代,菌悬液在8 000×g、25 ℃离心10 min 后弃去上清液,使用无菌生理盐水稀释菌液至1×109CFU/mL。
1.2.2.3 核桃粕接菌液态发酵
将核桃粕与超纯水混匀,灭菌冷却后,取发酵菌种接入核桃粕溶液中,混匀后置于培养箱中30 ℃培养。
1.2.3 多肽得率测定
参考王鲁黔[14]的方法并稍作修改,以还原型谷胱甘肽为标准品,采用双缩脲法进行多肽得率的测定。
1.2.3.1 标准曲线的绘制
用5%三氯乙酸配制质量浓度为1 mg/mL 的还原型谷胱甘肽标准品。配制为不同浓度(0.05、0.10、0.30、0.50、0.70 mg/mL)标品溶液,与双缩脲反应30 min 后,在540 nm 波长下测定吸光度,以浓度为横坐标,吸光度为纵坐标绘制标准曲线。标准曲线的线性回归方程为y=0.084x+0.008 1,相关系数R2=0.996 9,标准曲线的线性关系良好。
1.2.3.2 多肽得率计算
取发酵后的核桃粕溶液,6 000×g、25 ℃离心5 min取上清液,加入等体积10% 的三氯乙酸,混匀后静置10 min。8 000×g、25 ℃离心5 min 后取1 mL 上清液,加入1 mL 5% 的三氯乙酸混匀,取1 mL 混合液于10 mL 容量瓶中,用5% 三氯乙酸稀释定容。取上述稀释定容后的发酵液6 mL 与4 mL 双缩脲试剂暗处反应30 min,在540 nm 条件下测定吸光度。多肽得率(R,g/g)计算公式如下。
式中:C为根据标准曲线计算得到的多肽浓度,mg/mL;V为核桃粕发酵液总体积,mL;N为稀释倍数;M为发酵所用核桃粕的质量,g。
1.2.4 单因素试验
1.2.4.1 发酵时间对核桃多肽得率的影响
在底物浓度5%、接种量8% 的条件下,分别考察不同发酵时间(24、48、72、96、120 h)对植物乳杆菌发酵制备核桃粕多肽得率的影响。
1.2.4.2 接种量对核桃多肽得率的影响
在底物浓度5%、发酵时间72 h 的条件下,分别考察不同接种量(2%、5%、8%、11%、14%)对植物乳杆菌发酵制备核桃粕多肽得率的影响。
1.2.4.3 底物浓度对核桃多肽得率的影响
在接种量8%、发酵时间72 h 的条件下,分别考察不同底物浓度(1%、3%、5%、7%、9%)对植物乳杆菌发酵制备核桃粕多肽得率的影响。
以上发酵过程中发酵温度根据菌种培养说明书选择植物乳杆菌最适生长温度为30 ℃。
1.2.4.4 正交试验
在单因素试验基础上,以发酵时间、接种量、底物浓度为试验因素,以多肽得率为评价指标进行核桃肽制备工艺的优化,正交试验设计见表1。
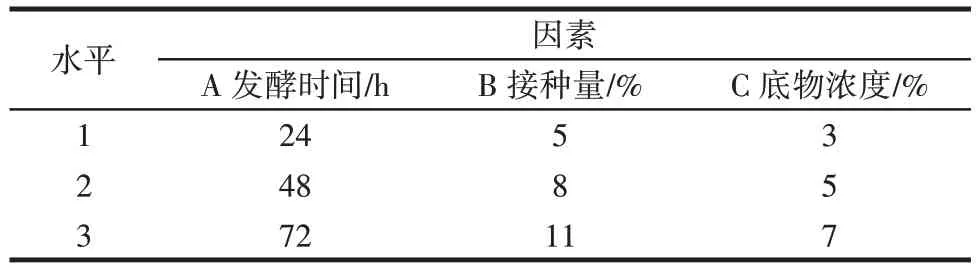
表1 正交试验设计Table 1 Orthogonal experimental design
1.2.5 发酵核桃多肽及其低分子量多肽的制备
取发酵核桃粕8 000×g、25 ℃离心10 min 后的上清液,依次通过截留分子质量为3 kDa 和10 kDa 的超滤管进行分级分离得到分子质量分别为<3 kDa、3~10 kDa 和>10 kDa 的发酵多肽液。发酵多肽液用真空冷冻干燥机进行冷冻干燥[15],于-80 ℃冰箱保存备用。
1.2.6 核桃多肽体外抗氧化活性测定
1.2.6.1 DPPH 自由基清除能力测定
参考羌宇等[16]的方法并稍作修改,准确称取未超滤的全组分、分子量<3 kDa、3~10 kDa 和>10 kDa 的多肽冻干粉,分别配制成不同浓度(0.5、1.0、1.5、2.0、3.0 mg/mL)的多肽溶液,对其进行抗氧化活性测定。
取不同浓度的多肽溶液100 µL,加入100 µL DPPH 溶液,暗处静置反应30 min,使用酶标仪在517 nm 处测定吸光度。DPPH 自由基清除率(H,%)计算公式如下。
式中:A1为样品吸光度;A2为95% 乙醇溶液代替DPPH 溶液的吸光度;A0为超纯水代替样品溶液的吸光度。
1.2.6.2 ABTS+自由基清除能力测定
取180µL ABTS 工作液,加入20µL 多肽溶液,暗处反应6 min,734 nm 波长处测定吸光度。ABTS+自由基清除率(B,%)计算公式如下。
式中:A1为样品组吸光度;A2为超纯水代替ABTS工作液的吸光度;A0为超纯水代替样品溶液的吸光度。
1.2.6.3 超氧阴离子自由基清除能力测定
参考倪庆圆[17]的方法,稍作修改。取0.05 mol/mL的三羟甲基氨基甲烷盐酸盐[tris(hydroxymethyl)aminomethane hydrochloride,Tris-HCl]溶液225µL 于25 ℃预热20 min,再加入50 µL 多肽溶液和20 µL 25 mmol/mL 的邻苯三酚,25 ℃反应5 min,迅速加入20 µL 浓盐酸终止反应,在320 nm 波长处测定吸光度。超氧阴离子自由基清除率(O,%)计算公式如下。
式中:A1为样品溶液的吸光度;A2为超纯水代替邻苯三酚的吸光度;A0为超纯水代替多肽溶液的吸光度。
1.2.6.4 总还原能力测定
参考张会翠等[18]的方法,稍加改进。向试管中加入2.5 mL pH6.8 的磷酸缓冲盐溶液(phosphate buffered saline,PBS)、1 mL 多肽溶液和2.5 mL 1% 的铁氰化钾溶液,50 ℃水浴20 min,冷却后加入2 mL 10%的三氯乙酸终止反应,8 000×g、25 ℃离心10 min 后取50µL 上清液,加入50 µL 超纯水和50 µL 0.1% 的氯化铁溶液,静置反应10 min,在700 nm 波长处测定吸光度。总还原能力(F,%)计算公式如下。
F=(A1-A0)× 100
式中:A1为样品组的吸光度;A0为超纯水代替上清液的吸光度。
1.2.7 氨基酸含量测定
氨基酸含量测定参考GB/T 5009.124—2016《食品安全国家标准食品中氨基酸的测定》[19],稍作修改。准确称取0.100 0 g 多肽粉末于蛋白水解管中,加入1.5 mL 6 mol/mL 盐酸,反复抽真空、充高纯氮气后密封,置于110 ℃数显鼓风干燥箱中水解22 h。水解结束后过滤至5 mL 水解管中,用超纯水定容至刻度线。吸取滤液于旋蒸烧瓶中旋转蒸发,再加超纯水旋转蒸发干燥,最后用pH2.2 的柠檬酸钠缓冲溶液溶解,过0.22µm 水相滤膜过滤,稀释15 倍后用氨基酸自动分析仪进行测定。
1.3 数据处理
所得数据用Excel 2019 和SPSS 软件进行处理分析,用Origin 2022 作图。每组样品做3 次平行试验。
2 结果与分析
2.1 单因素试验结果
发酵时间对多肽得率的影响如图1 所示。

图1 发酵时间对多肽得率的影响Fig.1 Effect of fermentation time on the yield of polypeptides
由图1 可知,在底物浓度为5%、接种量8%、发酵温度30 ℃的条件下,多肽得率在发酵的前48 h 明显升高,超过48 h 后,多肽得率随发酵时间的延长逐渐下降,造成这种现象的原因可能是产生的多肽被植物乳杆菌产生的酶分解为更小片段的肽或者氨基酸[20]。因此,选取发酵时间24、48、72 h 进行正交试验。
接种量对多肽得率的影响如图2 所示。
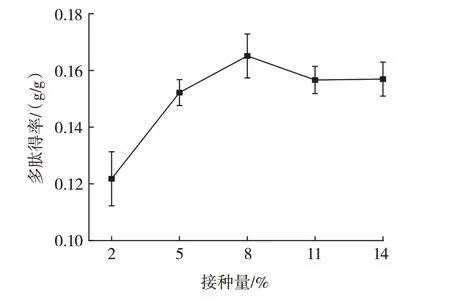
图2 接种量对多肽得率的影响Fig.2 Effect of inoculation amount on the yield of polypeptides
由图2 可知,在底物浓度5%、发酵时间72 h、发酵温度30 ℃的条件下,多肽得率随接种量的增加而逐渐增加,接种量为8% 时多肽得率最高,接种量大于8%时多肽得率开始下降。接种量过小会造成菌种生长缓慢,不能充分利用核桃蛋白产生多肽,延长发酵时间导致发酵效率较低;较高的接种量虽可以缩短发酵时间,但菌体的大量增加会引起供氧不足,影响发酵菌种产生蛋白酶,而且会产生过多代谢物不利于发酵过程。因此,选取接种量为5%、8%、11%进行正交试验。
底物浓度对多肽得率的影响如图3 所示。
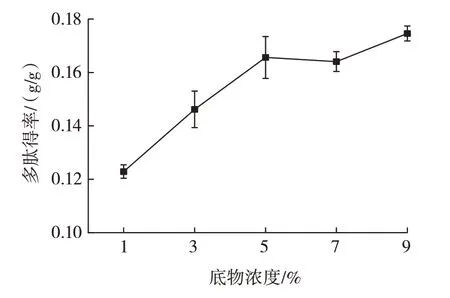
图3 底物浓度对多肽得率的影响Fig.3 Effect of substrate concentration on the yield of polypeptides
由图3 可知,在接种量8%、发酵时间72 h、发酵温度30 ℃的条件下,多肽得率随着底物浓度的升高整体呈升高趋势,底物浓度增加表明植物乳杆菌可利用的原料更多,因此多肽得率也随之上升。当底物浓度达到5%以上时,随着底物浓度的升高,多肽得率增加缓慢,考虑到底物浓度为9% 时,离心工作难度较大,也从节约原料的角度出发,选取底物浓度3%、5%、7%进行正交试验。
2.2 正交试验结果
在单因素试验基础上,以发酵时间(A)、接种量(B)、底物浓度(C)为试验因素,以多肽得率为指标,采用L9(34)正交试验探讨不同因素对核桃肽发酵制备工艺的影响。正交试验结果如表2 所示,方差分析结果如表3 所示。

表2 正交试验结果Table 2 Orthogonal test results

表3 方差分析结果Table 3 Analysis of variance results
由表2 和表3 可知,核桃肽发酵制备工艺中对多肽得率产生影响的各因素顺序为A>C>B,发酵时间为极显著性影响因素(P<0.01)。核桃肽发酵制备的最佳工艺为A2B3C3,即发酵制备核桃肽的最佳工艺条件为发酵时间48 h、植物乳杆菌接种量11%、底物浓度7%。进行4 次验证试验,平均多肽得率为0.263 0 g/g,略高于正交试验表中最高得率(0.252 3 g/g)。因此,在发酵温度为30 ℃时,最佳的发酵条件为发酵时间48 h、植物乳杆菌接种量11%和底物浓度7%。
2.3 体外抗氧化活性结果
不同分子量核桃多肽的抗氧化活性见图4。
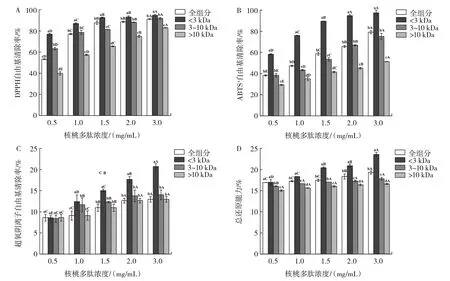
图4 不同分子量核桃多肽的抗氧化活性比较Fig.4 Comparison of antioxidant activities of walnut polypeptides with different molecular weights
由图4 可知,在核桃多肽浓度大于0.5 mg/mL 时,多肽的抗氧化活性均随着分子量的降低而逐渐增强。当质量浓度达到3.0 mg/mL 时,4 种分子量多肽的DPPH 自由基清除能力都很强,分子量<3 kDa、3~10 kDa 和全组分多肽的DPPH 自由基清除率分别达到了94.79%、91.90% 和91.25%。分子量<3 kDa 的多肽的ABTS+自由基清除能力在不同浓度下均显著高于其他3 种分子量的多肽(P<0.05),在浓度为2.0、3.0 mg/mL 时,ABTS+自由基清除率分别达到94.75%和97.42%。在浓度为0.5 mg/mL 时,4 种分子量多肽的超氧阴离子自由基清除能力无显著性差异,全组分与分子量<3 kDa 多肽的总还原能力差异不显著,但是它们与3~10 kDa、>10 kDa 多肽的总还原能力存在显著性差异(P<0.05)。当多肽浓度>1.0 mg/mL 时,分子量<3 kDa 多肽的超氧阴离子自由基清除能力和总还原能力显著升高,远超其他3 种分子量的多肽,在核桃多肽浓度为3.0 mg/mL 时,总还原能力和超氧阴离子自由基清除率分别为23.45% 和20.74%。结果表明,低分子量多肽具备更强的抗氧化活性。
2.4 多肽氨基酸组成及含量
不同分子量多肽的氨基酸组成和含量结果见表4。

表4 不同分子量多肽的氨基酸组成和含量Table 4 Amino acid composition and content of polypeptides with different molecular weights mg/g
由表4 可知,经过超滤分离的3 种不同分子量多肽和全组分多肽氨基酸种类齐全,氨基酸的组成、序列和结构与多肽的抗氧化活性密切相关[21],疏水性氨基酸可能通过增加肽在脂质中的溶解度而在脂质氧化抑制中发挥重要作用[22]。芳香族氨基酸如苯丙氨酸的存在允许电子直接转移至活性氧(reactive oxygen species,ROS),进而体现出强抗氧化活性[23]。酸性氨基酸能够螯合金属离子,组氨酸的供氢能力、诱捕超氧化物自由基及其咪唑基团的金属离子螯合能力对多肽抗氧化活性有很大贡献。<3 kDa 的多肽的抗氧化活性明显高于其他3 种分子量的多肽,一方面可能是<3 kDa的多肽含有的抗氧化氨基酸在4 种多肽组分中含量相对较高,另一方面可能是低分子量多肽的三级或四级结构较少,其中的抗氧化氨基酸基团充分暴露出来,从而增强其抗氧化活性[24]。
3 结论
以核桃粕为原料,植物乳杆菌为发酵菌种,采用液态发酵方式,以多肽得率为指标,通过单因素和正交试验,确定植物乳杆菌发酵核桃粕制备多肽的最佳发酵条件为发酵时间48 h、接种量11%和底物浓度7%,在此条件下多肽得率为0.263 0 g/g。抗氧化活性测定结果表明,随着多肽分子量的降低其抗氧化活性逐渐增强。在核桃多肽浓度大于0.5 mg/mL 时,分子量<3 kDa 的多肽的DPPH 自由基、ABTS+自由基、超氧阴离子自由基清除率和总还原能力均显著高于其他3 种。氨基酸分析结果表明,4 种多肽组分的氨基酸种类齐全,<3 kDa 多肽的疏水性、酸性和碱性氨基酸含量均最高。植物乳杆菌发酵核桃粕制备抗氧化多肽具有很大的潜力。本研究可为核桃粕的充分利用和深入研究提供一定的参考,也为微生物发酵制备其他功能性多肽提供参考。

