J、K亚群禽白血病病毒的分离和囊膜蛋白(gp85)基因序列分析
周钊灿 , 游广炬 , 杨金易 , 苏晓娜 , 高 丽 , 王永强 , 郑世军
(1. 中国农业大学动物医学院 兽医公共卫生安全全国重点实验室 农业部动物流行病学重点实验室 , 北京 海淀 100193 ;2. 华南农业大学食品学院 , 广东 广州 510642 ; 3. 温氏食品集团股份有限公司 岭南现代农业科学与技术广东省实验室云浮分中心 , 广东 云浮 527100)
禽白血病是一种禽类免疫抑制疾病的总称,是由反转录病毒科、反转录病毒属的禽白血病病毒(Avian leukosis virus,ALV)引起的禽肿瘤性疾病,感染鸡出现多种形式的肿瘤、免疫抑制、产蛋率下降和增重缓慢,增加对其他病原的易感性,进而增加疫苗接种失败的风险,给世界养禽业带来巨大的经济损失[1]。ALV是一种有包膜的逆转录病毒,基因组大小约为7.2 kb,编码核衣壳蛋白(Nucleocapsid protein)、多聚酶蛋白(Polymerase)和糖基化包膜蛋白(Glycosylated envelope protein)等结构蛋白和酶蛋白。根据病毒囊膜env基因序列、中和特性和宿主嗜性的不同,ALV被划分成A~K 共11个亚群,其中A~E、J和K共7个亚群可感染鸡[2-3]。囊膜蛋白(gp85)是ALV的主要包膜蛋白和突变率最高的结构蛋白,可与宿主细胞膜上的特异性病毒受体特异性结合,并参与病毒中和,对ALV毒力、进入宿主细胞机制和遗传变异特性等研究有重要意义[4-5]。HPRS-103作为ALV J亚群(ALV-J)代表株,于1992年在英国首次从肉鸡中分离[6]。我国于1999年从山东某种鸡场发病鸡中首次分离到ALV-J毒株,随后,其在全国各地迅速广泛传播,占据主导地位[7-8]。2012年,在我国地方品种鸡中分离到新的ALV毒株,其gp85基因序列与已知的ALV亚群毒株同源性不高,将其划分为新亚群,即ALV-K[9-12]。有研究表明,ALV-K亚群病毒复制能力、致病性和致癌性相对较低,但容易与其他亚群ALV发生混合感染,从而加快了ALV的重组速率,也使ALV分离鉴定变得更加困难[13]。目前尚无针对禽白血病的疫苗或药物。通过执行ALV定期检测、淘汰阳性鸡的措施实现规模化养禽场的禽白血病净化是有效控制措施,目前国内部分大型养殖场已经满足净化标准。然而,ALV仍然在某些小型和地方家禽养殖场中流行[9,14-15]。本试验在2021—2022年从国内某蛋鸡场禽白血病净化蛋清p27抗原阳性鸡血浆中分离到7株ALV,其中3株为J亚群毒株,4株为K亚群毒株,对其gp85基因进行克隆和测序,并与国内外分离毒株进行比较分析,为后续研究ALV的遗传变异特征和流行趋势等提供参考依据。
1 材料与方法
1.1 主要试剂 胎牛血清(Fetal bovine serum,FBS),购自美国Gibco公司;磷酸缓冲盐溶液(Phosphate buffer saline,PBS)、DMEM(Dulbecco's modified eagle medium)高糖培养基和胰酶,均购自北京中科迈晨科技有限公司;禽白血病病毒抗原p27 ELISA检测试剂盒,购自广东标允生物科技有限公司;RNA提取试剂盒,购自上海飞捷生物技术有限公司;第一链RNA反转录试剂盒,购自北京擎科生物科技有限公司;胶回收试剂盒,购自北京美基生物科技有限公司;Trans1-T1感受态细胞,购自北京全式金生物技术有限公司;TOPO-Blunt Cloning Kit和Phanta Flash高保真酶,均购自南京诺唯赞生物科技股份有限公司;M5Taq酶,购自北京聚合美生物科技有限公司;曲拉通 X-100(TritonX-100),购自北京索莱宝科技有限公司;牛血清白蛋白(Bovine serum albumin,BSA),购自美国AMRESCO公司;FITC标记山羊抗小鼠IgG抗体,购自北京博奥森生物技术有限公司;ALV p27单克隆抗体,本实验室保存。
1.2 主要仪器 电泳成套设备和PCR仪,均为美国Bio-Rad Laboratories公司产品;凝胶成像分析系统,美国Alpha公司产品;台式电子天平,德国Sartorius AG产品;荧光倒置显微镜,日本Olympus株式会社产品;电热恒温水槽,中国恒一科技股份有限公司产品;二氧化碳培养箱,美国Thermo Fisher科技公司产品。
1.3 样品与细胞 于2021—2022年自国内某禽白血病净化鸡场蛋清ALV阳性鸡采集无菌抗凝血样本40份,鸡胚成纤维细胞(Douglas foster-1,DF-1)由本实验室保存。
1.4 病毒分离 无菌抗凝血样本于4 ℃、3 000 r/min离心3 min,吸取上清液,4 ℃、12 000 r/min离心10 min,吸取透明淡黄色血浆,过0.22 μm滤器。用含10%FBS的DMEM培养基培养DF-1 细胞至密度达30%,更换为不含FBS的DMEM培养基(加入10%青链霉素双抗),接种处理好的血浆样品,每孔100 μL,每份样品接种2个细胞孔并设立空白对照,于37 ℃、5%二氧化碳细胞培养箱中放置1 h,吸弃上清液,用含1% FBS的 DMEM 维持液培养(加入5%青链霉素双抗),37 ℃、5%二氧化碳细胞培养箱中放置 6 d,盲传2代,收取细胞上清液,用禽白血病病毒抗原p27 ELISA检测试剂盒进行检测。
1.5 病毒DNA提取和亚群鉴定 将1.4中ELISA检测结果为阳性的细胞上清液接种于DF-1细胞,未进行接种操作的细胞孔为阴性对照,用含1%FBS的DMEM维持液培养4 d,收取病毒上清液,用RNA提取试剂盒提取ALV病毒基因组RNA,用第一链RNA反转录试剂盒将提取的RNA反转录为cDNA。根据参考文献[16-17]中方法设计ALV-A、ALV-B、ALV-J和ALV-K的鉴定引物(表1),引物由生工生物工程(上海)股份有限公司合成,以提取的ALV cDNA为模板,用M5Taq酶进行PCR扩增。

表1 ALV亚群PCR鉴定所用引物信息
1.6 病毒gp85基因PCR扩增和测序 根据ALV各亚群的gp85基因及其邻近序列的保守区域,设计gp85基因PCR扩增引物(表2),以ALV cDNA为模板,用Phanta Flash高保真酶进行PCR扩增。所得PCR产物回收纯化后,按说明书将目的片段连接到TOPO-Blunt Cloning Kit载体上,转化Trans1-T1感受态细胞,接种氨苄抗性LB平板并过夜培养,挑取单菌落送往北京诺赛基因组研究公司测序。

表2 ALV gp85基因PCR扩增引物信息
1.7gp85基因序列和遗传演化分析 通过将分离毒株与NCBI数据库中已有的 ALV毒株的gp85基因进行 BLAST比对,选取与分离毒株同源性较近的ALV各亚群参考毒株(表3)。用DNASTAR Lasergene软件中MegAlign程序的Clustal W方法,对7株ALV分离毒株和ALV各亚群参考毒株的gp85基因核苷酸进行多序列比对,分析同源性,并利用DNASTAR Lasergene内的EditSeq程序将基因序列翻译为氨基酸,进行同源性分析。使用DNASTAR Lasergene软件中Protean程序的Jameson-wolf方法,预测ALV分离株gp85蛋白B细胞抗原表位,分析分离毒株gp85蛋白氨基酸突变对B细胞抗原表位的影响。使用MEGA 11软件中的邻接法(Neighbor-joining method)对ALV分离毒株gp85基因序列和ALV各亚群参考毒株进行遗传进化树分析,Bootstrap值设置为1 000。
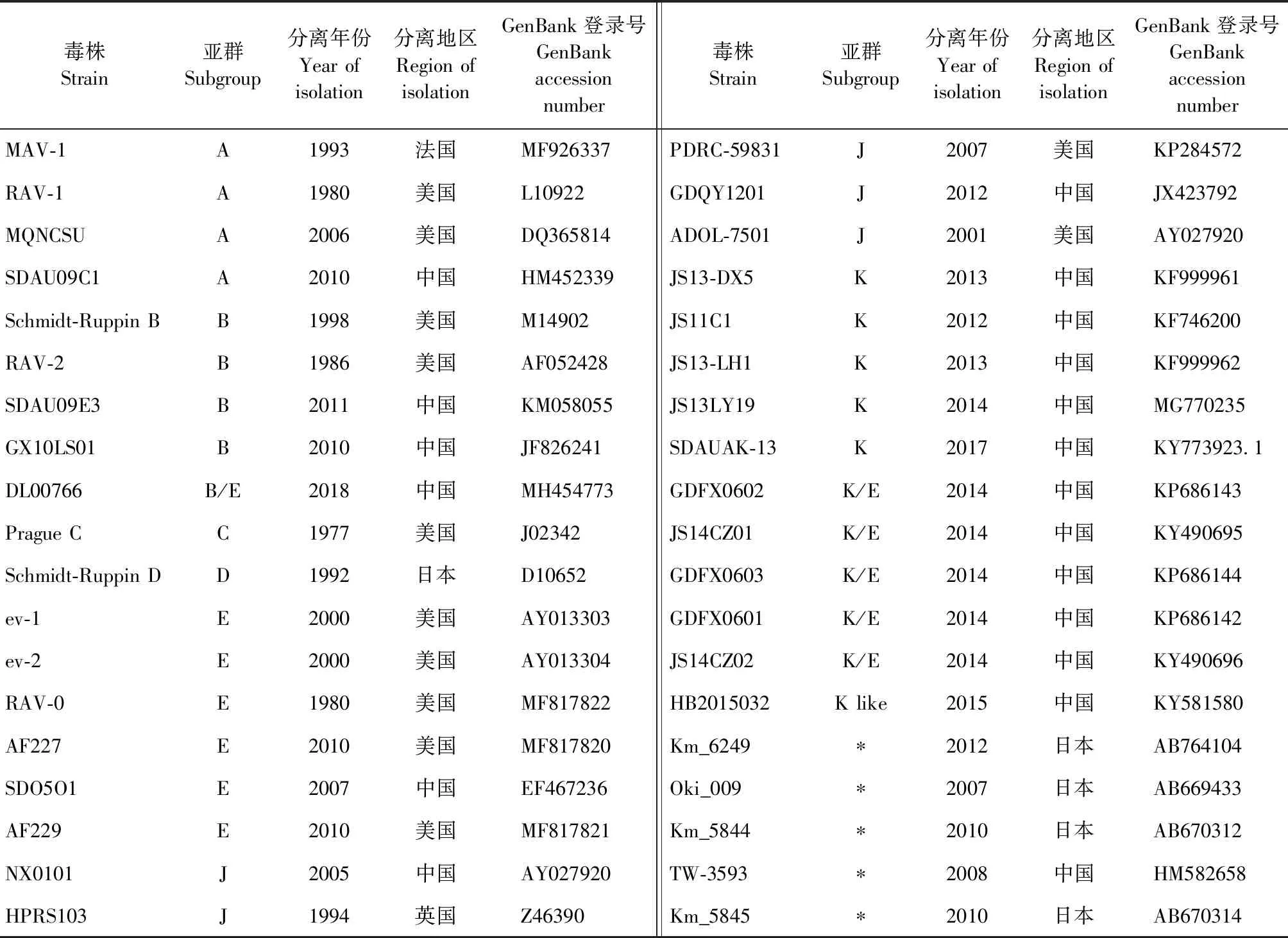
表3 ALV各亚群参考毒株信息
1.8 间接免疫荧光鉴定ALV分离毒株 从7株分离毒株中选取氨基酸变化差异较大的5株,将盲传2代后收取的病毒液接种于48孔板培养的DF-1细胞,未进行接毒操作的细胞为阴性对照,放置于37 ℃、5%二氧化碳细胞培养箱培养7 d,进行间接免疫荧光鉴定。将培养好的细胞用PBS漂洗3次,4%多聚甲醛室温下固定20 min,PBS漂洗3次,加入0.2%TritonX-100穿透细胞,冰上孵育20 min,预冷的PBS漂洗3次,1% BSA 37 ℃封闭1 h,预冷的PBS漂洗2次,使用ALV p27单克隆抗体 1∶100稀释,4 ℃过夜孵育,PBST漂洗4次,加入1∶100稀释的FITC标记山羊抗小鼠IgG抗体,37 ℃避光孵育1 h,于荧光倒置显微镜下观察发光情况。
2 结果
2.1 病毒分离 ELISA检测结果有7份样品为阳性,阳性率为17.5%(7/40),空白对照检测结果为阴性。结果表明,从40份蛋清p27抗原阳性鸡的无菌抗凝血样本中分离获得7株外源性ALV毒株。
2.2 病毒DNA提取和亚群鉴定 结果显示,7株分离毒株中有3株用ALV-J-F/R引物能扩增出特异性条带,其余4株用ALV-K-F/R引物能扩增出特异性条带,与预期条带大小基本相符,阴性对照无特异性条带(图1)。结果表明,7株ALV分离毒株中3株属于ALV-J毒株,分别命名为CAU4932、CAU4860和CAU2259;4株属于ALV-K毒株,分别命名为CAU5006、CAU7168、CAU7049和CAU7176。
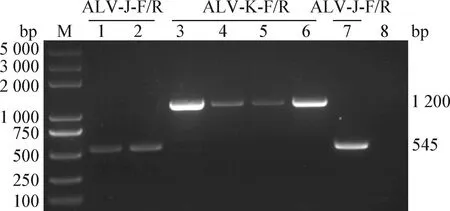
图1 7株ALV分离毒株的亚群鉴定
2.3 病毒gp85基因PCR扩增和测序 PCR扩增结果显示,7株分离毒株均在约1 000 bp位置扩增出特异性条带,符合gp85基因片段长度,阴性对照无扩增条带(图2)。测序结果显示,ALV-J分离株CAU4932、CAU4860和CAU2259的gp85基因片段长度为918 bp,编码306个氨基酸;ALV-K分离株CAU7049、CAU5006、CAU7176和CAU7168的gp85基因片段长度为1 008 bp,编码336个氨基酸。

图2 7株ALV分离毒株gp85基因的PCR扩增
2.4gp85基因序列和遗传演化分析 分离毒株gp85基因核苷酸序列同源性比对结果显示,同一亚群分离毒株间gp85基因核苷酸同源性较高,其中ALV-J分离毒株CAU4932、CAU4860和CAU2259的gp85基因核苷酸同源性为90.5%~95.2%,ALV-K分离毒株CAU5006、CAU7049、CAU7168和CAU7176的gp85基因核苷酸同源性为89.4%~92.3%。ALV-J分离毒株与ALV-J参考毒株HPRS103的gp85基因核苷酸同源性平均为83.2%(83.2%~83.3%);ALV-K分离毒株与ALV-K参考毒株JS11C1gp85基因核苷酸同源性平均为84.2%(84.0%~84.3%);其中ALV-J分离毒株中CAU2259与参考毒株SD13QJ01的gp85基因核苷酸序列同源性最高,为90.7%(图3)。

图3 gp85基因核苷酸序列同源性比对
分离毒株gp85蛋白氨基酸序列同源性比对结果显示,同一亚群分离毒株间gp85基因编码氨基酸同源性很高,其中ALV-J分离毒株CAU4932、CAU4860和CAU2259的gp85蛋白氨基酸同源性为95.1%~99.3%,ALV-K分离毒株CAU5006、CAU7049、CAU7168和CAU7176的gp85蛋白氨基酸同源性为94.0%~99.7%;ALV-J分离毒株与ALV-J参考毒株HPRS103的gp85蛋白氨基酸同源性平均为86.7%(85.3%~87.6%),ALV-K分离毒株与ALV-K参考毒株JS11C1的gp85蛋白氨基酸同源性平均为93.9%(93.1%~94.6%);ALV-J、ALV-K分离毒株gp85蛋白氨基酸序列与ALV-A、ALV-B参考毒株同源性较低,3株ALV-J分离毒株与ALV-A参考毒株氨基酸同源性平均仅为39.8%(39.5%~40.3%),与ALV-B参考毒株氨基酸同源性平均仅为40.5%(40.3%~40.8%);4株ALV-K分离毒株与ALV-A参考毒株gp85蛋白氨基酸同源性平均为81.5%(81.1%~82.0%),与ALV-B参考毒株gp85蛋白氨基酸同源性平均为77.1%(75.7%~77.8%)(图4)。

图4 gp85蛋白氨基酸序列同源性比对
通过对氨基酸序列进行对比分析,ALV-J分离毒株CAU2259与英国分离参考毒株 HPRS103分别有45个氨基酸突变、3个氨基酸缺失和1个氨基酸增加;ALV-J分离毒株CAU4860与HPRS103株分别有38个氨基酸突变和2个氨基酸缺失;ALV-J分离毒株CAU4932与HPRS103株分别有39个氨基酸突变和2个氨基酸缺失,这3株ALV-J分离毒株突变率分别为16.0%、13.1%和13.4%。ALV-J分离毒株CAU2259、CAU4860和CAU4932在高变区(hr1和hr2)分别有22、19和19个氨基酸突变。3株ALV-J分离毒株之间有16个氨基酸突变和2个氨基酸缺失,在hr1和hr2有7个氨基酸变异。结果表明,gp85蛋白的氨基酸变异在整个序列均有发生,但在hr1和hr2相对变异较多(图5)。

图5 ALV-J分离毒株gp85蛋白氨基酸可变区序列比对分析
预测ALV-J分离毒株gp85蛋白B细胞抗原表位,结果显示,3株ALV-J分离毒株均缺失了第117位氨基酸,CAU2259毒株第189、238、239位突变成赖氨酸,第190位突变成精氨酸,第192位突变成丝氨酸,第194、215位突变成天冬氨酸,第212位突变成谷氨酰胺,第214位突变成脯氨酸,第216位氨基酸缺失,以上氨基酸变化均发生在预测的gp85蛋白B细胞优势抗原表位中(图6),可能导致gp85蛋白抗原性发生变化。
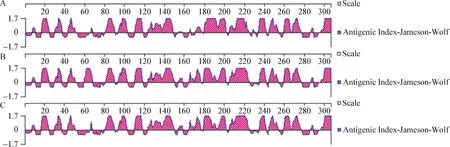
图6 ALV-J分离毒株gp85蛋白B细胞抗原表位预测
ALV-K分离毒株CAU5006与GDFX0603氨基酸同源性最高,为96.1%;ALV-K分离毒株CAU7176与中国分离参考毒株 JS11C1分别有22个氨基酸突变和1个氨基酸增加;ALV-K分离毒株CAU5006和CAU7049与JS11C1株分别有19个氨基酸突变和1个氨基酸增加,ALV-K分离毒株CAU7168与JS11C1株分别有18个氨基酸突变和1个氨基酸增加,这4株ALV-K分离毒株突变率分别为6.8%、6.0%、6.0%和5.7%,突变幅度差异不大。ALV-K分离毒株CAU7176、CAU5006、CAU7049和CAU7168在hr1和hr2分别有5、5、6和6个氨基酸突变;4株ALV-K分离毒株之间有24个氨基酸突变,在hr1和hr2有8个氨基酸变异(图7)。

图7 ALV-K分离毒株 gp85蛋白氨基酸可变区序列比对分析
预测ALV-K分离毒株gp85蛋白B细胞抗原表位,结果显示,4株ALV-K分离毒株中CAU5006和CAU7176第139位氨基酸突变为苏氨酸,CAU7049和CAU7168毒株第139位突变为精氨酸,CAU7176毒株第171位氨基酸,CAU5006、CAU7049和CAU7168毒株第176位氨基酸突变成天冬氨酸,CAU5006、CAU7049和CAU7168毒株第195位氨基酸突变为精氨酸,CAU7176毒株第197位突变为丝氨酸、第199位突变为苯丙氨酸,CAU5006、CAU7049和CAU7168毒株第200位突变为苯丙氨酸,4株ALV-K分离毒株在第216位均突变成精氨酸,CAU7176毒株第271位突变为甘氨酸,以上氨基酸变化均发生在预测的gp85 B细胞优势抗原表位中(图8),可能导致gp85蛋白抗原性发生变化。

图8 ALV-K分离毒株gp85蛋白 B细胞抗原表位预测
分离毒株gp85基因核苷酸序列遗传进化树如图9所示,3株ALV-J分离毒株CAU4932、CAU4860和CAU2259与ALV-J各参考毒株在同一进化分支上,属于ALV-J毒株;4株分离毒株CAU7049、CAU5006、CAU7176和CAU7168与ALV-K各参考毒株在同一进化分支上,属于ALV-K毒株;3株ALV-J分离毒株间亲缘关系很近,且与2001年美国分离毒株ADOL-7501亲缘关系较近,属于同一遗传进化分支,而与ALV-J代表毒株HPRS103亲缘关系相对较远;4株ALV-K分离株与日本分离毒株Oki_009以及JS13-DX5、JS13-LH1和SDAUAK-13等国内分离的ALV-K毒株亲缘关系较近。

图9 7株ALV分离毒株与参考毒株基于gp85基因核苷酸序列的遗传进化树
2.5 间接免疫荧光鉴定ALV分离毒株 使用ALV p27单克隆抗体进行间接免疫荧光鉴定,结果如图10所示,5株分离毒株CAU7176、CAU5006、CAU4860、CAU2259和CAU7049在荧光显微镜下均可看到绿色荧光,阴性对照未见特异性绿色荧光。结果表明,该5株分离毒株可在DF-1细胞内复制并存在可被抗体识别的p27抗原表位。

图10 ALV分离毒株间接免疫荧光鉴定(200×)
3 讨论
自从1868年鸡的淋巴肉瘤症状首次被报道以来,禽白血病作为一种免疫抑制性疾病在世界各地流行传播,给养禽业造成巨大经济损失[18]。近十年来,我国大型种鸡场高度重视禽白血病净化并取得显著成效,许多规模化鸡场已达到规定的净化标准[19]。但由于ALV高变异率和垂直传播等特征,其仍在一些鸡场流行,并不断出现新毒株[20]。ALV-J毒株于1992年首次在英国被发现并报道,而后迅速传播,导致家禽恶性肿瘤伴有骨髓性白血病,该亚群的高致病性使其相比ALV其他亚群更加普遍[21]。近年来,我国分离到的ALV新型K亚群毒株的复制能力和致病性较弱,但易与其他ALV亚群病毒混合感染,为ALV防控净化增加难度[13]。ALV的糖基化包膜蛋白由env基因编码,其中负责与宿主细胞受体结合的gp85蛋白具有高变异性[22]。
本试验从国内某鸡场无菌抗凝血样本分离获得7株ALV毒株,进行gp85基因片段克隆和测序,其中3株为ALV-J毒株,gp85基因片段长度均为918 bp,4株为ALV-K毒株,gp85基因片段长度均为1 008 bp。其中CAU5006毒株与国内分离株GDFX0603氨基酸同源性最高,为96.1%,遗传进化树属同一分支,表明该鸡场流行的ALV-K毒株可能与GDFX0603是同一祖先。
本试验中分离获得的ALV-K毒株与JS11C1毒株gp85蛋白氨基酸突变率为5.7%~6.8%;遗传进化树显示,ALV-K分离毒株gp85基因序列与日本参考毒株Oki_009以及JS13-DX5、JS13-LH1和SDAUAK-13等国内分离毒株亲缘关系较近,属于同一分支,表明ALV-K毒株可能已在国内和日本的鸡群中传播并存在了较长时间,且与广西和山东的ALV-K毒株发生过基因重组。此外,鸡群存在ALV-J和ALV-K共感染现象,感染ALV多种亚群的病鸡临床症状更为明显[23]。
本试验中分离获得ALV-J毒株与英国原型株HPRS103gp85基因片段核苷酸同源性为83.2%,氨基酸的变异在整个序列均有发生,但高变区hr1和hr2相对变异较多,其中某些氨基酸位点的变化可能导致蛋白疏水性改变,进而导致gp85蛋白抗原表位发生变化,该结果证实了gp85 基因片段具有很强的变异性,同时也证实了ALV-J毒株感染鸡群的范围正在逐步扩大。将ALV分离毒株gp85蛋白氨基酸序列与预测的gp85蛋白B细胞抗原表位对比发现,ALV分离毒株gp85蛋白部分氨基酸突变发生在预测的B细胞抗原表位上,这可能使gp85蛋白抗原性发生变化,增加ALV分群鉴定难度。
综上所述,本试验分离获得7株ALV毒株,对其gp85基因进行克隆、测序和遗传进化树分析,丰富了ALV基因组库资源,同时也为ALV演化特征提供了一定参考,但分离毒株gp85蛋白变异的具体流行规律和趋势有待未来进一步研究。我国地方品系鸡群背景复杂,加之ALV具有隐性感染、混合感染和易突变的特性,目前我国尚不能达到ALV的全面净化,未来应进一步深入研究ALV致病特征、流行规律和遗传进化演变等,通过健全完善严格的净化体系,加速种鸡群ALV净化,减少禽白血病给我国养禽业造成的经济损失。

