内蒙古不同地区蜱类鉴定及其空间分布
崔梦宇 , 苏 思 , 邢丽丽 , 木 兰 , 高瑞娟 , 郭棋棋 , 任 洪 , 祁冬冬 , 于晶峰
(1.内蒙古医科大学公共卫生学院 , 内蒙古 呼和浩特 010100 ; 2. 内蒙古医科大学基础医学院 , 内蒙古 呼和浩特 010100 ;3. 内蒙古医科大学第二附属医院 , 内蒙古 呼和浩特 010090 ; 4. 内蒙古医科大学第一临床医学院 , 内蒙古 呼和浩特 010100 ;5. 呼伦贝尔市第三人民医院精神疾病基础与临床实验室 , 内蒙古 呼伦贝尔 022150)
蜱是一种吸血寄生虫,可以传播原生动物、立克次体、螺旋体和病毒等,被认为是仅次于蚊子的疾病传播媒介。蜱可以寄生在家畜、野生动物和人类等脊椎动物身上[1-2],大多数蜱在饱血后脱离宿主,落到地面,受精的雌蜱脱离宿主后,在栖息地产卵繁殖[3]。蜱的一生中大部分时间脱离宿主,因此植被中有大量游离蜱存在。蜱分布广泛但不均匀,以树林、灌木丛和草地居多,放牧区域更是蜱类疾病的多发地带[4]。因此,开展对寄生蜱和游离蜱的调查,对蜱传疾病的预警和控制具有十分重要的意义。
内蒙古自治区位于我国北部边疆,东西狭长,占地面积118.3万平方公里,是我国第三大省区。毗邻我国多个省份,并与蒙古国和俄罗斯接壤。内蒙古自治区生态环境差异较大,从极端的干旱区跨越到温带湿润区,生态系统包括森林生态系统、草地生态系统、荒漠生态系统和农田生态系统等[5],但总体来说,内蒙古自治区属高原草原型气候,拥有我国丰富的草原牧区和重要的森林基地,得天独厚的地理生态环境不仅为蜱的生长和繁殖提供了条件,也使得该地区成为我国蜱传疾病的重要疫区之一[6-8]。由于蜱传疾病具有自然疫源性,蜱标本的采集多在人迹罕至的森林和牧场,加上蜱的生活史特点,研究者们受采样时间和地理位置所限,只能对内蒙古自治区的部分地区和部分蜱种分布进行研究,整体全局分布还不清楚。本试验为了解内蒙古自治区蜱种类的分布情况,于2021—2023年首次在内蒙古自治区全境东部和西部选择森林、草地、荒漠和农田等不同的生态环境开展蜱的调查。
1 材料与方法
1.1 主要试剂 2×TaqPCR Mix预混液,购自生工生物工程(上海)股份有限公司;DL5 000 DNA Marker,购自宝日医生物技术(北京)有限公司;CelRed核酸染料,购自兰博利德生物技术有限公司(北京);Invitrogen琼脂糖,购自Thermo Fisher Scientific公司(美国);血液/细胞/组织基因组DNA提取试剂盒、通用型DNA纯化回收试剂盒、PGM-T Vector产物克隆试剂盒和TOP 10感受态细胞,均购自天根生化科技(北京)有限公司。
1.2 主要仪器 凝胶成像系统ChampGel 5 000,北京赛智创业科技有限公司产品;NANODROP2000c,基因科技(上海)股份有限公司产品;琼脂糖水平电泳槽,北京六一生物科技有限公司产品;SZ 680连续变倍体视显微镜,重庆奥特光学仪器有限责任公司产品。
1.3 试验方法
1.3.1 调查地点和时间 2021年4月—2023年7月对内蒙古自治区全境以分层随机方式,对呼伦贝尔市新巴尔虎右旗、阿龙山镇、牙克石市和大杨树镇,兴安盟阿尔山市,赤峰市天山镇,锡林郭勒盟苏尼特右旗,鄂尔多斯市成川镇,巴彦淖尔市乌拉特前旗、乌拉特中旗、乌拉特后旗和磴口县共12个地区进行采样。因巴彦淖尔市磴口县紧靠阿拉善右旗,阿拉善盟为典型的荒漠区,已在巴彦淖尔市的荒漠生态系统采样,故而并未在阿拉善盟采样。具体采样地点见图1。
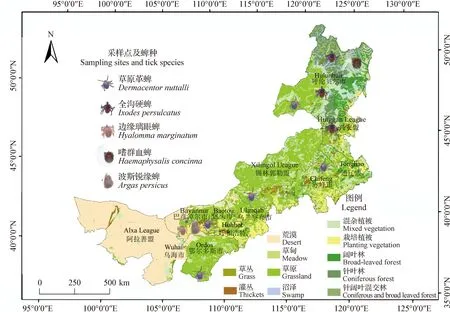
图1 蜱样本采样地图
1.3.2 调查方法 于2021—2023年蜱活跃期结合牧民参与调查的意愿,采用拖旗法和人工采集法
(使用镊子轻轻将宿主体表寄生的蜱夹取并放入收集管中)对内蒙古自治区中12个调查地点进行采样。
1.3.3 蜱形态学鉴定 在体视显微镜下观察蜱的假头、气门板、生殖孔、盾板、须肢有无背刺或腹刺、哈式器、有无几丁质增厚部等形态学特点,根据《蜱类学》[9]和《常见病媒生物分类鉴定手册》[10]进行蜱形态学属、种鉴定。
1.3.4 蜱DNA提取 将经形态学鉴定的蜱用75%酒精浸泡1 min消毒体表,用PBS清洗3遍,置于滤纸上将水分充分吸干。研钵、研磨杵和镊子等提前高温灭菌,使用前用液氮预冷,对调查地点的每个蜱种取1~2只蜱,单只一组充分研磨3遍。将研磨的蜱组织按照血液/细胞/组织基因组DNA提取试剂盒说明书提取DNA。
1.3.5 引物合成 参考GenBank中软蜱和硬蜱的18S rRNA、16S rRNA和细胞色素C氧化酶亚基Ⅰ(Cytochrome C oxidase subunit Ⅰ,COI)基因的序列,应用Oligo 7.0设计简并引物(表1),引物序列交由生工生物工程(上海)股份有限公司合成。
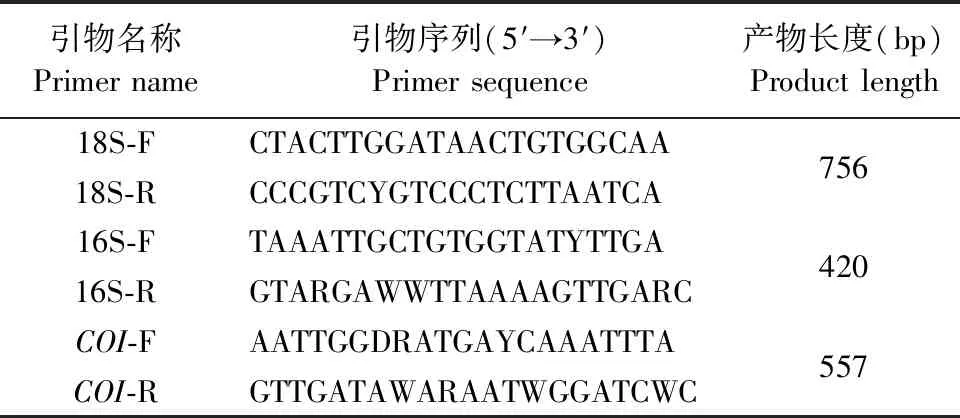
表1 PCR引物信息
1.3.6 PCR扩增和测序 应用18S rRNA、16S rRNA和COI基因引物,以提取的DNA为模板,进行聚合
酶链式反应(Polymerase chain reaction,PCR)扩增。PCR反应体系为20 μL:DNA模板1 μL,上、下游引物各0.5 μL,2×TaqMaster Mix 11 μL,ddH2O 7 μL。反应结束后,取5 μL PCR产物加入到1.5%琼脂糖凝胶中,110 V、30 min条件下电泳,在凝胶成像系统中将目的片段的特异性条带切下,用通用型DNA纯化回收试剂盒回收目的片段。胶回收产物在16 ℃条件下与PGM-T Vector过夜连接,转化至TOP 10感受态细胞中,并在含氨苄西林的LB固体培养基上进行阳性克隆筛选。挑取可疑菌落接种至含氨苄青霉素的LB液体培养基扩大培养,将阳性菌液送至生工生物工程(上海)股份有限公司测序。
1.3.7 系统进化分析 将成功测序的18S rRNA、16S rRNA和COI基因序列与美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)中GenBank数据库序列进行同源性对比分析。使用MEGA 7软件,采用最大似然(Maximum likelihood,ML)法[11],以微小扇头蜱作为外群,经过1 000次的Bootstrap计算,分别构建3个基因的系统进化树。
1.3.8 统计学分析 试验得到的计数资料应用SPSS 22.0软件对数据进行分析,使用χ2检验进行差异性显著检验,P<0.05表示差异显著。统计在不同宿主中采集的蜱种。按照公式(1)计算Jaccard相似性系数[12],分析不同生态环境中蜱群落相似性。
q=c/(a+b-c)
(1)
式中:a和b分别为2个群落各自所拥有的物种数目,c为2个群落共有的物种数目。当0≤q<0.25,2个群落间极不相似;当0.25≤q<0.50,2个群落间中等不相似;当0.50≤q<0.75,2个群落间中等相似;当0.75≤q≤1.00,2个群落间极相似。
2 结果
2.1 蜱形态学鉴定 共采集5 029只皆处于成虫阶段的蜱(表2),其中包括1 719只游离蜱和3 310只寄生蜱,于显微镜下进行形态结构观察,结果显示,所采集的蜱隶属于2科5属5种,分别为硬蜱科的草原革蜱(Dermacentornuttalli)、全沟硬蜱(Ixodespersulcatus)、边缘璃眼蜱(Hyalommamarginatum)和嗜群血蜱(Haemaphysalisconcinna)以及软蜱科的波斯锐缘蜱(Argaspersicus)。因未采集到雄性波斯锐缘蜱,故本试验无法提供其参考照片。以上5种蜱的假头基形状、盾板、生殖孔和气门板等有一定的区别(表3和图2)。
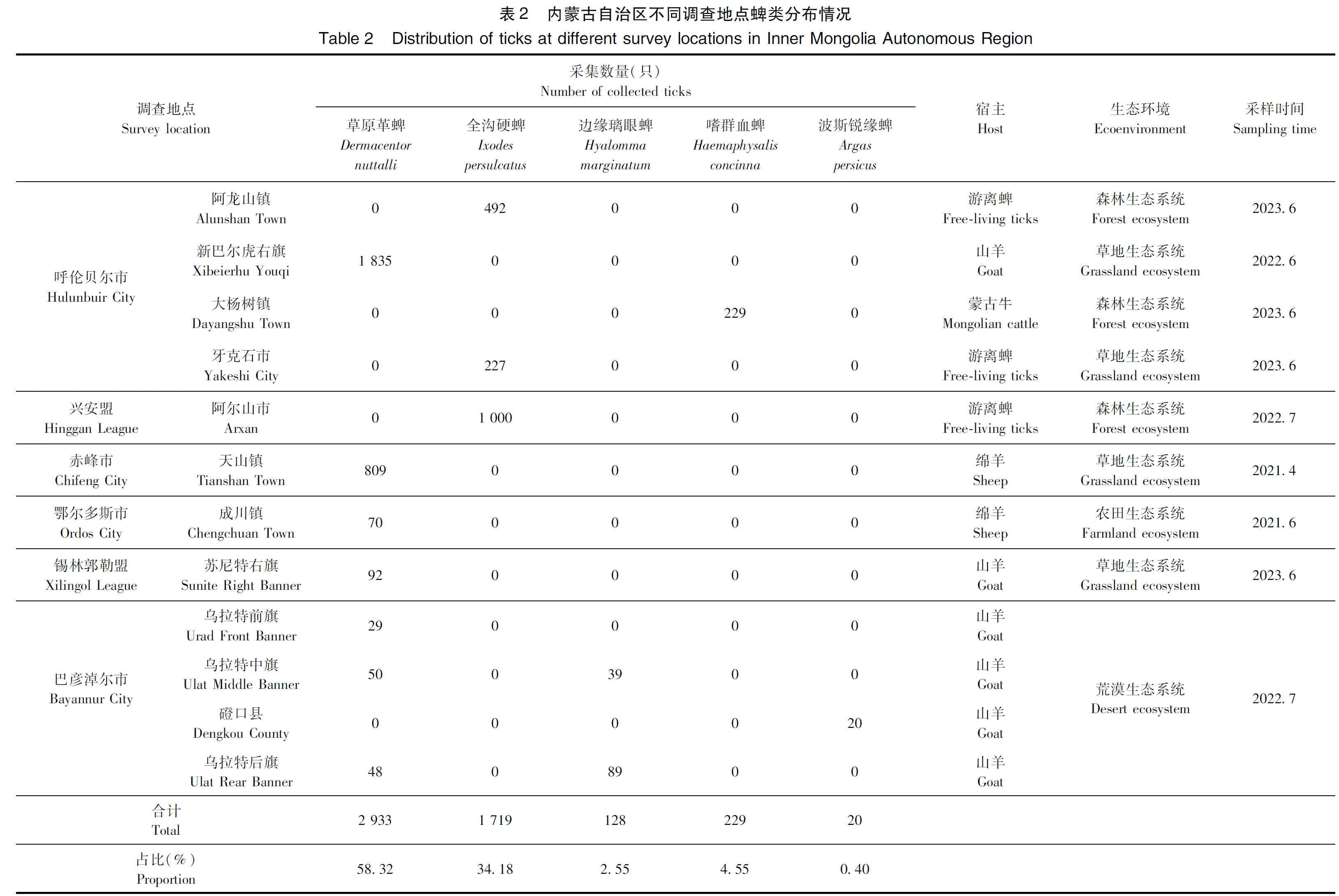

表3 显微镜观察不同品种蜱的主要鉴定特征

图2 蜱的形态结构
2.2 PCR扩增 草原革蜱、全沟硬蜱、边缘璃眼蜱、嗜群血蜱和波斯锐缘蜱的18S rRNA基因PCR扩增产物片段为756 bp,16S rRNA基因PCR扩增产物片段为420 bp,COI基因PCR扩增产物片段为557 bp(图3),与预期大小相符。
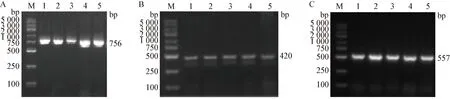
图3 蜱的18S rRNA(A)、16S rRNA(B)和COI(C)基因的PCR扩增
2.3 序列和系统发育分析 将成功测序的18S rRNA(GenBank序列号:OR 039313~OR 039324、OR 936234)、16S rRNA(GenBank序列号:OR 039050~OR 039061、OR 936207)和COI(GenBank序列号:OR 039519~OR 039530、OR 936649)基因序列与GenBank中的序列进行同源性对比分析,结果如图4所示,本调查的草原革蜱、全沟硬蜱、边缘璃眼蜱、嗜群血蜱和波斯锐缘蜱基因序列分别与GenBank中同种类蜱的基因序列同源性达96.0%以上,与同属蜱种的基因序列在同一大支上,不同属蜱种的基因序列在不同分支上;6个地理种群的草原革蜱混合分布,不存在地理隔离。18S rRNA基因系统发育树显示,同种类蜱的基因序列与GenBank中同属种的参考基因序列自展值仅大于76.0%,无法鉴定到种水平;16S rRNA和COI基因序列与GenBank中同种类的参考基因序列比对,自展值均大于96.0%。
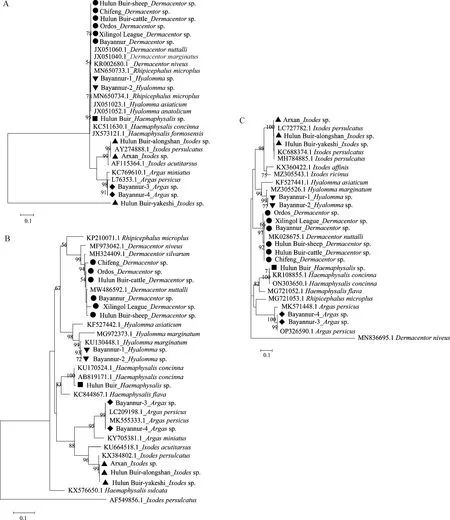
图4 不同蜱种18S rRNA(A)、16S rRNA(B)和COI(C)基因的系统进化分析
2.4 不同生态坏境中蜱的构成 由表4可知,草原革蜱存在于除森林生态系统外的3种生态环境中,全沟硬蜱存在于森林生态系统和草地生态系统2种生态环境中,边缘璃眼蜱和波斯锐缘蜱均只存在于荒漠生态系统,嗜群血蜱只存在于森林生态系统。不同的生态环境中分布的蜱种存在统计学差异(χ2=6 734.068,P<0.001)。在草地生态系统中存在的蜱较多(2 963只),占蜱总数的58.92%;其次是森林生态系统(1 721只),占蜱总数的34.22%。
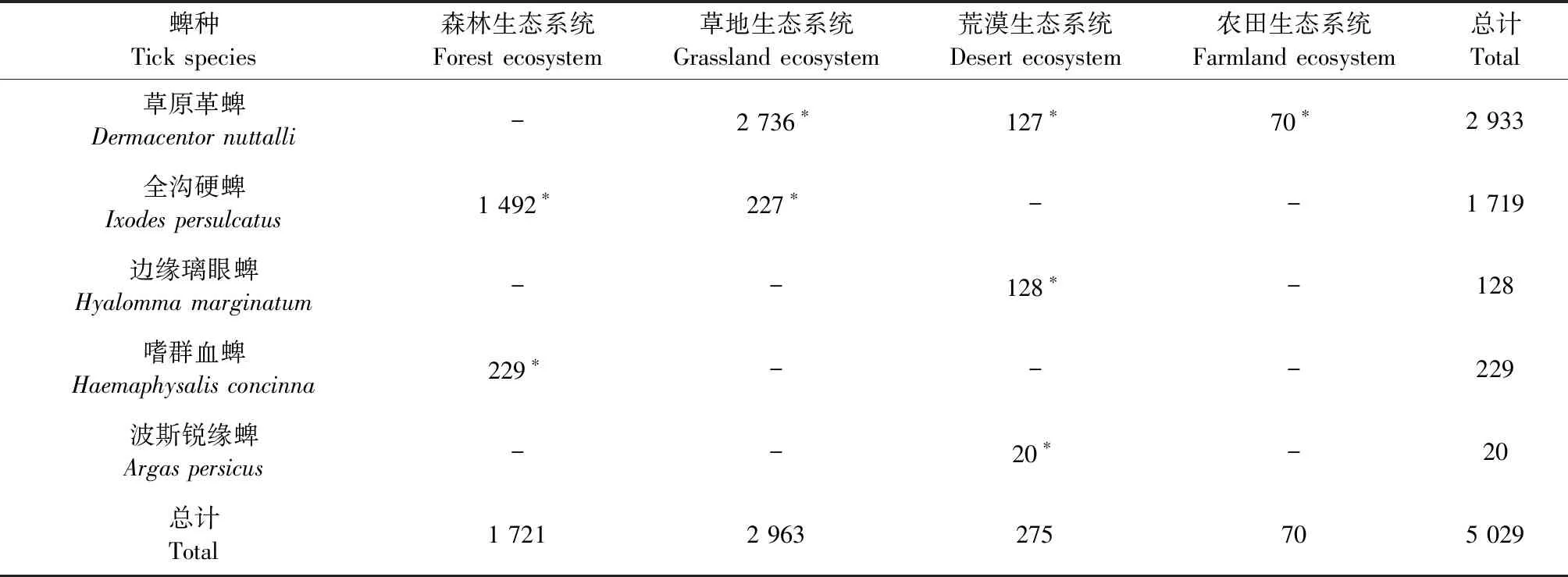
表4 内蒙古自治区不同生态环境中采获蜱的数量
2.5 不同生态环境中蜱群落相似性 由表5可知,森林生态系统与荒漠生态系统和农田生态系统均没有相似性,相似性系数为0;草地生态系统与农田生态系统中等相似,相似性系数为0.50;草地生态系统与森林生态系统中等不相似,相似性系数为0.33;荒漠生态系统与农田生态系统和草地生态系统中等不相似,相似性系数分别为0.33和0.25。
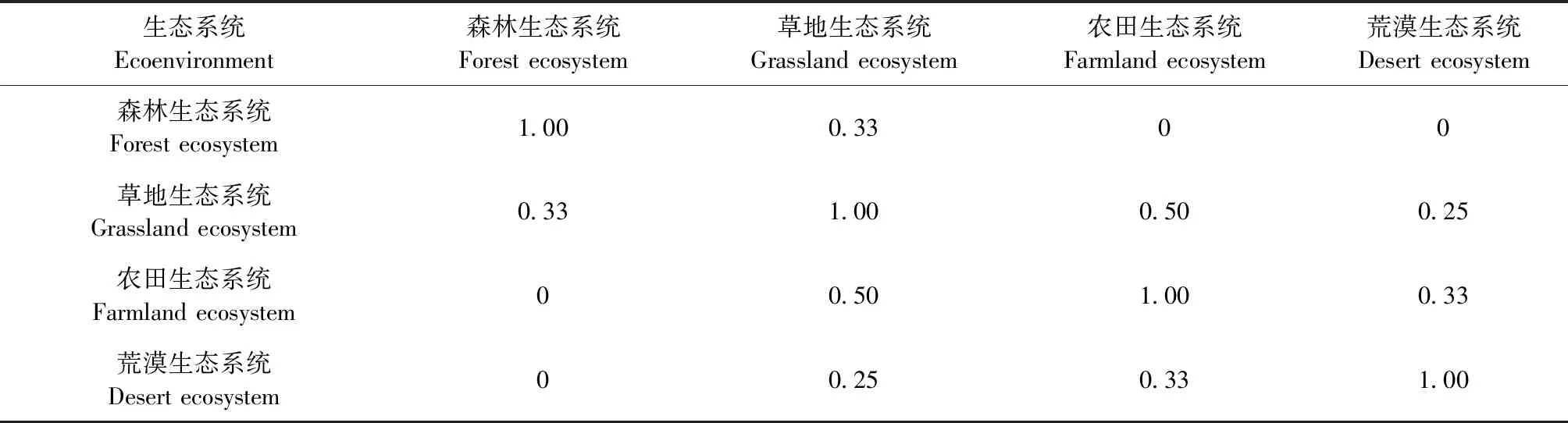
表5 内蒙古自治区不同生态环境蜱群落Jaccard相似性系数
2.6 不同宿主采集的蜱种 由表6可知,山羊宿主所携带的蜱数量(2 202只,43.79%)最多,种类最丰富。采集的全沟硬蜱均为野外游离蜱,故未在表中呈现该蜱种的宿主情况。

表6 不同宿主采获蜱情况
3 讨论
本调查发现,草原革蜱是内蒙古自治区地区优势蜱种,占此次采获蜱总数的58.32%,这与黄天鹏[13]的研究结果一致。全沟硬蜱和嗜群血蜱主要分布在东北的黑龙江省和辽宁省,孳生地的温度变化大是蜱种分布的主要影响因素,针阔混交林的覆盖率越大越适合这2种蜱的生存。这2种成蜱的活动期均在4~8月,高峰在5月至6月初;其可以携带立克次体、森林脑炎病毒和发热伴血小板减少综合征病毒等[14-16]。草原革蜱主要分布在北方,包括内蒙古自治区等省份,该蜱一般在3月底至6月中旬积极活动,成蜱高峰为4月和5月,灌丛草地的覆盖率越高越适合草原革蜱的生存;其可以携带斑点热群立克次体、无形体、布鲁氏菌和巴贝西虫等蜱传病原体[17]。璃眼蜱主要分布在新疆维吾尔自治区、内蒙古自治区和辽宁省等地区,荒漠草地的覆盖率越高越适合该蜱的生存[18]。内蒙古自治区全区狭长,蜱种丰富,因地形各异可以形成各种独特的小气候,为不同蜱的生存提供了条件。因此,开展蜱媒的监测对蜱传疾病的预防和控制具有重要意义。
本调查采用传统形态学与分子生物学结合的方法对采集到的硬蜱和软蜱进行蜱种鉴定,并总结了在国内分布较广泛的硬蜱和软蜱的形态学特征,可为后续研究提供参考。系统发育分析显示,本调查的蜱种与GenBank中同属蜱种的基因序列在同一大支上,不同属蜱种的基因序列在不同分支上,表明分子生物学鉴定较为可靠,且可避免因幼蜱、样本残缺等无法进行蜱种鉴定的问题。基于16S rRNA和COI基因的系统发育结果显示,草原革蜱与森林革蜱亲缘关系较近,且在内蒙古自治区不同地区采集的草原革蜱在系统发育树中混杂分布,并未出现地理隔离;但18S rRNA基因无法鉴定到物种水平,这与此前报道结果一致[11]。本调查尚有一定的不足:首先,此次采集样本中未采获雄性波斯锐缘蜱;其次,调查的宿主除牧区山羊和绵羊外,野生动物尚未涉及。后续可以扩大样本的种类和来源,进一步开展蜱类空间分布特征等调查。
本调查对不同的生态环境中分布的蜱种差异进行卡方分析,以及对不同生态环境蜱群落进行相似性分析,均发现内蒙古自治区的森林、草地、农田和荒漠不同生态环境中蜱种分布有所差异,可能与蜱的分布受到空气中湿度、温度、植被类型和年度温差变化等的影响有关,本调查在不同的生态系统中采集的蜱类与赵国平[19]的蜱类区系分布特点一致。同时,本调查对蜱虫侵染的宿主进行分析,发现不同宿主中山羊感染的蜱虫数量较多,以草原革蜱为主,可能与草原革蜱在内蒙古自治区分布广泛有关,在本次采样中也证实草原革蜱除大量存在于草原外,也存在于荒漠。全沟硬蜱仅在蒙东地区的森林生态环境中采集到游离蜱,未采集到寄生蜱,可能与蒙东地区温差变化较大和植被类型丰富等因素有关。在对蜱虫预防和控制过程中可针对不同生态环境、不同宿主采取更加有针对性的措施。
本调查于2021—2023年首次对内蒙古自治区全境不同生态环境中采集的蜱类进行生态环境差异分析和蜱种鉴定。内蒙古自治区畜牧业发达且拥有众多林区和牧场,农牧民与蜱接触较为密切,对该地区进行蜱的空间分布调查具有重要的医学意义,本调查结果为内蒙古自治区蜱的防治工作提供了科学参考依据。

