堆型艾美耳球虫裂殖子外分泌蛋白对细胞凋亡的抑制作用
葛玉杰 , 王黎霞 , 王诗琪 , 石梦云 , 陈玲玲 , 王梦琦 , 于 慧 , 张建军 , 安 健
(1. 北京农学院动物科学技术学院 , 北京 昌平 102206 ; 2. 北京农业职业学院动物科技学院 , 北京 房山 102442)
鸡球虫病是一种专性细胞内寄生原虫病,主要损害鸡的肠道部位,在家禽养殖业中时常出现,尤其是在集约化养殖场中最易暴发,发病率可达50%~70%[1],严重影响了养殖户的经济收益。细胞凋亡是一种高度调控的细胞死亡方式,在面对病原体感染时,宿主细胞为了抑制病原体在体内的增殖会启动细胞凋亡,以此保护正常的细胞[2-3]。胞内寄生虫会通过一些途径和机制来抑制宿主细胞的凋亡,逃避宿主细胞防御系统的杀伤作用,为自身在宿主细胞的生存和增殖提供有利的条件[4-5]。目前的研究表明,弓形虫可通过干扰半胱天冬氨酸蛋白酶(Caspase)级联反应、促进核转录因子κB(Nuclear transcription factor κB,NF-κB)活化、抑制线粒体细胞色素C(Cytochrome C,Cyt-C)释放等途径抑制宿主细胞的凋亡[4]。柔嫩艾美耳球虫(Eimeriatenella)裂殖子在入侵马-达氏牛肾(Madin-Darby bovine kidney,MDBK)细胞早期可通过线粒体通路和NF-κB信号通路抑制宿主细胞凋亡[6],堆型艾美耳球虫(Eimeriaacervulina)裂殖子在入侵MDBK细胞早期也有类似于柔嫩艾美耳球虫裂殖子抑制MDBK细胞凋亡的机制[7]。然而,关于堆型艾美耳球虫裂殖子与细胞在不直接接触的情况下,对细胞凋亡影响的研究罕有报道。因此,本试验使用Transwell小室将堆型艾美耳球虫裂殖子与MDBK细胞相互隔开,共培养不同的时间点,检测细胞凋亡的情况,并对共培养6 h的细胞上清液进行液相色谱串联质谱(Liquid chromatography-tandem mass spectrometry,LC-MS/MS)分析鉴定,初步确定堆型艾美耳球虫裂殖子是否会释放外分泌蛋白抑制细胞凋亡,为进一步探究球虫外分泌蛋白调节宿主细胞凋亡的作用和机制提供支持。
1 材料与方法
1.1 主要试剂 DMEM高糖培养基,购自北京爱普锐晟科技有限公司;胎牛血清(Fetal bovin serum,FBS),购自赛默飞世尔科学(美国)科技有限公司;胰蛋白酶粉、双抗和PBS,均购自索莱宝生物科技有限公司;层析柱,购自思拓凡公司;DEAE-52纤维素、0.1 moL/L氯化氢(HCl)和0.1 mol /L氢氧化钠(NaOH),均购自北京博奥拓达科技有限公司。
1.2 主要仪器 100和200目标准分样筛,均购自绍兴市上虞区豪泉筛具厂;匀浆机,购自九阳股份有限公司;血球计数板,购自上海求精生化试剂仪器有限公司;Transwell小室(孔径0.4 μm),购自美国Corning公司;倒置显微镜,购自美国Scilogex公司;细胞培养箱,购自三洋公司。
1.3 实验动物、细胞株和虫株 1日龄白羽肉鸡,购自北京市华都峪口禽业有限公司,在经高温灭菌后的房间内饲养至14日龄。MDBK细胞,由北京农学院兽医病理学实验室保存。堆型艾美耳球虫虫株,由中国农业大学兽医寄生虫实验室惠赠。
1.4 试验方法
1.4.1 堆型艾美耳球虫裂殖子的分离纯化 参照参考文献[8]的方法,取14日龄的雏鸡,每只鸡感染2×105个堆型艾美耳球虫孢子化卵囊,感染74 h后脱颈致死雏鸡,取十二指肠,在预冷的洗脱液中刮取肠道黏膜,匀浆3 min,依次使用100和200目标准分样筛过滤。滤液于1 500 r/min离心10 min,弃去上清液;用预热的洗脱液重悬沉淀,于600 r/min离心8 min,收集上清以去除红细胞等杂质;最后于1 500 r/min离心10 min,收集沉淀,用预热的洗脱液重悬。提前活化的DEAE-52纤维素加入适量预热的洗脱液混匀倒入直径1 cm、高约30 cm的层析柱中,纤维层析柱高约14 cm。将裂殖子重悬液缓慢均匀的沿着玻璃棒加入纤维层析柱中,用试管收集游过层析柱的裂殖子,用于后续试验。
1.4.2 试验分组和处理 取出液氮中冻存的MDBK细胞并进行复苏传代,传至第3代后以每孔3.5×105个/mL的密度均匀铺至6孔板,培养24 h后,6孔板中架设Transwell小室,6孔板每孔被分为上室和下室两部分。试验设置3个时间点,分别为共培养1.5、3和6 h,每个时间点分为2个组,共培养组(Co-culture group,上室加入0.5 mL约含有1.4×106个堆型艾美耳球虫裂殖子的洗脱液)和对照组(Control group,上室加入0.5 mL洗脱液)。以上所有试验均设3组重复。
1.4.3 细胞凋亡检测 分别在共培养1.5、3和6 h三个时间点收集共培养组和对照组的细胞,于1 000 r/min离心5 min,将各组的细胞收集至1.5 mL离心管,重悬至Binding Buffer中,加入PI和Annexin-V-FITC溶液,避光室温孵育15 min,用流式细胞仪进行荧光检测。
1.4.4 LC-MS/MS分析 MDBK细胞培养24 h后,将旧的细胞培养基换成不含双抗和血清的高糖DMEM,架设Transwell小室,上室加入同1.4.2等量的堆型艾美耳球虫裂殖子。共培养6 h后,收集细胞培养上清液进行LC-MS/MS检测,质谱数据通过MaxQuant(V1.6.6)软件进行检索,采用的数据库检索算法是Andromeda;通过与Uniprot数据库中堆型艾美耳球虫的蛋白质组参考数据库进行比对,鉴定样品液中的蛋白质成分。
1.4.5 数据统计与分析 利用Graphpad Prism 8.0.2软件进行统计作图,SPASS 22.0软件进行统计分析,试验数据采用“平均值±标准差”表示,采用独立样本t检验对数据进行差异性分析,P<0.05表示差异显著,P<0.01表示差异极显著,P>0.05表示差异不显著。
2 结果
2.1 细胞凋亡检测 结果显示,1.5 h对照组总细胞凋亡率为(6.70±0.13)%,1.5 h共培养组总细胞凋亡率为(5.92±0.19)%;3 h对照组总细胞凋亡率为(10.10±0.32)%,3 h共培养组总细胞凋亡率为(8.13±0.32)%;6 h对照组总细胞凋亡率为(13.33±0.13)%,6 h共培养组总细胞凋亡率为(11.57±0.37)%(表1)。在共培养不同时间点,共培养组的总细胞凋亡率均极显著低于对照组(P<0.01)(图1)。

图1 对照组与共培养组在不同时间点的总细胞凋亡率

表1 各组细胞凋亡情况
2.2 LC-MS/MS分析 细胞培养液上清通过LC-MS/MS检测,与Uniprot数据库中堆型艾美耳球虫的蛋白质组参考数据库进行比对,共鉴定到65个外分泌蛋白,其中23个蛋白具有定量信息(图2)。定量蛋白包括3个热休克蛋白、1个微线蛋白、3个生化代谢酶相关蛋白、2个能量合成蛋白、1个蛋白磷酸酶、1个14-3-3蛋白、1个组蛋白、1个肌动蛋白、1个延伸因子、1个真核翻译起始因子和4个假定蛋白等(表2)。

图2 LC-MS/MS分析鉴定结果
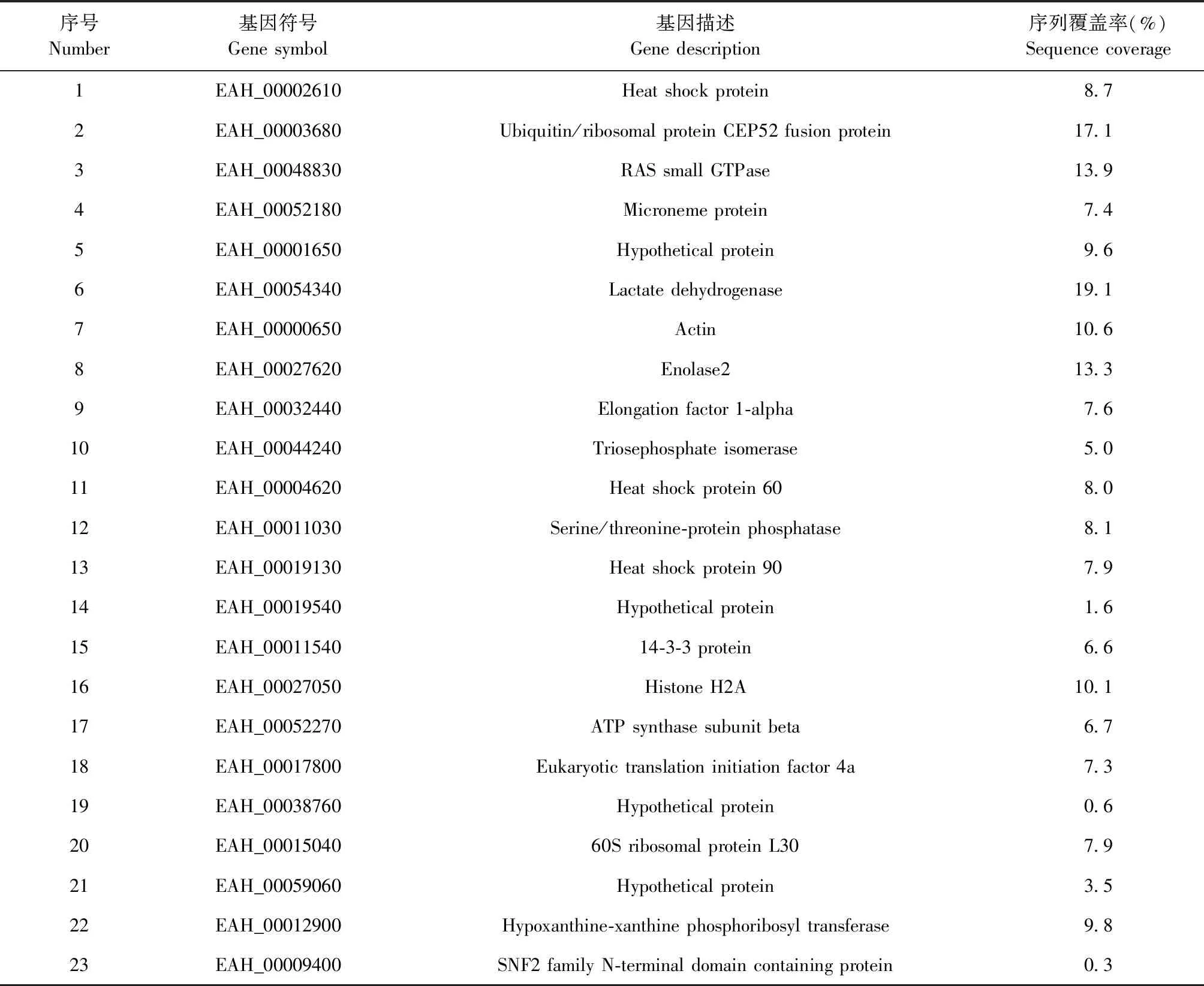
表2 定量蛋白的鉴定结果
3 讨论
流式细胞术具有分析细胞量大、操作简捷和敏感性好等优点,成为了研究细胞凋亡的重要方法之一,可准确检测出细胞凋亡过程中各阶段的情况[9]。Transwell小室可用于建立细胞共培养体系,研究细胞培养液中的成分对细胞生长和运动等的影响[10]。鸡球虫体外入侵试验研究发现,柔嫩艾美耳球虫和堆型艾美耳球虫裂殖子均可以抑制凋亡诱导剂(6%乙醇)诱导的细胞凋亡[7,11]。郑新枫等[12]将柔嫩艾美耳球虫裂殖子与MDBK细胞共培养12 h,发现宿主细胞的Caspase2、3、6、8和9酶活性与对照组相比均显著降低,细胞凋亡受到抑制。本试验结果显示,堆型艾美耳球虫裂殖子与MDBK细胞间接共培养6 h内均可极显著抑制细胞凋亡。以上试验结果说明堆型艾美耳球虫和柔嫩艾美耳球虫可通过相似的作用方式调控宿主细胞的凋亡,为自身在宿主体内进行长期且持续的慢性感染提供保障。
王腾[13]使用Transwell小室将弓形虫与神经干细胞(Neural stem cells,NSCs)共培养,发现弓形虫排泄分泌抗原(Excretory/secretory antigens,ESA)可通过内质网应激信号途径诱导NSCs发生凋亡。毒害艾美耳球虫外泌体(Exosome,Exo)能抑制鸡胚成纤维(Chicken UMNSAH/DF-1,DF-1)细胞发生凋亡,此外,Exo中的钙调蛋白(Calmodulin,CaM)能促进DF-1细胞的增殖,抑制脂多糖(Lipopolysaccharide,LPS)诱导的细胞凋亡[14]。本试验使用Transwell小室建立间接共培养体系,堆型艾美耳球虫裂殖子未直接接触MDBK细胞,鉴定的外分泌蛋白包括热休克蛋白(Heat shock protein,HSP)、微线蛋白(Microneme protein,MIC)、14-3-3蛋白和假定蛋白(Hypothetical protein,HP)等,推测堆型艾美耳球虫可能通过释放外分泌蛋白抑制细胞凋亡。
外分泌蛋白在胞内寄生虫与宿主细胞相互作用中发挥着至关重要的作用[15]。弓形虫外分泌蛋白棒状体蛋白18(Rhoptry protein 18,ROP18)可通过线粒体通路抑制宿主细胞凋亡[16];柔嫩艾美耳球虫外分泌蛋白HP可以诱导鸡巨噬细胞发生凋亡,尤其是早期的细胞凋亡[17]。柔嫩艾美耳球虫和犬新孢子虫均能够通过含EGF样结构域的微线蛋白(Microneme protein containing EGF domain,EGF-MIC)与宿主表皮生长因子受体(Epithelial growth factor receptor,EGFR)相互作用,激活宿主EGFR信号转导,介导丝裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK)、c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)和蛋白激酶B(Protein kinase B,PKB) 等信号通路,进一步调控细胞增殖、凋亡和自噬等生理过程[18-19]。胞内寄生虫HSP90能够与凋亡活化因子-1(Apoptosis active factor-1,Apaf-1)结合,在Cyt-C释放、凋亡体复合物形成和Caspase启动等多个方面发挥抗凋亡作用[20]。李文桂等[21]研究表明,多房棘球绦虫重组BCG-Em14-3-3疫苗能够抑制感染小鼠脾细胞的凋亡。综上所述,本试验堆型艾美耳球虫裂殖子对MDBK细胞凋亡的抑制与鉴定的外分泌蛋白密切相关,后续将对筛选的蛋白在细胞凋亡调节相关通路中发挥的作用和机制进行探究。

