snoRNAs在肝癌中潜在作用的研究进展
宋馨馨,汪旭,2,倪娟

0 引言
小核仁RNA(small nucleolar RNAs, snoRNAs)是最多样化的一类长度约为60~300个核苷酸的非编码RNA(noncoding RNA, ncRNAs),聚集在核仁中[1],主要分为C/D box和H/ACA box两个家族。snoRNAs的主要功能是介导其他RNA的化学修饰,包括核糖体RNA(rRNA)、转运RNA(tRNA)和小核RNA(snRNA)等。snoRNAs通过同源反义元件与靶rRNA分子相互作用,并与核糖核仁蛋白(ribonucleoprotein,RNPs)结合成复合物,共同发挥作用,促进核糖体的成熟和稳定[2]。snoRNAs还有很多其他功能,如染色质结构调节、信使RNA前体(pre-mRNA)的选择性剪接、端粒酶活调节、被加工成更小的miRNA等。此外,一些snoRNA可能还具有其他未知功能[2]。snoRNAs广泛参与许多生理和病理过程。在癌细胞中,异常表达的snoRNAs对rRNA的修饰引起核糖体生物发生的失控,确保蛋白质的持续高产,使细胞快速生长扩散。
snoRNAs经典的调控机制对维护核糖体功能有重要作用,因此,snoRNAs的表达和活性在包括癌症在内的多种人类疾病中均会发生改变。研究snoRNAs揭示了一种新的肿瘤发生途径,为开发新的癌症生物标志物和精准医学治疗提供了新的途径。本文简要综述了snoRNAs的合成、类型、结构和主要生物学功能,重点介绍了snoRNAs在肝癌发生和发展中潜在作用的研究进展。
1 snoRNAs的合成和结构
1.1 snoRNAs的合成
大多数snoRNAs来源于编码基因的内含子区域,少部分是由独立的snoRNAs基因编码,见图1。

图1 snoRNAs的生物合成过程[3] (本图由Figdraw绘制)Figure 1 Biosynthesis of snoRNAs[3] (This image was created by Figdraw)
1.2 snoRNAs的结构特征及分类
snoRNAs按其结构分为C/D box(简称:SNORD)和H/ACA box(简称:SNORA)两个家族。C/D box snoRNAs具有两个高度保守盒序列结构:C box(RUGAUGA)和D box(CUGA),多数还包含C′ box和D′ box。需与四种核糖核蛋白FBL、NOP56、NOP58、SNU13结合,生成snoRNPs(small nucleolar ribonucleoprotein)复合物,参与rRNA 的2′-O-甲基化修饰。H/ACA box snoRNAs包含H box(ANANNA)和ACA box(ANANNN),以及两对发夹结构,与Dyskerin、Gar1、Nhp2和Nop10四种蛋白结合,指导假尿嘧啶化修饰[4]。
2 snoRNAs的多重生物学功能
snoRNAs除了上述主要的2′-O-甲基化和假尿嘧啶化两种修饰功能外,还具有其他多重功能,见图2。

图2 snoRNAs的生物学功能示意图[11] (绘自ScienceSlides Suite)Figure 2 Schematic diagram of biological functions of snoRNAs[11](drawing by ScienceSlides Suite)
snoRNAs可与tRNA互作,修饰tRNA,促进靶tRNA的活性和水平,影响密码子的使用偏好性,促进细胞增殖,以及调节干细胞的发育[5]。定位于Cajal小体(Cajal bodies, CBs)中的scaRNA(small Cajal body-specific RNA)可以引导剪接体snRNA的修饰[6]。由snoRNAs产生的snoRNAs源性小RNA(snoRNA derived small RNA, sdRNA)如miRNA和piRNA,可在基因沉默中发挥功能[7-8]。人类端粒酶RNA中存在一种类似于H/ACA box snoRNAs的结构域,对端粒酶活性维持至关重要[9]。一些snoRNAs还可调节pre-mRNA的可变剪接[10]。
3 snoRNAs在肝癌中的研究进展
肝癌(hepatocellular carcinoma, HCC)是世界范围内致死性较高的恶性肿瘤,目前的治疗方法包括手术、放疗、化疗等,在一定程度上减缓了癌症的发展,然而,由于缺乏早期的筛查标志物,大多数HCC患者被诊断为晚期,缺乏有效的治疗导致高死亡率[12]。目前,在多项研究中表明,snoRNAs在肝细胞癌中具有重要的调控作用,见图3。一些snoRNAs具有致癌潜能,一些则具有抑癌功能。由于它们在血浆、血清和尿液等体液中相对稳定,且容易被检测,所以可以作为疾病诊断和预后的循环生物标志物及潜在的癌症治疗靶点。
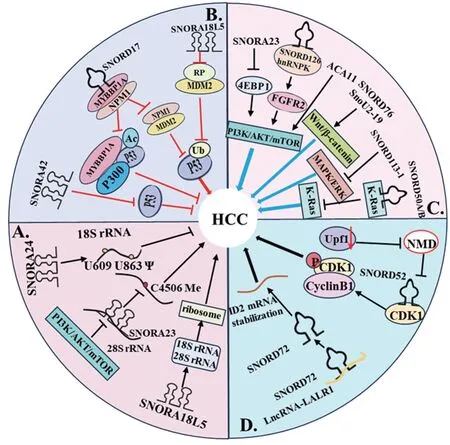
图3 snoRNAs在肝癌中的作用机制Figure 3 Mechanism of action of snoRNAs in liver cancer
3.1 影响核糖体功能
核糖体是在细胞中合成蛋白质的细胞器,由大约80种核糖体蛋白和4种rRNA(5S、5.8S、18S和28S)组成。rRNA在核仁中被加工,在人类核糖体中有超过200个核苷酸的化学修饰,这些修饰对于微调核糖体的结构和功能非常重要。rRNA的修饰可以影响核糖体翻译mRNA的保真度,并与异质性核糖体病变相关,核糖体活性的变化通常与细胞癌变相关[13]。rRNA的甲基化和假尿嘧啶化修饰是由snoRNAs复合物引导的,通过对prerRNA的加工修饰,促进rRNA成熟,从而调控核糖体活性以及蛋白质的产生,在肝癌的发生发展中发挥重要功能。
SNORA24在HCC中显著下调,并与生存期较差相关。癌基因诱导的细胞衰老(oncogeneinduced senescence, OIS)是一种由癌基因的异常激活引起的肿瘤抑制机制[14]。在对RAS诱导衰老的小鼠模型中,通过锁定核酸(locked nucleic acid,LNA)靶向降解SNORA24(LNA-24),可以抑制衰老进程,并与RASG12V协同促进肝癌的发展,使HCC脂质含量增加,其特征与人类脂肪性肝细胞癌相似。SNORA24可引导40S核糖体亚基的18S rRNA的U609和U863两个位点的假尿嘧啶修饰,而Ψ609和Ψ863可以提高翻译的准确性,Ψ609直接参与了密码子-反密码子的识别配对[13]。SNORA24引导的假尿嘧啶修饰改变了核糖体在氨基酰基转移RNA(aa-tRNA)的选择和移位前复合体动力学。在SNORA24低表达的HCC细胞系中发现氨基酸错误掺入的概率增加。因此,HCC中SNORA24的表达降低可能导致特定mRNA的翻译错误,表明了SNORA24在预防致癌损伤方面的作用[13]。
一项研究中,SNORA23在HCC中的表达水平下调,与患者的预后不良相关,且HCC组织中SNORA23的表达显著低于癌旁组织。SNORA23过表达显著抑制了Huh7和SMMC 7721两种细胞系的增殖、迁移和侵袭,敲除则相反。SNORA23的表达受PI3K/AKT/mTOR的调控,可通过互补序列与28SrRNA直接结合,破坏C4506位点的2′-O-甲基化调节核糖体的生物发生过程。此外,SNORA23还可以通过抑制mTOR通路下游特异性转录因子4E结合蛋白1(4E binding protein 1, 4EBP1)的磷酸化抑制PI3K/AKT/mTOR途径,并与雷帕霉素有协同作用,联合使用后,在小鼠肝癌细胞移植肿瘤模型中增强了雷帕霉素的抗肿瘤效果[15]。但在另一项研究中,通过TCGA数据库对比分析发现,与正常组织相比,SNORA23在HCC中上调。在HepG2和Huh-7两种肝癌细胞系中敲除SNORA23后降低了细胞活力,集落形成和淋巴管形成的能力。此外,敲低SNORA23降低了Wnt3a和β-catenin表达水平,从而下调Wnt/β-catenin信号通路,证明了SNORA23通过调节Wnt/β-catenin通路促进肝细胞癌的进展[16]。
SNORA18L5(H/ACA box 18-like 5)在HCC中起致瘤作用,SNORA18L5过表达可显著促进18SrRNA和28SrRNA成熟,增加核糖体的生物发生,从而改变了核糖体蛋白RPL5和RPL11的定位,使其定位于核仁,无法与MDM2结合并抑制其活性,导致MDM2介导的p53蛋白水解增加,从而促进HCC进展[17]。
3.2 调节p53蛋白
p53作为一种重要的肿瘤抑制因子,在被激活后可以诱导癌细胞的细胞周期阻滞、细胞凋亡以及衰老等生物过程,进而抑制癌细胞的进展[18]。p53可直接结合调控FBL,从而抑制rRNA甲基化修饰,介导核糖体生物发生以及mRNA翻译过程[19]。p53经常在癌症中功能失调,是常见的突变蛋白之一。一些snoRNAs在调控p53通路中发挥重要作用。
在HCC组织和细胞中,SNORA42的表达明显高于正常肝组织和细胞,且SNORA42过表达与HCC患者的预后不良相关。敲低SNORA42后,显著抑制了SK-Hep1和HCCLM9两种肝癌细胞系的细胞周期,抑制了细胞的迁移和侵袭,促进细胞凋亡,过表达SNORA42则产生相反的结果,说明SNORA42在HCC中起致瘤作用。敲低SNORA42的细胞系与对照组相比,有差异表达的基因在细胞周期和p53信号通路中富集。并且,SNORD42敲低后的肝癌细胞系中TP53和p21表达水平明显降低,而过表达SNORA42的结果与之相反,说明SNORA42通过抑制p53信号通路促进HCC进展[20]。
SNORD17在多种人类肿瘤中起致癌作用,在肝癌中SNORD17过表达,将敲除SNORD17的HepG2细胞(HepG2-KO)和对照组(HepG2-WT)移植到小鼠中,HepG2-KO显著降低了原位肝癌的肿瘤体积和重量,说明SNORD17促进了体内的肿瘤发生和转移[21]。对比敲除SNORD17后差异表达的基因后发现,p53信号通路与SNORD17的表达呈负相关。SNORD17可与MYB结合蛋白1A(MYB binding protein 1A, MYBBP1A)和核磷蛋白1(Nucleophosmin 1, NPM1)结合,并将两种蛋白锚定在核仁中,使其不能够转运至细胞质,从而抑制了NPM1/MDM2的结合,促进MDM2对p53的降解作用,以及抑制了MYBBP1A/p300介导的p53激活[21]。此外,在SNORD17的启动子区域,还存在p53的结合位点,p300介导的p53乙酰化可以反过来结合SNORD17的启动子,抑制SNORD17的表达,而p53的减少又增强了SNORD17的表达。SNORD17和p53之间的这种相互调节形成了一个促进肿瘤发生发展的正反馈循环[21]。
3.3 调节信号通路
一些参与细胞增殖、存活、分化和凋亡的信号通路如Wnt/β-catenin、PI3K/Akt、MAPK/ERK等在HCC中通常被激活,发挥促癌作用[22]。许多snoRNAs可以通过直接或间接调控信号通路影响肿瘤的进展。
SNORD126过表达增加了AKT、GSK-3β和p70S6K的磷酸化水平,并升高了成纤维细胞生长因子受体2(fibroblast growth factor receptor 2,FGFR2)的表达[23], FGFR2可以激活PI3K-AKT通路[24]。进一步研究发现,SNORD126通过结合hnRNPK蛋白,然后募集到FGFR2的启动子上,促进其转录,激活PI3K-AKT通路,发挥致癌作用[25]。丙型肝炎病毒(Hepatitis C virus,HCV)感染是HCC发展的主要原因之一, SNORD126过表达促进了HCV感染,敲除则相反,其可能通过激活PI3K-AKT通路,增加紧密连接蛋白(claudin-1,CLDN1)表达,促进HCV进入宿主细胞[26]。
在Huh7细胞中过表达孤儿snoRNA ACA11上调了p-PI3K和p-AKT、cyclinD1以及间质标志物纤连蛋白(fibronectin)、N-钙黏蛋白(N-cadherin)、波形蛋白(vimentin),而下调了上皮标志物(claudin-1),在PI3K抑制剂LY294002处理过表达ACA11的Huh7细胞后,显著降低了p-PI3K和p-AKT的水平,并抑制了癌细胞的增殖、迁移和侵袭,表明ACA11通过激活PI3K/AKT通路促进细胞生长、迁移和侵袭,进而增加cyclinD1表达,诱导EMT[27]。SNORD76在HCC中明显上调,敲低后可显著降低Huh7细胞中β-catenin、c-Myc和cyclinD1的表达水平,过表达则相反,表明SNORD76可以通过激活Wnt/β-catenin信号通路,促进HCC的致瘤性[28]。此外,snoU2-19也可以激活Wnt/β-catenin信号通路促进HCC细胞周期,抑制细胞凋亡[29]。
SNORD113-1具有抑癌作用,在HCC中表达显著下调,并与患者的较差生存率显著相关。在SNORD113-1基因的启动子区域的CpG甲基化在HCC肿瘤组织中高于癌旁组织。SNORD113-1通过抑制MAPK/ERK和TGF-β信号通路中ERK1/2和SMAD2/3的磷酸化而发挥作用[30]。SNORD50A/B通常被认为具有抑癌功能,在癌细胞中经常缺失,其缺失与癌症患者的生存率降低有关。研究发现,SNORD50A/B缺失后,使K-Ras的活性增加,从而造成Ras-ERK1/ERK2过度激活,后又发现SNORD50A/B通过与K-Ras结合并抑制其活性,发挥抑癌作用[31]。
3.4 其他调控方式
ID2(inhibitor of DNA Binding 2)可以通过抑制转录因子与DNA的结合来影响细胞生长和分化,研究发现,ID2可以促进HCC细胞增殖、抑制细胞凋亡、诱导侵袭转移。lncRNA-LALR1可以直接结合并上调SNORD72,不影响核糖体的生物发生,而是通过上调ID2并稳定ID2 mRNA,促进肿瘤生长和侵袭[32]。SNORD52在肝癌组织中高表达,并与患者预后密切相关。无义介导的mRNA降解途径(nonsense-mediated mRNA decay,NMD)是一种RNA监测机制,能够识别并降解开放阅读框中含有提前终止密码子(premature termination codon, PTC)的mRNA,Upf1(Up frameshift protein1)介导NMD,可将其招募至含PTC的mRNA上,从而激活降解[33]。启动子区域的甲基化导致Upf1下调,抑制了NMD进展,从而不能识别和降解SNORD52,致使SNORD52过表达,SNORD52与CDK1(cyclin dependent kinase 1)结合降低了CDK1泛素化和蛋白酶体降解,增加了磷酸化水平,增强了CDK1蛋白水平及稳定性,从而促进细胞周期,最终促进肝癌的发生[34]。还有部分snoRNAs在HCC中存在表达差异,其中SNORD78、SNORD105等在HCC中表达上调,SNORA31、SNORA52、SNORA71等在HCC中表达下调,但目前其在肝癌中的调控机制并不明确,还需进一步研究[35]。
4 总结与展望
随着高通量测序技术的发展,越来越多的研究证实了snoRNAs在癌症中的差异表达,并可通过多种途径调控肿瘤发展。鉴于其致癌及抑癌潜能,并容易在体液中被检测到,可作为疾病诊断和预后的标志物及治疗的新靶点。
目前,还有多种snoRNAs已被发现可以调控癌症的进展,但其作用机制还不明确需要进一步探索。随着对snoRNAs的研究不断深入,我们对其在肿瘤中功能和机制的理解也将不断加深。未来的研究可进一步探寻snoRNAs新的作用机制,并开发相关的治疗策略,为肿瘤的预防和治疗提供新的思路和方法。
利益冲突声明:
所有作者均声明不存在利益冲突。

