慢性饥饿应激通过增强ITGB1表达促进结直肠癌细胞迁移
李思雨,曹静桦,王凤伟
0 引言
结直肠癌(colorectal cancer, CRC)是消化道最常见的恶性肿瘤之一,如何提高其早期诊断率及有效抑制肿瘤细胞的侵袭和转移,已成为医学研究亟需解决的关键科学问题。肿瘤进展是一个多阶段的复杂过程,期间肿瘤细胞经常处在缺氧、营养缺乏、酸中毒等应激条件下[1]。传统观点认为营养缺乏会显著降低细胞基础活动,但有越来越多的研究[2-4]发现,肿瘤细胞可能在营养缺乏条件下仍维持生存并进行侵袭和迁移。血清作为多种蛋白、生长因子、细胞因子和激素的来源[5],对促进肿瘤细胞的生长和增殖具有重要作用。血清饥饿(血清剥夺)模型是一种模拟肿瘤营养缺乏环境的体外模型,指用低于正常培养基的胎牛血清浓度(通常为0.5%~5%)来培养细胞,但注意血清的完全缺乏对细胞有不可逆的毒性作用[6]。已有文献报道,急性血清饥饿作为一种应激条件,会增加结直肠癌侧群细胞的比例及对化疗药物的抵抗[7],被广泛应用于细胞周期[8]、自噬[9]及凋亡[10]等研究中。考虑到肿瘤作为一种慢性疾病,其细胞在生长过程中通常长期处于营养缺乏状态,因此采用长期血清饥饿模型能更准确地模拟其体内环境。本研究针对两种常见结直肠癌细胞系构建了长期血清饥饿诱导的亚株,旨在探究慢性血清饥饿的应激条件对结直肠癌细胞生物学功能的影响及潜在分子机制,从而为阐明结直肠癌的发展机制提供新的视角和实验基础。
1 材料与方法
1.1 材料与试剂
结直肠癌细胞系DLD-1、SW480分别购自美国ATCC细胞库和中国科学院细胞库;RPMI1640培养基、胎牛血清购自美国Thermo Fisher Scientific公司;CCK-8试剂盒(HY-K0301)和Stattic试剂(HY-13818)均购自美国MCE公司;8 μm Transwell小室(美国Falcon,353097);RNA快速提取试剂盒(B0004D)和SYBR qPCR试剂盒(A0012-R2)均购自美国EZB公司;预混型定量用反转录试剂盒(日本TAKARA公司,RR036A);jetPRIME转染试剂(法国Polyplustransfection);哺乳动物细胞核蛋白和细胞浆蛋白提取试剂盒(北京全式金生物,DE201-01);BCA蛋白浓度测定试剂盒(GK10009)和ECL超敏化学发光试剂盒(GK10008)均购自美国GLPBIO公司;蛋白酶抑制剂(江苏康为世纪公司,CW2200S);Omni-Easy一步法PAGE凝胶快速制备试剂盒(上海Epizyme, PG211);Anti-Integrin Beta 1(武汉Proteintech, 12594-1-AP);Anti-FAK(A11195)、Anti-phospho-FAK-Y397(AP1447)和Anti-STAT3(A1192)均购自武汉ABclonal公司。
1.2 细胞培养与低血清耐受细胞亚株的构建
SW480和DLD-1细胞在37℃、5%CO2培养箱内培养。正常血清培养组细胞用含10%FBS的RPMI 1640培养液维持培养,血清饥饿组细胞在细胞状态良好(细胞无明显空泡、边缘不清晰、黑点和碎片多等)的情况下将血清浓度从10%FBS依次降至7.5%FBS、5%FBS、2%FBS和1%FBS,32天后细胞基本适应1%FBS的生长环境。定义适应1%FBS培养的细胞为血清饥饿细胞(SW480-1%和DLD-1-1%),保持10%FBS培养的细胞为对照细胞(SW480 WT和DLD-1 WT)。
1.3 细胞增殖能力测定
分别将血清饥饿组DLD-1-1%、SW480-1%细胞株和对照组SW480、DLD-1细胞接种于96孔板,12 h待细胞贴壁后加入含10% CCK8的无血清培养基,置于培养箱孵育2 h后用酶标仪检测吸光度,同一时间点连续检测7天,根据检测结果绘制细胞生长折线图。
1.4 细胞迁移能力检测
使用Transwell小室(8 μm),上室加入以无血清RPMI1640重悬的2×104个/ml细胞悬液250 μl,下室加入含5%FBS的RPMI1640培养液500 μl,置于培养箱中培养36~48 h。取出小室进行甲醇固定30 min,结晶紫染色10 min,无菌棉签小心擦净上室侧细胞,显微镜下观察下室侧细胞,并拍照记录迁移情况。
1.5 细胞转染及给药
分别将血清饥饿组DLD-1-1%、SW480-1%细胞株和对照组DLD-1、SW480细胞消化收集后以30%的细胞密度接种于六孔板中,待细胞贴壁后加入siRNA与转染试剂混合物,转染6~8 h后换液,48 h后收集细胞。取相同数量的血清饥饿组和对照组细胞以80%的细胞密度接种于6孔板中,待细胞贴壁后加入稀释后的STAT3抑制剂Stattic,使药物终浓度为5 μmol/L,24 h后收集细胞。本研究使用的siRNA通过NCBI Blast确认靶点特异性,由锐博生物合成,见表1。
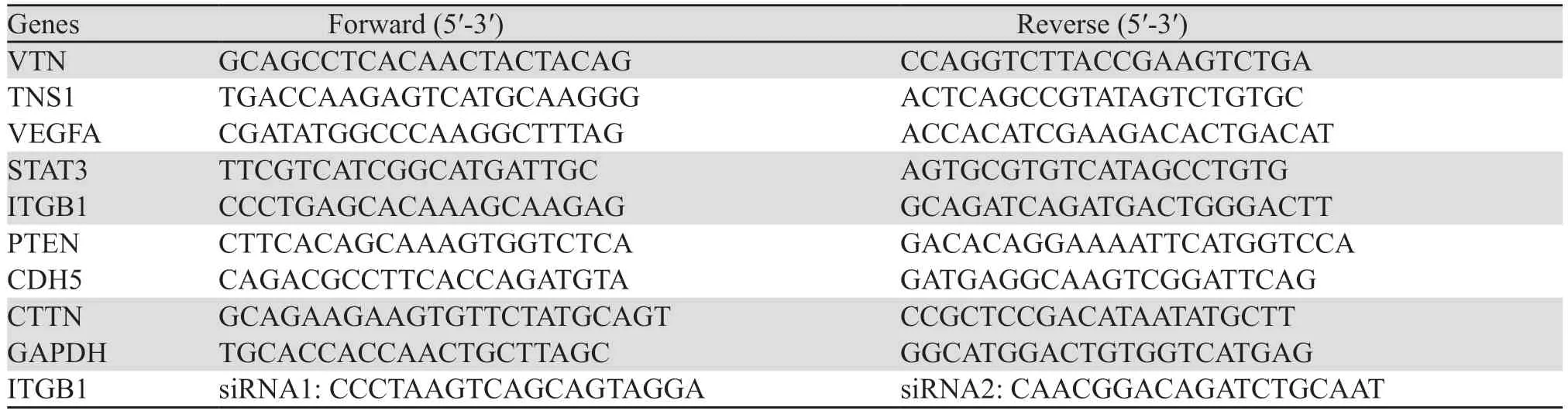
表1 本研究使用的引物和siRNA序列Table 1 Primer and siRNA sequence used in this study
1.6 RNA提取及定量分析
取6 cm培养皿中处于对数生长期的血清饥饿组DLD-1-1%、SW480-1%细胞株和对照组DLD-1、SW480细胞,弃培养基后加入PBS充分清洗,再加入RNA提取裂解液充分吹打,按说明书步骤提取RNA,得到的RNA样品用Nanodrop微量分光光度计进行定量和质量评估。整个操作过程处于无RNA酶、DNA酶污染环境下。
1.7 实时荧光定量PCR检测
取2 μg RNA样品,用PrimeScript™ RT Master Mix配制成20 μl反转录体系,置于PCR仪进行反转录反应,程序为:37℃ 15 min,85℃ 15 s,4℃暂存。得到的cDNA样品用ddH2O进行稀释,并配制SYBR Green qPCR Mix、特异性引物及ddH2O混合液,按顺序定量加至Bio-Rad 96孔qPCR板中,每个样品设三个复孔,离心后置于Roche实时荧光定量PCR仪中进行检测,反应程序为:95℃预变性5 min,PCR反应 95℃ 10 s,60℃ 10 s,72℃15 s,循环40次,72℃彻底延伸5 min,最后65℃~95℃绘制溶解曲线。本研究使用的引物序列查询自Primer Bank,经NCBI Blast匹配,由擎科生物合成,见表1。
1.8 细胞核蛋白和细胞浆蛋白提取
收集10 cm培养皿中处于对数生长期的细胞,按照全式金核浆分离试剂盒说明书进行操作,提取的细胞核蛋白和细胞浆蛋白经BCA法测浓度后配成相同浓度蛋白样品,随后进行Western blot实验。
1.9 Western blot检验
收集处于对数生长期的细胞,PBS洗两次后加入IP裂解液,冰上裂解30 min,随后4℃12 000 r/min离心20 min,取上清液用BCA法测定蛋白浓度,将每组样品统一配置成3 μg/μl的浓度。使用凝胶快速制备试剂盒配置10%浓度的SDS-PAGE胶,每个样品取相同蛋白量进行上样,以90 V恒压进行电泳30 min,随后加大电压至120 V,当溴酚蓝条带即将跑出凝胶时停止电泳。以250 mA恒流转膜2 h,5%脱脂牛奶封闭PVDF膜1 h,4℃一抗孵育过夜。次日TBST洗3遍,二抗室温孵育1 h,TBST洗3遍,最后加ECL发光液进行曝光。
1.10 RNA-Seq数据分析
本研究委托武汉康测科技有限公司进行RNA建库测序,获得的原始数据经过滤、比对人类全基因组、基因表达定量从而得到差异基因表达数据,使用metascape基因注释网站进行GO和KEGG富集分析,输出结果利用R语言的dplyr函数、DOSE包和ggplot包绘制富集气泡图,利用R语言的circlize包和ComplexHeatmap包绘制环状热图。从String数据库下载蛋白互作信息,导入Cytoscape并使用CytoHubba插件绘制核心基因互作图。
1.11 统计学方法
使用ImageJ软件进行Transwell小室细胞计数及Western blot灰度值定量,GraphPad Prism 8软件进行统计学分析及绘图,采用Student′st-test检验对两组间的差异进行分析,P<0.05为差异有统计学意义。
2 结果
2.1 长期血清饥饿耐受细胞亚株形态
显微镜下观察可见10%FBS培养的SW480呈三角形、梭形或圆形,边缘锐利。长期血清饥饿后细胞体积增大,边缘变模糊毛糙,核浆比增大,细胞密度提高时聚集性更加明显。10%FBS培养的DLD-1呈不规则梭形,血清饥饿后细胞形态大小不一,部分细胞突出增多,见图1。
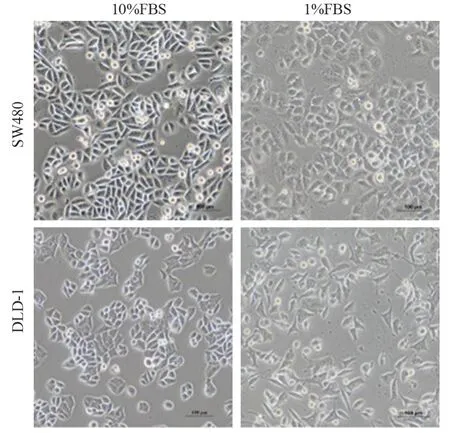
图1 长期血清饥饿后肠癌细胞形态变化Figure 1 Morphological changes of colorectal cancer cells after prolonged serum deprivation
2.2 长期血清饥饿对SW480及DLD-1细胞增殖的影响
CCK-8实验结果显示:血清饥饿的SW480和DLD-1细胞增殖能力明显弱于对照组细胞,差异有统计学意义(均P<0.05),见图2。
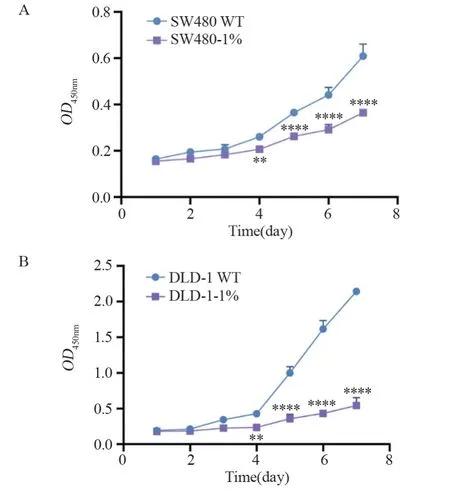
图2 长期血清饥饿对SW480和DLD-1细胞增殖能力的影响Figure 2 Impact of prolonged serum deprivation on proliferation capacity of SW480 and DLD-1 cells
2.3 长期血清饥饿对SW480及DLD-1细胞迁移的影响
Transwell实验结果显示:血清饥饿减弱了DLD-1细胞的迁移能力,差异有统计学意义(P<0.0001);但血清饥饿的SW480迁移能力明显强于对照组,差异有统计学意义(P=0.0004),见图3。以上结果提示,在肿瘤进展的过程中,肿瘤中的部分癌细胞可以耐受长期的营养匮乏并在其刺激下获得更强的迁移能力,这可能是肿瘤转移及复发的重要原因之一。

图3 长期血清饥饿对SW480和DLD-1细胞迁移能力的影响Figure 3 Effect of prolonged serum deprivation on migration of SW480 and DLD-1 cells
2.4 RNA-Seq差异基因分布特征
为探索SW480耐受血清饥饿并获得更强迁移能力的潜在分子机制,我们对血清饥饿及对照的SW480细胞进行转录组测序,实验组和对照组每组细胞设置两个生物学重复。主成分分析(PCA)显示组内两个样本分布较为聚集,见图4A,提示实验重复性好;组间样本分布散在,具有较好的区分度,提示血清饥饿对细胞的基因表达有显著调控。以|log2FC|>1且FDR<0.05为阈值,筛选出6 486个差异基因,其中血清饥饿诱导3 016个基因表达上调,3 470个基因表达下调,见图4B。
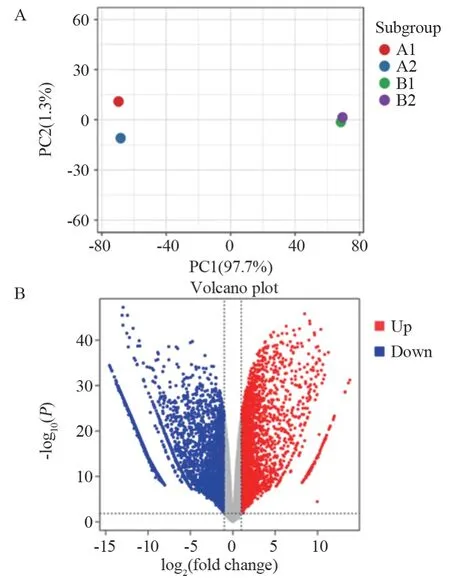
图4 SW480细胞转录水平差异基因分布特征Figure 4 Distribution characteristics of differentiallyexpressed genes (DEGs) in SW480 cells
2.5 RNA-Seq差异基因富集分析
对长期血清饥饿诱导上调的3 016个差异基因进行GO和KEGG富集分析。GO数据库分别从细胞组分(cellular component, CC)、分子功能(molecular function, MF)和生物过程(biological process, BP)3个角度对基因进行注释,富集到细胞增殖负调控、细胞迁移正调控、细胞运动、血管形成等生物过程相关的基因,KEGG通路分析主要富集到细胞黏附分子相关通路,这与观察到的功能实验相一致,提示高通量测序数据具有较高的可信度,结果见图5。
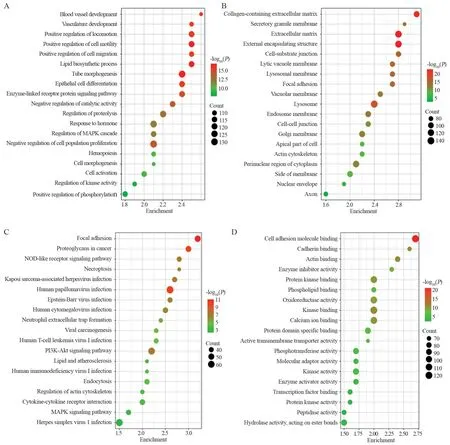
图5 差异表达基因GO和KEGG富集分析Figure 5 GO and KEGG enrichment analyses of differentially-expressed genes
2.6 长期血清饥饿上调SW480细胞迁移相关基因表达
选取GO富集分析中与细胞迁移相关的283个基因,见图6A。为进一步筛选其中发挥潜在介导作用的关键分子,我们使用String在线数据库分析了283个迁移相关基因的蛋白互作信息。该组基因导入Cytoscape软件后,采用拓扑分析方法Ec-Centricity筛选出互作网络中排名前20位的潜在关键基因,见图6B。随后对评分最高的16个核心基因进行qPCR验证,见图7,发现血清饥饿的确在SW480中上调了VTN、TNS1、VEGFA、STAT3、ITGB1、PTEN、CDH5和CTTN等基因的mRNA表达水平,差异具有统计学意义(P<0.0001)。
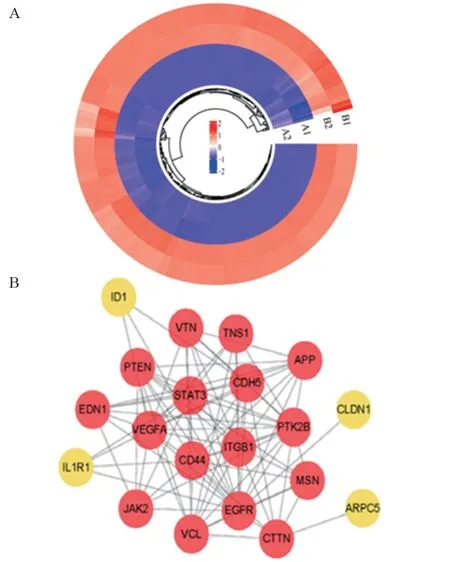
图6 SW480细胞迁移相关差异基因分析Figure 6 Analysis of migration-related DEGs in SW480 cells

图7 长期血清饥饿上调SW480细胞转录核心基因mRNA水平Figure 7 Prolonged serum starvation upregulated the mRNA levels of the SW480 cell transcriptome core gene
2.7 长期血清饥饿上调SW480 ITGB1/p-JAK2/p-STAT3/MMP2蛋白表达
为了找到促进SW480迁移的关键介导分子,我们采用Western blot实验来检测迁移相关核心基因的表达,并通过文献阅读初步确认了ITGB1的重要性。随后,我们检测了文献中报道的ITGB1相关通路FAK-SRC和JAK2-STAT3的关键激酶蛋白表达和磷酸化水平,见图8。血清饥饿上调SW480 ITGB1、p-JAK2、p-STAT3(Tyr705)、p-STAT3(Ser727)、STAT3、MMP2蛋白表达,下调p-FAK表达水平,差异具有统计学意义(均P<0.05)。通过核浆分离实验发现血清饥饿后SW480 STAT3转录因子入核增多,而DLD-1 STAT3核浆蛋白水平不受血清饥饿的影响,见图9。

图8 长期血清饥饿上调SW480细胞ITGB1/p-JAK2/p-STAT3/MMP2蛋白表达Figure 8 Prolonged serum starvation promoted the protein expression of ITGB 1/p-JAK2/p-STAT3/MMP2 in SW480 cells

图9 长期血清饥饿促进SW480细胞STAT3转位进入细胞核Figure 9 Prolonged serum starvation promoted STAT3 translation to the nucleus in SW480 cells
2.8 敲降ITGB1和使用STAT3抑制剂减弱血清饥饿SW480的迁移能力
为探究上调的ITGB1和STAT3的磷酸化水平对SW480的影响,采用Transwell实验验证血清饥饿组和对照组细胞转染siRNA或加入5 μmol/L STAT3抑制剂(stattic)后迁移能力的变化。ITGB1的敲降效果和stattic抑制STAT3磷酸化的作用见图10A~B。敲降ITGB1能减弱血清饥饿SW480细胞的迁移能力,而正常血清组不受影响,见图10C。5 μmol/L stattic作用24 h均能抑制两组细胞的迁移能力,并且对血清饥饿SW480迁移能力的抑制作用相较于对照组更显著,见图10D,差异有统计学意义(均P<0.05)。
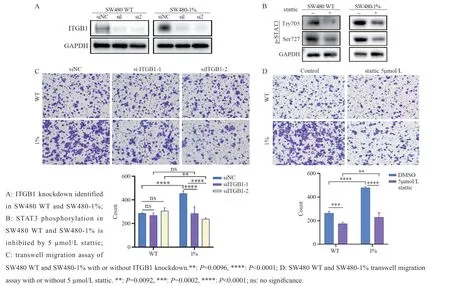
图10 敲低ITGB1和使用STAT3抑制剂减弱血清饥饿SW480细胞的迁移能力Figure 10 Knockdown of ITGB1 and use of STAT3 inhibitor reduced the migration capacity of serum-starved SW480 cells
3 讨论
肿瘤细胞在生长、迁移、侵袭的过程中持续受到不利环境条件的刺激[11],尤其是营养物质的匮乏。为探索其对肿瘤细胞生物学功能的影响及机制,目前研究主要利用葡萄糖剥夺、氨基酸剥夺、血清饥饿等体外模型来模拟体内肿瘤的营养缺乏状态。
为揭示长期营养匮乏对结直肠癌细胞生物学功能的影响,我们构建了1%FBS耐受细胞亚株SW480-1%和DLD-1-1%,并对其增殖、迁移能力进行检测。长期血清饥饿导致SW480和DLD-1细胞增殖能力下降,这可能主要归因于培养基中营养和生长因子的不足,但也可能涉及其他机制。例如,研究发现肠癌细胞HD6在低血清条件下培养48小时会上调Mirk表达,通过降低cyclin D1的稳定性使细胞停留在G0期,从而抑制了其生长[12]。值得注意的是,长期血清饥饿减弱DLD-1的迁移能力,但增强SW480的迁移能力。为了探究其潜在的分子机制,我们分别对DLD-1、SW480的血清饥饿组及对照组细胞进行转录组测序,DLD-1转录组分析未得到显著差异,而SW480转录组差异基因富集到细胞迁移正调控通路。基于283个迁移相关且表达上调的基因,我们构建迁移相关基因核心蛋白互作网络,并选取评分最高的16个基因进行qPCR验证。相较于对照组细胞,血清饥饿细胞的VTN、TNS1、VEGFA、STAT3、ITGB1、PTEN、CDH5和CTTNmRNA表达水平显著上调。通过相关文献回顾,我们发现此组基因在多种癌种中具有显著促转移的作用。结合蛋白表达水平验证,我们初步确定了ITGB1作为进一步研究的分子。
ITGB1基因编码Integrin Subunit Beta 1,属于整合素家族。该家族是一组由18种α亚基、8种β亚基组合形成的糖基化异二聚体跨膜蛋白,不仅作为胞膜受体参与细胞黏附和分子识别,同时参与细胞增殖、迁移和侵袭等多种生命活动[13]。研究显示,ITGB1的高表达与胃癌患者的不良预后和高复发率紧密相关[14],并在乳腺癌与胶质瘤的恶性进展中,特别是在侵袭、转移和血管生成方面发挥关键作用[15-16]。Chang等通过对微阵列数据进行生信分析及临床样本验证,提出ITGB1可作为预测结直肠癌患者预后的新指标[17]。在我们的研究中,长期血清饥饿显著上调了SW480细胞中的ITGB1表达,而对DLD1细胞无明显影响,这表明血清饥饿可能通过增强ITGB1的表达来增强SW480细胞的迁移能力。整合素负责介导细胞内外的双向信号传递。当细胞受到外界刺激时,整合素从折叠状态变为活性形式,其胞外段与细胞外基质的配体蛋白结合,驱动整合素形成蛋白簇,胞内段则与支架蛋白、细胞骨架蛋白和信号蛋白等相互作用,形成复杂而动态的结构黏附体,进而触发下游信号的激活[18]。虽然FAK-SRC是整合素介导细胞迁移的经典激酶家族,但我们的实验排除了ITGB1通过促进FAK第397位酪氨酸磷酸化激活FAK-SRC从而调节细胞迁移的可能性。文献表明,整合素能够激活多条信号通路,如PI3KAKT、MAPK-ERK和JAK-STAT,进而促进细胞的生存、增殖和迁移[19],此前的生物信息学分析也提示迁移相关的核心基因包括JAK2和STAT3。在后续的实验中,我们观察到血清饥饿SW480细胞的确激活了JAK2-STAT3信号通路,导致STAT3的磷酸化并入核,从而促进了MMP2等迁移相关正向调控蛋白的表达。通过敲降ITGB1和使用STAT3抑制剂,我们观察到在血清饥饿条件下增强的SW480细胞迁移能力被有效抑制,并且敲降ITGB1的效果更为显著,这表明ITGB1的上调除了激活JAK2-STAT3信号通路外,还可能通过其他分子途径影响细胞迁移。
总之,本研究发现结直肠癌细胞可耐受慢性饥饿应激,并通过上调ITGB1增强其迁移能力,提示应激条件可能促进癌细胞的恶性表型,为理解体内应激条件对肿瘤细胞的影响提供了实验基础。此外,尽管STAT3作为肿瘤药物研发的重要靶点,近20年来已有多种抑制剂进入临床试验,但受限于药效、不良反应等原因治疗方案尚未获得FDA批准[20]。本研究发现低浓度STAT3抑制剂对迁移能力更强的血清饥饿细胞有更好的抑制作用,提示STAT3抑制剂可能对恶性倾向更显著的结直肠癌细胞有同样甚至更好的治疗效果,为了解肿瘤异质性与STAT3信号通路的关系提供了新的线索。不足的是,关于慢性饥饿应激是通过何种机制促进ITGB1表达,以及ITGB1调节JAK2激酶活性的具体机制仍有待探索。
利益冲突声明:
所有作者均声明不存在利益冲突。

