Lnc-BM通过FASTK/MT-ND6轴调节线粒体呼吸功能促进胃癌进展
张明月,陈晨,王萌,王守宇
0 引言
胃癌是全球第五大常见肿瘤,死亡率居全球前三,是威胁人民健康的重要疾病之一[1-2]。随着高通量测序技术的提高,人们发现基因突变、基因表达差异以及表观遗传的改变对胃癌发生发展影响巨大[3]。因此,在分子水平上探究胃癌的发病机制,寻找新的分子标志物和治疗靶点对于提高胃癌诊疗水平具有重要的意义。
哺乳动物基因组存在编码基因和非编码基因,而非编码基因占整个基因组98%以上[4]。非编码RNA可以分为短链非编码RNA(长度<200 bp)和长链非编码RNA(长度>200 bp),其中长链非编码RNA(lncRNA)不仅可以调节自身转录位点附近的基因表达,还可以与远处的转录因子或细胞质中蛋白相互作用[5]。在前期研究中,我们在三阴性乳腺癌细胞中发现一种与乳腺癌脑转移相关的lncRNA,命名为Lnc-BM(long noncoding for brain metastasis),其主要定位于细胞质并具有较低的蛋白编码潜力。通过研究,我们发现Lnc-BM通过激活JAK2-STAT3信号通路,促进下游细胞黏附分子1(intercellular adhesion molecule 1, ICAM1)和趋化因子配体2(C-C motif chemokine ligand 2, CCL2)的表达。ICAM1促进乳腺癌细胞黏附到脑血管,CCL2促进巨噬细胞招募并分泌抑瘤素M(oncostatin M, OSM)和白细胞介素6(interleukin 6,IL-6)进一步激活JAK2信号通路,促进乳腺癌细胞脑转移[6]。目前,Lnc-BM在其他肿瘤发生发展中的作用机制还不清楚,值得深入研究。
线粒体是生物能量和生物合成的细胞器,线粒体功能障碍会导致发育功能异常,代谢系统紊乱以及肿瘤等多种疾病的发生[7]。2008年Ghezzi团队发现Fas激活的丝氨酸/苏氨酸激酶家族(fasactivated serine/threonine kinase, FASTK)中的FASTKD2定位于线粒体基质,可以参与调节线粒体功能[8]。最近研究表明,FASTK蛋白均可以定位于线粒体基质,是线粒体基因表达的关键转录后调节因子[9]。线粒体编码的NADH脱氢酶6(MT-ND6)参与线粒体电子传递和线粒体呼吸链复合体Ⅰ的组装[10],FASTK可以作用于MTND6 mRNA的3′端通过增强其稳定性提高MTND6蛋白表达水平[9]。TOM20是线粒体蛋白转运TOM复合体的亚基,可直接识别具有N端前导序列的前体蛋白,然后与TOM40形成蛋白复合体。TOM20代谢异常会导致线粒体相关疾病的发生,可作为线粒体相关的功能性蛋白[11]。
Lnc-BM是一种与肿瘤转移密切相关的LncRNA,但其是否会影响胃癌或其他肿瘤的进展,目前尚不清楚。因此,本研究将探讨Lnc-BM对胃癌增殖、迁移和侵袭能力的影响,并探索其分子机制,为胃癌临床诊断寻找新的生物标志物和治疗靶点。
1 资料与方法
1.1 组织样本
收集在江苏省南京大学医学院附属鼓楼医院手术并经病理诊断明确的36例胃癌患者的胃癌组织及癌旁正常组织。本研究经南京大学医学院附属鼓楼医院伦理委员会批准(审批号:2023-016-02),所有患者及其家属知情并签署同意书。
1.2 细胞
人胃上皮细胞(GES-1、BGC823、SGC 7901、NCI-N87、MKN74)购自中国科学院上海细胞生物研究所。
1.3 实验试剂
RPMI1640、Opti-MEM培养基、胰酶、PBS、青链霉素、胎牛血清(维森特生物);FISH试剂盒(广州锐博生物);RT SuperMix反转录试剂盒、ChamQ SYBR qPCR Master Mix(南京诺唯赞生物);Western及IP细胞裂解液、结晶紫染液、BCA蛋白浓度测定试剂盒(碧云天生物);蛋白酶抑制剂、磷酸酶抑制剂(Bimake);ECL化学发光检测试剂盒(美国BIORAD);Transwell小室(美国Corning)。FASTK抗体(PA5-21449,Invitrogen);MT-ND6抗体(DF9676,Affinity Biosciences);TOM20抗体(66777-1-Ig,Proteintech);Tubulin抗体(AF0001,碧云天);辣根过氧化物酶(HRP)标记的山羊抗小鼠/兔二抗(1:1500,碧云天)。商品化GST-FASTK重组蛋白购自Abnova公司(H00010922-P01)。Lnc-BM和FASTK的siRNA合成委托广州锐博生物有限公司。
1.4 实验方法
1.4.1 细胞培养 上述细胞用含10%胎牛血清以及1%青霉素和链霉素的RPMI1640培养液培养在37℃、5%CO2环境的培养箱中。
1.4.2 siRNA及慢病毒转染实验 在6孔板中接种适宜密度的细胞,待细胞恢复正常形态后进行转染实验。在200 μl Opti-MEM培养基中分别加入siRNA(50 pmol)或2.5 μl Dharmacon转染试剂,混匀,静置5 min。然后将两管溶液混匀,静置20 min后缓慢滴加至6孔板中,48 h后完成转染进行后续实验。使用完全培养基将病毒稀释至适宜浓度,与病毒感染试剂polybrene混匀后加入目的细胞,72 h后完成感染,使用1 μg/ml嘌呤霉素筛选细胞并进行验证。
1.4.3 RT-qPCR实验 使用TRIzol提取目的RNA,测定浓度。按照10 μl体系(2 μl的5×Supermix、500 ng RNA以及适量无酶水)反转录合成cDNA,程序如下:37℃ 15 min;85℃ 5 s。然后进行RTqPCR反应,5 μl SYBR、0.2 μl正向引物、0.2 μl反向引物、3.6 μl无酶水以及1 μl的cDNA。RT-qPCR扩增程序:50℃ 2 min;95℃ 10 min;95℃ 15 s;60℃ 1 min;95℃ 15 s;60℃ 15 s;95℃ 15 s,共循环40次。平行样本的Ct值取均值,采用2-ΔΔCt的方法分析,引物序列如下:Lnc-BM的正向引物:5’-GTGGTTGTCAAAGGCAGTCA-3’,反向引物5’-AACACTGGGAGAGGATTGGG-3’;GAPDH的正向引物:5’-CATGTGGGCCATGAGGTCCACCAC-3’,反向引物:5’-GGGAAGCTCACTGGCATGGCCTTCC-3’。
1.4.4 蛋白免疫印迹实验 在细胞样品中加入适量RIPA裂解液提取总蛋白,BCA试剂盒测定样品蛋白总量。蛋白定量后,加入蛋白上样缓冲液,100℃变性5 min。电泳,转膜,5%脱脂牛奶室温封闭1 h后,置于摇床4℃孵育一抗过夜。第2天室温孵育二抗1 h后,加入超敏型ECL发光液,化学发光成像仪显影。
1.4.5 细胞原位杂交(FISH)实验 将NCI-N87细胞接种于荧光小皿中,细胞生长至适宜密度后使用4%多聚甲醛固定,加入0.3%Triton X-100通透液于4℃静置5 min后,PBS洗涤。加入200 μl预热的预杂交液,37℃湿盒孵育30 min。弃预杂交液,加入含2.5 μl探针预热的杂交液,37℃下置于避光湿盒中杂交过夜。第2天,在42℃使用杂交洗液Ⅰ、Ⅱ、Ⅲ分别避光洗涤,常温PBS洗涤后使用DAPI进行细胞核染色,然后使用激光共聚焦显微镜拍摄。
1.4.6 组织切片FISH实验 将组织切片置于二甲苯及梯度乙醇中脱蜡,100°C左右纯化水预处理切片,胃蛋白酶消化15 min,洗涤后使用梯度乙醇脱水。加入含探针的杂交液,37℃下置于避光湿盒中杂交过夜。第二天,在42℃下使用杂交洗液Ⅰ、Ⅱ、Ⅲ分别避光洗涤,DAPI进行细胞核染色,激光共聚焦显微镜拍摄。
1.4.7 平板克隆形成实验 将处理过的细胞以500个/孔接种于6孔板中,培养7~10天后,弃上清液、PBS洗涤、4%多聚甲醛固定、结晶紫染色,洗净后置于显微镜下拍照。
1.4.8 CCK-8实验 将转染si-Lnc-BM的SGC7901细胞和Lnc-BM稳定过表达的BGC823细胞消化后,以5×103个/孔用新鲜培养基重悬后接种于96孔板中,每组设6个复孔,边缘孔各加入100 μl的PBS缓冲液以防止蒸发。将96孔板置于37℃、5%CO2培养箱中培养1~4 d,弃掉培养基,加入含10 μl CCK-8溶液的100 μl新鲜培养基,避光继续孵育1.5 h,使用酶标仪在450 nm处检测吸光度。
1.4.9 Transwell实验 在Transwell小室底部均匀涂抹50 μl纤连蛋白,晾干后放入24孔板置于培养箱中用于检测细胞迁移能力。细胞侵袭能力检测:以1:30比例用无血清的培养基稀释Matrigel基质胶,每孔加入50 μl至Transwell上室,放入培养箱中使其凝固。将细胞以4×104个/孔用无血清的培养基重悬后接种于Transwell上室中,下室加入600 μl完全培养基。培养12 h后使用4%多聚甲醛固定,结晶紫染色,洗净后置于显微镜下拍照。
1.4.10 RNA Pull-down实验 30 μg PGEM-3ZLnc-BM质粒与2 μl限制性核酸内切酶XbaⅠ或EcoRⅠ混合配置酶切体系,37℃水浴加热2 h后进行琼脂糖凝胶电泳验证,利用DNA回收试剂盒(LSKGEL050, Merck)得到纯化的Lnc-BM正义链及反义链线性DNA。利用体外转录试剂盒(AM1320,Ambion)转录得到Lnc-BM正义链及反义链RNA产物,进行生物素标记后纯化备用。纯化的RNA加入缓冲液[10 mmol/L Tris-HCl(pH=7.5),0.1 mol/L KCl,10 mmol/L MgCl2]恢复线性构型。准备适量细胞,加入含RNA酶抑制剂、蛋白酶和磷酸酶抑制剂以及组蛋白脱乙酰酶和去甲基化酶抑制剂的蛋白裂解液超声裂解,离心后取上清液备用。RNA捕获缓冲液[20 mmol/L Tris-HCl(pH=7.5),1 mol/L NaCl,1 mmol/L EDTA]重悬链霉亲和素磁珠后,加入20 μg生物素标记的Lnc-BM室温旋转孵育后加入10×蛋白-RNA结合缓冲液 [20 mmol/L Tris-HCl(pH=7.5),0.5 mol/L NaCl,20 mmol/L MgCl2,1%吐温20] 50 μl,50%甘油150 μl,30 mg细胞裂解液,加无酶水补齐至500 μl,4℃旋转孵育4 h。孵育得到的RNA-蛋白复合物使用洗涤缓冲液[20 mmol/L Tris-HCl(pH=7.5),10 mmol/L NaCl,0.1%吐温20]洗涤4次,得到的蛋白复合物变性后跑聚丙烯酰胺凝胶,银染后进行质谱分析结合的蛋白。Lnc-BM与GST-FASTK重组蛋白的RNA Pull-down实验过程同上,将生物素标记的1 μg Lnc-BM正义链及反义链RNA产物与链霉亲和素磁珠孵育2 h后,加入1 μg GST-FASTK重组蛋白4℃旋转孵育4 h,洗脱、变性后进行蛋白免疫印迹实验。
1.4.11 Seahorse细胞能量代谢检测 实验前一天,接种8×103个细胞至培养板中,置于培养箱中培养。向水化板中加入200 μl的无菌水,将检测板放入水化板中并置于无CO2的37℃培养箱中过夜;另取50 ml的校准液于50 ml离心管中一起放入无CO2的37℃培养箱。次日,将检测板中原有无菌水弃掉,加入提前准备的200 μl校准液,继续置于无CO2的37℃培养箱中。配置终浓度为1 mmol/L丙酮酸、2 mmol/L谷氨酸以及25 mol/L葡萄糖的检测培养液,调节pH至7.4,过滤除菌后置于37℃预热。弃去原有培养基,加入200 μl的检测培养液洗涤两次,然后加入180 μl的检测培养液置于37℃培养箱平衡1 h。加入对应药物后置于Seahorse细胞能量代谢仪检测。
1.4.12 裸鼠皮下荷瘤实验 将10只6周龄Balb/c雄性裸鼠随机分为两组,每组5只,皮下注射Lnc-BM稳定过表达的BGC823细胞和对照细胞,细胞浓度为2×106个/100微升。荷瘤12天后,每隔2天用游标卡尺测量一次肿瘤长径和短径,并计算肿瘤体积(长径×短径×短径×1/2)。荷瘤20天后,麻醉小鼠颈椎脱臼处死,取肿瘤称重分析。
1.5 统计学方法
SPSS21.0和GraphPad Prism 7.0软件对数据进行统计分析和作图。两组间差异比较采用t检验分析,多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 Lnc-BM在胃癌组织和胃癌细胞中的表达
RT-qPCR实验检测Lnc-BM在胃癌及癌旁正常组织中表达水平,结果显示在36对胃癌组织中Lnc-BM表达水平高于癌旁组织(P=0.014),见图1A。此外,我们在胃癌细胞系中检测了Lnc-BM的表达,发现其在胃癌细胞BGC823、SGC7901、NCI-N87和MKN74中的表达明显高于正常胃黏膜细胞GES-1(均P<0.05),见图1B。RNA原位杂交(FISH)实验也证明Lnc-BM在胃癌组织中表达量较癌旁正常组织高(P<0.05),见图1C。
2.2 构建Lnc-BM敲低及过表达的胃癌细胞株
为进一步研究Lnc-BM对胃癌进展的影响,我们设计合成了特定干扰Lnc-BM表达的siRNA,转染SGC7901细胞后,RT-qPCR证实si-Lnc-BM组表达显著低于si-Ctrl组(均P<0.01),见图2A。同时,我们构建了Lnc-BM过表达的慢病毒感染BGC823细胞,通过嘌呤霉素筛选得到Lnc-BM稳定过表达的BGC823细胞。RT-qPCR验证过表达组Lnc-BM表达水平显著高于对照组(P<0.001),见图2B。

图2 RT-qPCR实验检测Lnc-BM敲低及过表达胃癌细胞中Lnc-BM的表达水平Figure 2 Expression of Lnc-BM in its knockdown and overexpressing gastric cancer cells detected by RT-qPCR
2.3 Lnc-BM增加胃癌细胞的增殖能力
通过平板克隆形成实验检测Lnc-BM对肿瘤细胞增殖能力的影响,结果显示,转染si-L n c-B M 后,S G C 7 9 0 1 细胞克隆形成数下降(均P<0.001),见图3A~B;过表达Lnc-BM后,BGC823 细胞克隆形成数明显增多(P<0.001),见图3C~D。CCK-8实验结果也显示,转染si-Lnc-BM后,SGC7901细胞增殖能力下降(均P<0.0001),见图3E;过表达Lnc-BM后,BGC823细胞增殖能力高于对照组(均P<0.0001),见图3F。
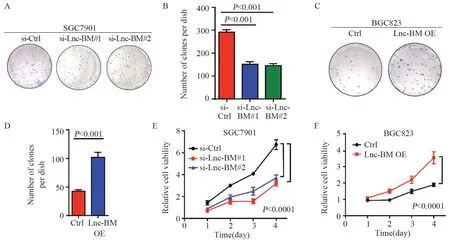
图3 克隆形成实验和CCK-8实验检测Lnc-BM对胃癌细胞增殖能力的影响Figure 3 Effect of Lnc-BM on the proliferation of gastric cancer cells detected by colony formation and CCK-8 assays
2.4 Lnc-BM增加胃癌细胞的迁移和侵袭能力
通过Transwell实验检测Lnc-BM对胃癌细胞迁移、侵袭能力的影响,结果显示,转染si-Lnc-BM后的胃癌细胞迁移、侵袭能力下降(均P<0.001),见图4A~B;相反,Lnc-BM稳定过表达的胃癌细胞迁移、侵袭能力增强(均P<0.001),见图4C~D。
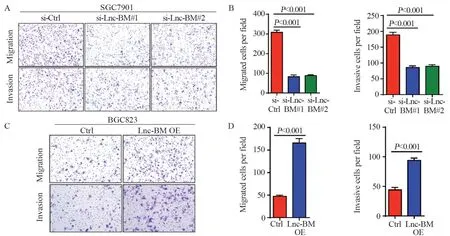
图4 Transwell实验检测Lnc-BM对胃癌细胞迁移、侵袭能力影响Figure 4 Effect of Lnc-BM on the migration and invasion of gastric cancer cells detected by Transwell assay
2.5 Lnc-BM定位于细胞质
通过Lnc-BM的FISH实验检测Lnc-BM在胃癌细胞中的定位,发现Lnc-BM主要定位于细胞质中,见图5,提示Lnc-BM可能在胞质中发挥其生物学作用。
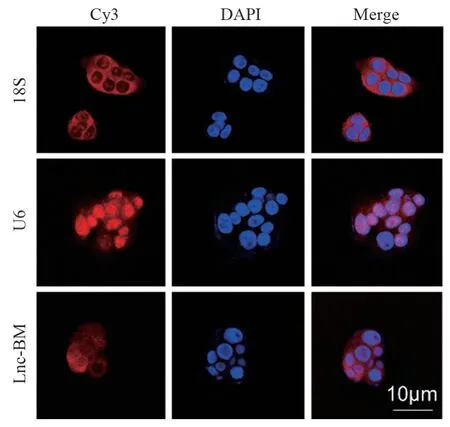
图5 RNA FISH实验检测Lnc-BM在细胞中的定位Figure 5 Location of Lnc-BM in cells detected by FISH assay
2.6 Lnc-BM结合FASTK蛋白
为了验证Lnc-BM是否与FASTK蛋白结合,我们首先在体外转录得到生物素标记的Lnc-BM正义和反义的RNA产物,然后和SGC7901细胞裂解液孵育进行RNA Pull-down实验。Western blot实验证实Lnc-BM与FASTK结合,而与阴性对照蛋白GAPDH没有结合,见图6A。此外,我们利用FASTK重组蛋白(通过考马斯亮蓝染色实验验证,见图6B)和生物素标记的Lnc-BM正义和反义的RNA产物孵育后进行Western blot实验发现,Lnc-BM与FASTK可以直接结合,见图6C。
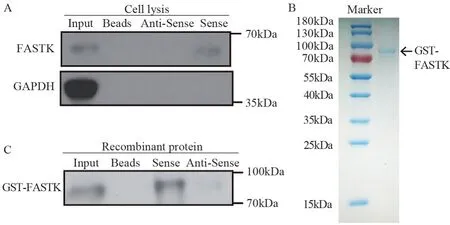
图6 RNA Pull-down验证Lnc-BM与FASTK蛋白结合Figure 6 Interaction between Lnc-BM and FASTK detected by RNA pull-down assay
2.7 Lnc-BM调控FASTK蛋白表达
Lnc-BM的siRNA转染SGC7901细胞后,Western blot实验证实敲低Lnc-BM后,细胞中FASTK蛋白水平也下降(均P<0.05),见图7A~B。相反,Lnc-BM稳定过表达的BGC823细胞中FASTK蛋白表达水平也增高(P<0.05),说明Lnc-BM可以调控FASTK的蛋白表达,见图7C~D。

图7 Western blot检测Lnc-BM敲低和过表达细胞中FASTK的蛋白表达水平Figure 7 FASTK protein levels in Lnc-BM knockdown and overexpression cells detected by Western blot
2.8 Lnc-BM调控线粒体相关蛋白表达
Western blot实验分析Lnc-BM是否调控线粒体相关蛋白MT-ND6和TOM20的表达。结果显示,敲低Lnc-BM抑制了MT-ND6和TOM20蛋白表达水平(均P<0.05),见图8A~C;而Lnc-BM过表达的细胞中MT-ND6和TOM20蛋白水平显著增高(均P<0.05),见图8D~F。
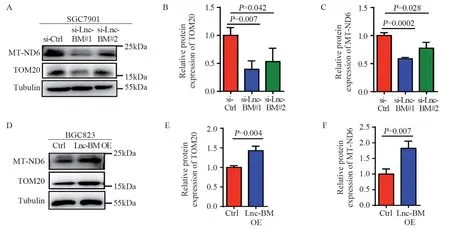
图8 Western blot检测Lnc-BM敲低和过表达细胞中线粒体相关蛋白的表达Figure 8 Levels of mitochondria-associated proteins in Lnc-BM knockdown and overexpression cells detected by Western blot
2.9 Lnc-BM调控胃癌细胞线粒体呼吸功能
利用Seahorse检测改变Lnc-BM表达后线粒体呼吸功能的改变。结果表明,降低Lnc-BM表达后细胞的基础呼吸值、ATP产生量以及最大呼吸值均低于对照组细胞,说明降低Lnc-BM表达后细胞的线粒体呼吸能力减弱,氧化磷酸化水平降低(均P<0.05),见图9A。相反,Lnc-BM稳定过表达的BGC823细胞中线粒体呼吸能力显著增强(均P<0.05),见图9B。
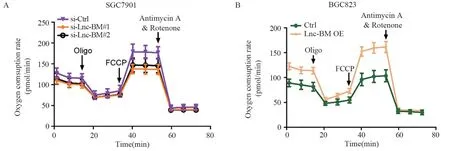
图9 Seahorse实验检测Lnc-BM敲低和过表达细胞中线粒体呼吸功能的改变Figure 9 Mitochondrial respiratory function in Lnc-BM knockdown and overexpression cells detected by Seahorse assay
2.10 Lnc-BM靶向FASTK调控线粒体呼吸能力
为了进一步研究Lnc-BM是否通过FASTK发挥调节线粒体呼吸作用,我们设计合成了特定干扰FASTK表达的siRNA,转染Lnc-BM稳定过表达的BGC823细胞后,Western blot证实si-FASTK组表达显著低于si-Ctrl组(均P<0.05),见图10A~B。此外,敲低FASTK显著抑制Lnc-BM过表达所增加的MT-ND6和TOM20蛋白水平(均P<0.05),见图10A、C、D。同时,Seahorse实验结果表明,在过表达Lnc-BM基础上抑制FASTK表达,细胞的基础呼吸值、ATP产生量以及最大呼吸值均降低,线粒体呼吸功能受到抑制(均P<0.05),见图10E。

图10 Lnc-BM通过FASTK调控细胞中线粒体相关蛋白的表达以及线粒体呼吸功能的改变Figure 10 Lnc-BM regulated expression of mitochondria-associated proteins and mitochondrial respiratory function via FASTK
2.11 Lnc-BM促进胃癌细胞生长
为了观察Lnc-BM在体内是否促进肿瘤生长,我们利用Lnc-BM稳定过表达的BGC823细胞和对照细胞注射在裸鼠皮下,构建了裸鼠荷瘤模型。RT-qPCR实验证实,Lnc-BM过表达组肿瘤中Lnc-BM表达水平显著高于对照组(P<0.05),见图11A。与对照组相比,Lnc-BM稳定过表达组肿瘤生长更快,肿瘤体积更大,肿瘤重量显著增加(均P<0.05),见图11B~D。

图11 裸鼠皮下荷瘤实验证明过表达Lnc-BM促进胃癌生长Figure 11 Growth of gastric cancer in nude mice promoted by Lnc-BM overexpression
3 讨论
胃癌是人类常见的消化道恶性肿瘤之一,由于胃癌早期症状不明显、筛查率低,大多数胃癌患者在确诊时已处于晚期,严重影响患者预后。目前胃癌临床治疗主要包括化疗、靶向治疗和免疫治疗,但胃癌患者5年总体生存率仍然不足50%,寻找胃癌潜在分子靶标对于治疗胃癌意义重大[12]。随着人类基因组计划测序的最终完成,人们认识到长链非编码RNA具有丰富的生物学功能,可通过多种机制调控靶基因的表达,是肿瘤诊断的重要生物标志物和治疗靶点[5]。本课题组前期通过筛选发现Lnc-BM与乳腺癌进展密切相关,可通过Lnc-BM/JAK2/STAT3/ICAM1通路促进乳腺癌细胞脑转移[6]。本研究中,我们发现Lnc-BM在胃癌组织中表达高于正常组织,过表达Lnc-BM可以促进胃癌细胞增殖与转移潜能。这说明Lnc-BM与胃癌进展密切相关,因此进一步研究了Lnc-BM调节胃癌进展的具体分子机制。
线粒体氧化磷酸化是细胞的能量来源,线粒体功能改变引起的能量代谢失衡可以影响肿瘤细胞进展,氧化磷酸化通路也已经成为多种疾病治疗靶点[13]。在我们先前的研究中,RNA pull-down结合蛋白质谱分析发现FASTK在Lnc-BM的结合蛋白中显著富集,我们进一步利用体内外实验证实Lnc-BM可以与FASTK蛋白直接结合,并且调控FASTK的蛋白水平[6]。siRNA降低Lnc-BM表达可以下调FASTK的蛋白表达水平,相反,过表达Lnc-BM可以提高FASTK表达水平。这些结果提示,Lnc-BM可能通过靶向FASTK表达影响线粒体氧化磷酸化功能。
MT-ND6参与线粒体呼吸链电子传递和线粒体呼吸链复合体Ⅰ的组装[14],有研究表明,FASTK可以调节MT-ND6的稳定性影响其表达[9]。白血病干细胞通过氧化磷酸化获得能量,它是导致白血病微小残留病的主要原因。有研究发现,在白血病干细胞中诱导FASTK基因剪切,降低FASTK的蛋白表达水平,可以抑制下游MTND6的表达水平,抑制线粒体呼吸链复合物Ⅰ的作用,从而阻碍白血病进展[15]。但是,FASTK调控MT-ND6表达是否可以影响肿瘤进展尚未见报道。因此,我们在胃癌中研究了Lnc-BM是否通过靶向FASTK改变MT-ND6的表达,影响线粒体呼吸功能从而调控胃癌进展。我们通过Western blot实验进行验证,发现过表达Lnc-BM后MTND6和线粒体标志蛋白TOM20表达升高,降低Lnc-BM表达后MT-ND6和TOM20蛋白表达也相应下降。Seahorse实验结果也表明,过表达Lnc-BM后细胞的基础呼吸值、ATP产生以及最大呼吸值均高于对照组细胞,说明过表达Lnc-BM后胃癌细胞线粒体呼吸能力增强,氧化磷酸化水平增强;降低Lnc-BM表达,线粒体呼吸能力也发生相应改变。此外,在Lnc-BM稳定过表达的细胞中敲低FASTK,发现线粒体的呼吸能力明显减弱,氧化磷酸化水平降低。提示Lnc-BM促进胃癌细胞增殖与转移是通过FASTK增强线粒体呼吸功能,促进ATP产生实现的。
本研究也存在一些不足之处,Lnc-BM是否可以作为胃癌的标志物以及Lnc-BM调节FASTK表达的具体机制还需要进一步的研究。敲低Lnc-BM是否可以对胃癌临床肿瘤药物有协同增敏作用还有待验证。
综上所述,本研究证实了Lnc-BM在胃癌中高表达,可以与FASTK直接结合影响其蛋白水平,增加线粒体呼吸链复合体I的关键蛋白MT-ND6表达,增强线粒体呼吸能力,促进ATP产生,促进胃癌恶性进展。Lnc-BM-FASTK-MT-ND6信号轴可能成为胃癌诊断的分子标志物和潜在的治疗靶点,为胃癌的综合防治提供新策略。
利益冲突声明:
所有作者均声明不存在利益冲突。

