非M3型急性髓系白血病患者骨髓原始细胞酪氨酸蛋白激酶CD117的表达及意义
纪婷婷,陶善东,丁邦和,王春玲,于 亮
(1.南京医科大学附属淮安第一医院血液科,江苏 淮安 223300;2.南京医科大学血液病重点实验室,江苏 南京 210009)
急性髓系白血病(acute myeloid leukemia,AML)是一种造血干细胞异常的恶性克隆性血液肿瘤,以骨髓中白血病细胞的克隆性增殖以及正常造血功能受损为特征。AML具有高度异质性,白血病细胞具有不同的免疫表型,对AML的诊断及预后判断具有重要价值[1]。酪氨酸蛋白激酶CD117是原癌基因C-kit的受体,在B淋巴细胞、T淋巴细胞、红细胞等细胞上表达,其通过与相对应的配体结合而被激活,可促进白血病细胞的生长和增殖。同时,CD117可用于鉴别髓系与淋系白血病,是AML诊断的特异性标志物之一。研究发现,CD117可能与AML患者的预后相关[2],但其与AML患者临床疗效及长期生存状态的确切关系目前尚不明确。本研究对淮安市第一人民医院收治的87例初诊为非M3型AML患者的白血病细胞免疫表型特征进行分析,并检测CD117在非M3型AML患者中的表达情况,探讨其对AML患者完全缓解(complete remission,CR)率、微小残留病(minimal residual disease,MRD)阴性率及总生存期(overall survival,OS)的影响,旨在为AML患者个体化治疗方案的制订及预后判断提供参考。
1 资料与方法
1.1 一般资料
选择2013年1月至2018年6月淮安市第一人民医院收治的83例初诊为非M3型AML患者为研究对象,患者均符合AML诊断标准[3]。纳入标准:(1)年龄≥14岁;(2)初次诱导采用标准的诱导化疗方案。排除标准:(1)AML-M3型;(2)合并严重的脏器功能衰竭。83例患者中,男54例,女29例;中位随访时间33个月。根据骨髓原始细胞免疫表型流式细胞术检测结果,将患者分为CD117抗原阴性组(CD117-组,n=40)和CD117抗原阳性组(CD117+组,n=43),2组患者的性别、年龄、初诊时白细胞(white blood cell,WBC)计数、血红蛋白(hemoglobin,Hb)水平和血小板(platelet,PLT)计数、乳酸脱氢酶(lactate dehydrogenase,LDH)计数、血糖、骨髓中原始细胞百分比以及中枢神经系统白血病(central nervous system leukemia,CNSL)分布等一般临床资料比较差异无统计学意义(P>0.05)(见表1),具有可比性。本研究获得淮安市第一人民医院医学伦理委员会审核批准,患者和(或)家属均知情同意并签署知情同意书。
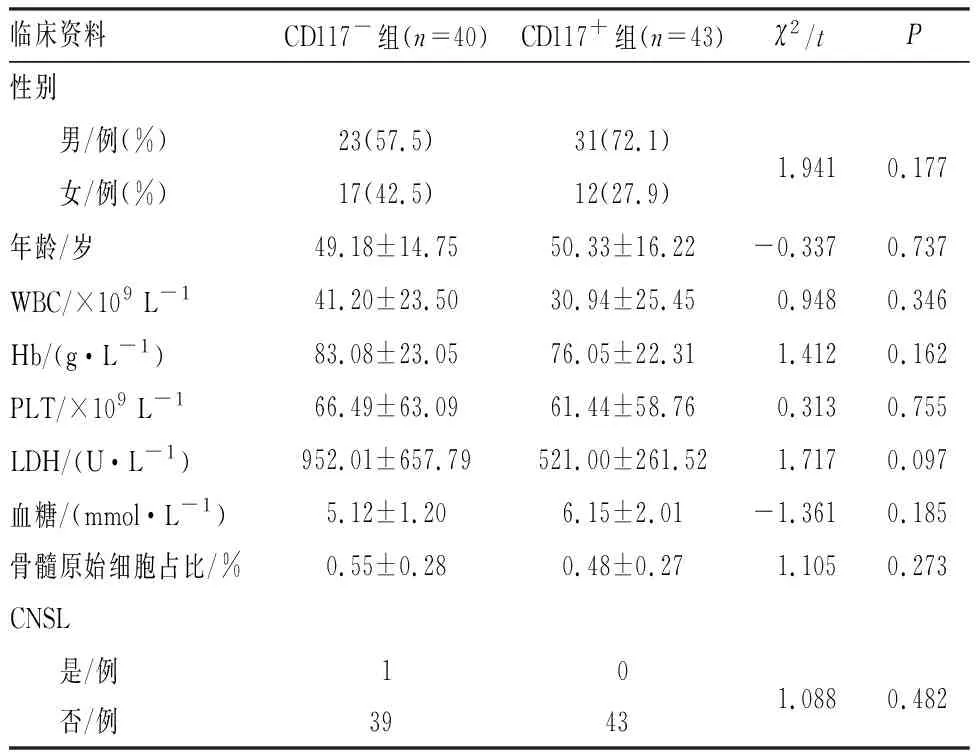
表1 CD117+组与CD117-组患者一般临床资料比较Tab.1 Comparison of general clinical data of patients between CD117+ group and CD117- group
1.2 骨髓标本采集
患者入院初始治疗前,在无菌环境下给予局部浸润麻醉后行骨髓穿刺术(髂前上棘/髂后上棘),抽取1绿头管和2紫头管的骨髓样本各3 mL,保存于4 ℃冰箱中,绿管骨髓液进行染色体核型分析,紫管送流式细胞术及基因检测。
1.3 流式细胞术检测骨髓原始细胞的免疫表型
取上述紫管骨髓液,抽20 μL置入流式管中,加入膜表面多色抗体(法国Immunotech公司),振荡混匀,室温避光孵育15 min;加入红细胞裂解液 0.5 mL,振荡混匀,37 ℃避光孵育15 min;加入 3 mL 磷酸盐缓冲液(phosphate buffer saline,PBS),2 000 r·min-1离心5 min,弃上清;加入3 mL PBS,2 000 r·min-1离心5 min,弃上清;补足0.3 mL PBS,使用流式细胞仪(美国Beckmancoulter公司)检测骨髓中原始细胞表面CD117抗原的表达,根据CD117抗原表达强度进行分组,其中原幼细胞CD117抗原表达≥20%者为阳性组(CD117+组),原幼细胞CD117抗原表达<20%者为阴性组(CD117-组)。
1.4 遗传学特征检测
1.4.1 R显带技术分析AML患者的染色体核型
取上述绿管骨髓液3 mL,加入RPMI 1640培养液,应用短期培养法培养24~48 h,收集其中有丝分裂期的细胞进行染色体制片,应用R显带技术分析20个分裂中期细胞,依据人类细胞遗传学国际命名体制指南(ISCN2009)[4]对其短期培养物进行染色体核型分析,统计正常核型、1~2条染色体异常及复杂核型(≥3条染色体异常)的占比。
1.4.2 多重反转录聚合酶链式反应法检测AML患者的基因突变情况
取上述紫管骨髓液3 mL,采用多重反转录聚合酶链式反应法检测骨髓样本的麦克唐纳猫肉瘤样酪氨酸激酶3(feline mcDonough sarcoma-like tyrosine kinase 3,FLT3)、CCAAT/增强子结合蛋白a(CCAAT/enhancer binding protein a,CEBPA)、核磷蛋白1(nucleophosmin1,NPM1)、C-kit等常见的基因突变状态,无基因变异者为野生型,有基因变异者为突变型。
1.5 患者预后分层
结合患者染色体及基因突变结果,依据中国成人急性髓系白血病(非急性早幼粒细胞白血病)诊断和治疗的有关指南[5],将所有患者的预后分层为预后良好、预后中等、预后不良。
1.6 治疗及预后评估
所有患者根据病情选择以下诱导方案中的1种进行化学治疗:(1)IA方案[去甲氧柔红霉素10~12 mg·m-2(第1~3天) +阿糖胞苷100 mg·m-2(第1~7天)];(2)DA方案[柔红霉素60~90 mg·m-2(第1~3天) +阿糖胞苷100 mg·m-2(第1~7天)];(3)HA方案[高三尖杉酯碱2.5 mg·m-2(第1~7天) +阿糖胞苷100 mg·m-2(第1~7天)]。1个疗程后未达CR的患者可选择原方案或更改诱导方案;达CR的患者选择中大剂量阿糖胞苷(1~2 g·m-2,12 h 1次,第1~4天)方案进行巩固化学治疗。患者均完成1个疗程及以上标准诱导化学治疗方案治疗。参照《血液病诊断及疗效标准》[6],符合以下条件者为CR:(1)骨髓原始细胞比例<5%,红细胞及巨核细胞系正常;(2)Hb≥100 g·L-1,中性粒细胞绝对值≥1.5×109L-1,PLT≥100×109L-1;(3)外周血无原始细胞,并且无白血病髓外浸润。计算所有患者的CR率、MRD阴性率及OS。
1.7 统计学处理

2 结果
2.1 2组患者遗传学特征比较
2组患者的染色体核型及FLT3、CEBPA、NPM1、C-kit等基因突变状态、预后分层比较差异均无统计学意义(P>0.05)。结果见表2。
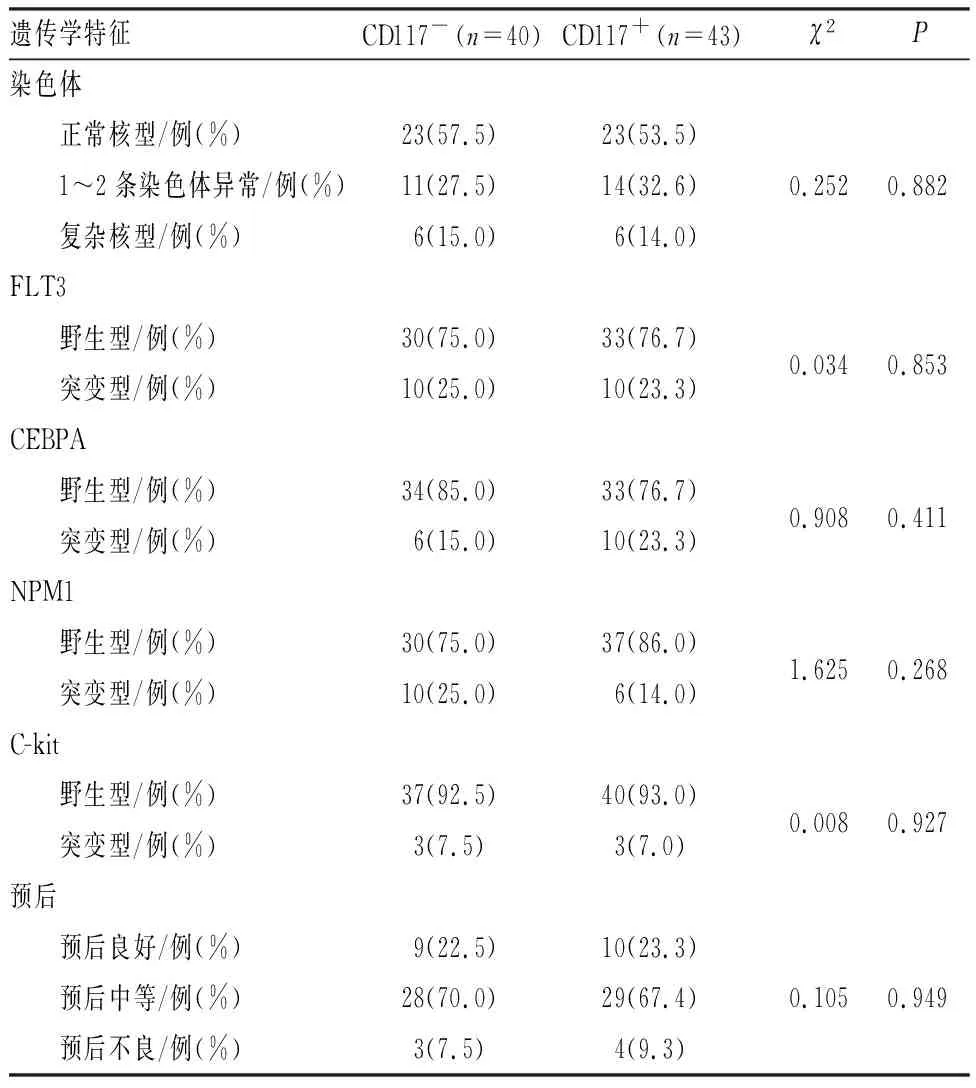
表2 CD117+组和CD117-组患者的遗传学特征比较Tab.2 Comparison of cytogenetic/molecular genetic characteristics of patients between CD117+ group and CD117- group
2.2 2组患者1个疗程后CR率、MRD阴性率及OS比较
CD117-组患者治疗1个疗程后CR率为77.50%(31/40),CD117+组患者治疗1个疗程后CR率为76.74%(33/43);2组患者治疗1个疗程的CR率比较差异无统计学意义(χ2=0.007,P>0.05)。CD117-组达CR患者的MRD阴性率为90.30%(28/31),CD117+组达CR患者的MRD阴性率为57.60%(19/33);CD117-组达CR患者的MRD阴性率显著高于CD117+组,差异有统计学意义(χ2=8.797,P<0.01)。Kaplan-Meier法生存分析结果显示,CD117-组患者的中位OS为33.09[95%置信区间(confidence interval,CI):28.22~37.97]个月,CD117+组患者的中位OS为20.61(95%CI:17.89~23.33)个月;CD117-组患者的中位OS显著长于CD117+组,差异有统计学意义(P<0.01)。
3 讨论
AML是一种在发病机制、遗传背景和预后转归等方面具有高度异质性的血液系统恶性肿瘤,其发生发展涉及多种细胞遗传学和分子学异常,是血液造血系统常见的恶性肿瘤[7-8]。随着AML诊断技术及治疗方案的不断完善,在一定程度上改善了患者的预后,然而疾病的难治性及其易复发的特点使得患者的总存活率仍然很低[9]。近年来,靶向疗法成为血液肿瘤治疗的研究热点,如抗CD20单克隆抗体治疗CD20+的B细胞肿瘤,靶向CD19的嵌合抗原受体治疗AML[10-12]。免疫分型作为诊断血液系统疾病常用的检测手段,可为AML的靶向治疗提供有价值的线索,促进AML个体化治疗目标的实现。由于M3型AML具有独特的发病机制与治疗策略,因此,本研究选取非M3型AML患者为观察对象,探讨CD117在AML预后判断中的临床价值。
CD117在大约80%的AML患者髓细胞中过表达,是鉴别AML与淋系白血病的重要免疫标志物[13]。CD117可与配体、干细胞因子等相互作用而活化,调控造血干细胞的存活、增殖和分化。活化的CD117亦可激活多种非受体酪氨酸激酶如布鲁顿酪氨酸蛋白激酶(Bruton′s tyrosine kinase,BTK)、脾酪氨酸激酶和磷脂酰肌醇3-激酶,调控细胞的凋亡、趋化和黏附[14]。另外,CD117可增强AML原始细胞对纤连蛋白的黏附,并且强化纤连蛋白介导的细胞增殖和抗凋亡信号[15]。本研究发现,CD117-组和CD117+组患者经1个疗程标准方案化学治疗后的CR率比较差异无统计学意义,但患者达CR后,CD117-组患者的MRD阴性率显著高于CD117+组患者。MRD是AML患者经标准诱导方案化学治疗达到CR但体内仍留有少量白血病细胞的状态。DINARDO等[16]指出,MRD可预测AML复发,并可影响患者预后。本研究证实,MRD阴性率较高的CD117-组患者具有较长的OS,CD117有可能通过影响MRD促进AML白血病细胞存活,从而影响AML患者的预后。有研究亦证实,CD117高表达的成人AML患者预后较差[17]。
CD117作为一种主要表达于髓细胞表面的受体,可与BTK等多种酪氨酸激酶结合,并通过传递磷酸化信号调控Toll样受体9、FLT3等信号通路,促进AML白血病细胞的存活和增殖[18-19]。RUSHWORTH等[20]研究发现,CD117可介导AML原始细胞增殖,而BTK抑制剂伊布替尼可通过抑制CD117介导的促生存信号及其下游的BTK活化信号,抑制白血病细胞增殖;同时伊布替尼可阻断CD117活化介导的AML白血病细胞对骨髓微环境和纤连蛋白的黏附,促进CD117+AML白血病细胞凋亡。另有研究发现,酪氨酸激酶抑制剂Radotinib对CD117+AML白血病细胞较CD117-细胞具有更强的细胞毒性[21]。HEO等[22]研究证实,达沙替尼和Radotinib可靶向抑制CD117而促进CD117+AML白血病细胞死亡。另外,达沙替尼和Radotinib通过诱发CD117的内吞作用、减少热休克蛋白90β的表达以及增加凋亡蛋白酶激活因子-1的释放来激活CD117+AML相关的凋亡通路,促进细胞凋亡。这些结果表明,CD117与AML白血病细胞的增殖、凋亡及化学治疗敏感性密切相关,影响AML患者预后。本研究表明,CD117是AML预后不良的分子标志物,同时本课题组前期研究发现,达CR的AML患者具有较低的BTK 表达,靶向抑制酪氨酸激酶的活性或可成为CD117+AML治疗的研究热点[23]。伊布替尼、达沙替尼和Radotinib在CD117+AML患者的治疗中具有重要的潜在临床价值。
此外,本研究显示,CD117+的AML患者较CD117-患者具有较低的MRD阴性率;而与 MRD 阴性率较低的 CD117+患者相比,MRD 阴性率较高的 CD117-患者具有更长的 OS,这可能与CD117激活多种非受体酪氨酸激酶、促进纤连蛋白黏附,从而促进AML白血病细胞的存活并抑制凋亡等密切相关。以上结果提示,CD117或可作为AML患者预后不良的标志物之一。
4 结论
CD117与非M3型AML患者的MRD相关,是影响AML患者预后的因素,可指导AML患者的临床预后分层及精准化治疗,对指导AML患者的临床治疗具有重要意义。合理准确地处理骨髓细胞,提高流式检测阳性率,对于初诊AML患者的治疗方案选择和临床预后判断具有重要价值,靶向抑制CD117已成为AML治疗的研究热点。

