绿原酸抗菌作用及机制的研究进展
李阳昱 李庆蓉 陈孝红 薛丽 和平安 吕梅 杨旭
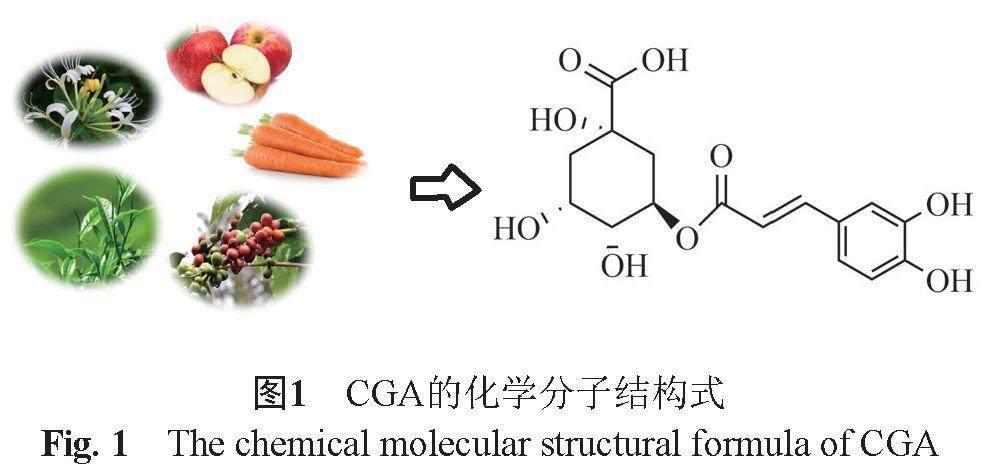

摘要:绿原酸是植物体在有氧呼吸过程中经莽草酸途径合成的一种苯丙素类物质,自然存在于多种中药材和食物中,杜仲、金银花和咖啡等植物中含量较高,具有抗菌、抗炎、抗氧化、抗癌和免疫调节等多种药理活性。近年来,绿原酸作为研究活性物质的焦点之一,因其抗菌谱广,对多种细菌和真菌均有较好的抗菌活性,故绿原酸对临床菌株的抗菌作用逐渐被重视和研究。本文综述了近年来国内外关于绿原酸对多种致病菌的抗菌作用及机制的研究进展,旨在为绿原酸抗菌作用的深入研究提供参考,为临床抗感染治疗和控制带来新思路,有助于绿原酸在医药领域的开发。
关键词:绿原酸;活性多酚;抗菌作用;临床耐药菌;机制
中图分类号:R966文献标志码:A
Advances in research on the antibacterial effects and mechanism of chlorogenic acid
Abstract Chlorogenic acid (CGA) is a phenylpropyl substance synthesized by shikimic acid pathway in plants during aerobic respiration. It naturally exists in a variety of Chinese medicinal materials and foods, with relatively high contents in Eucommia ulmoides, honeysuckle, coffee and other plants, which have various pharmacological activities such as antibacterial, anti-inflammatory, antioxidation, anticancer and immune regulation. In recent years, as one of the focal points of research on active substances, CGAs antibacterial effect on clinical strains has been gradually paid attention to and studied due to its wide antibacterial spectrum and good antibacterial activity against a variety of bacteria and fungi. This study summarized recent developments in research on the antibacterial action and mechanism of CGA against a variety of pathogenic bacteria both at home and abroad, aiming to provide a reference for further research on the antibacterial activity of CGA, bring new ideas for clinical anti-infection treatment and control, and contribute to the development of CGA in the field of medicine.
Key words Chlorogenic acid; Active polyphenol; Antibacterial effects; Clinical drug resistant bacteria; Mechanism
近年來,随着长期抗生素的过度使用,临床出现多重耐药菌,常与高发病率和高死亡率密切相关。传统抗生素有效性下降,新抗生素研发慢且细菌易获得耐药性,加大了临床抗感染治疗的难度,因此,迫切需要寻找潜在的抗生素替代药物。绿原酸(chlorogenic acid, CGA) (图1)是由咖啡酸和奎宁酸缩合而成的缩酚酸,又名咖啡鞣酸,是植物体在有氧呼吸过程中由肉桂酸和奎宁酸经莽草酸途径合成的一种苯丙素类物质[1]。国内外的研究发现CGA具有抗菌、抗炎、抗氧化和免疫调节等多种药理活
性[2-4]。CGA作为一种天然活性多酚,广泛存在于各种植物中,在杜仲和金银花中含量较为丰富,其他植物如咖啡、绿茶、苹果和胡萝卜中也有分布,廉价易得,副作用小。CGA抗菌谱广且抗菌机制复杂多样,对多种常见致病菌有较好的抗菌作用,但是关于CGA抗菌作用及机制的研究进展鲜有报道,本文综述近年来国内外关于CGA抗菌作用及机制的研究进展,以期为临床抗菌药物的研发提供新思路。
1 CGA的抗菌作用
1897年科学家发现向日葵籽中含有一种物质,可以导致向日葵籽蛋白变黑;1909年经多次实验证明了此化合物就是CGA;1947年Nelson和Rudkin通过研究首次确定CGA的化学结构,是一种由咖啡酸和奎宁酸形成的酯[5]。目前已有大量研究证明CGA对多种致病菌有广谱抗菌活性,包括革兰阴性菌,如大肠埃希菌、肺炎克雷伯菌、铜绿假单胞菌、鼠伤寒沙门菌、小肠结肠炎耶尔森菌、痢疾志贺菌、嗜麦芽窄食单胞菌,以及革兰阳性菌,如金黄色葡萄球菌、枯草芽胞杆菌、化脓链球菌、肺炎链球菌
等[6-10],见表1。2005年,屈景年等[7]从金银花中提取CGA后,通过平板法测定抑菌圈大小确定了CGA对大肠埃希菌和金黄色葡萄球菌有较好的抗菌活性,抑菌圈直径与CGA浓度呈正相关,且抗金黄色葡萄球菌的活性较大肠埃希菌强。元超等[8]从艾纳香中分离出CGA成分,通过微量稀释法测定最低抑菌浓度(minimal inhibitory concentration,MIC)显示,CGA对金黄色葡萄球菌和枯草芽孢杆菌有较强的抗菌活性,MIC值均为64 ?g/mL,优于大肠埃希菌(MIC>
128 ?g/mL)。Su等[9]研究了铜绿假单胞菌对CGA的敏感性,发现经CGA处理后,铜绿假单胞菌的脂多糖(lipopolysaccharide,LPS)含量降低,其内膜通透性增高,致使重要内容物被释出,最终引起细菌死亡。CGA可通过诱导细胞内代谢失衡抑制枯草芽孢杆菌生长[11],影响化脓性链球菌中的脂质代谢和清除活性氧(reactive oxygen species, ROS)[12]。Primavilla等[13]还发现从藏红花瓣中提取的CGA对产气荚膜梭菌、肉毒梭菌和艰难梭菌有抗菌作用。
更为重要的是,已有研究证明CGA对多重耐药菌也有抗菌作用。耐甲氧西林金黄色葡萄球菌、耐碳青霉烯类肺炎克雷伯菌、多重耐药大肠埃希菌和多重耐药铜绿假单胞菌是临床常见的耐药性致病菌,随着细菌耐药性日益严重,临床可选择的有效抗生素越来越少,而CGA抗耐药菌活性的发现,为临床寻找潜在的抗生素替代药物带来新思路。CGA的抗菌机制复杂多样,首先,CGA直接靶向细胞壁和细胞膜,损伤细胞表面,增加细胞膜通透性,这是CGA对不同细菌的共同作用机制;其次,CGA抑制耐药菌生物膜形成,一定浓度的CGA及其代谢产物可抑制耐甲氧西林金黄色葡萄球菌的生物膜形成并消除已成熟生物膜[14],调节耐碳青霉烯类肺炎克雷伯菌和多重耐药铜绿假单胞菌的群体感应(quorum sensing,QS) 系统,降低胞外多糖和荚膜多糖(capsular polysaccharide,CPS )的产生,抑制其生物膜形成[15-16];最后,CGA靶向多重耐药大肠埃希菌的外排泵并抑制其活性,下调耐药性相关基因Tsr、Tar、CheA和CheW[17-18],此外也有CGA抗β-内酰胺酶活性的报道[19],这些研究表明CGA能遏制细菌耐药性发展,进一步为临床治疗多重耐药菌感染提供了新希望。以上研究还发现CGA可提高细菌对抗生素的敏感性,与抗生素联合表现出协同抗菌作用,如在CGA治疗多重耐药大肠埃希菌引起的小鼠乳腺炎模型中,CGA联合头霉素C或者替米考星具有协同作用[20],CGA与左氧氟沙星协同抵抗多重耐药铜绿假单胞菌[21],原因可能是CGA损伤细胞表面结构,破坏细胞完整性,促使足够浓度的抗生素进入细胞发挥抗菌效应。此外,CGA还有抗真菌作用,并伴有一定的剂量效应[22]。综上,CGA作为天然活性分子,抗菌活性强,可缓解细菌耐药性,具有作为新型抗菌药物的潜力,有很大的临床开发应用价值。
2 CGA的抗菌机制
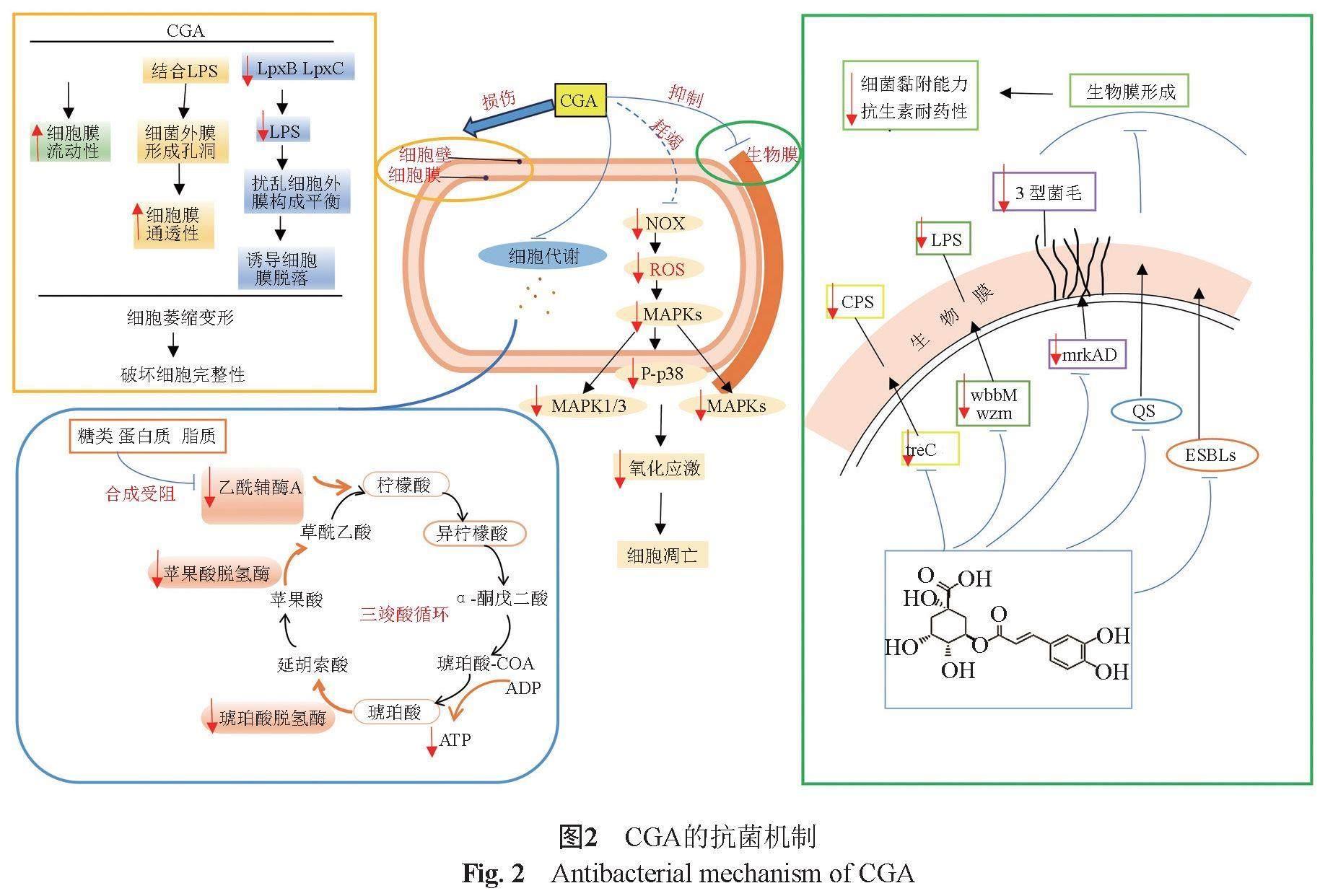
CGA的抗菌机制复杂多样,一直是近年研究的热点,已有大量研究证明了CGA对多种致病菌的抗菌机制,见图2,据目前的研究结果主要总结为以下几点。
2.1 抑制细菌生物膜形成
生物膜是细菌在相对恶劣的环境中形成的一种黏附在物体表面或气-液交界面、以微菌落为基本单位的膜状结构,由细菌及其自身分泌的代谢产物(胞外多糖、蛋白质、胞外DNA和脂质等)组成,常定植于医疗设备和植入物,细菌从浮游状态转变为生物膜状态是一个受环境与遗传因素高度调控的过程。生物膜形成后,为细菌提供营养和信息交流,可以逃避宿主免疫攻击,使细菌难以被清除并长期持留在宿主内形成慢性感染灶,造成持续的炎症和组织损伤;生物膜还会阻止抗生素进入细胞,使细菌衍生出较强的耐药性,与浮游菌相比,生物膜保护的细菌对抗生素的耐药性高出达1000倍[23]。CGA可通过多种途径抑制生物膜形成,破坏其屏障作用,使足够浓度的抗生素进入细胞内,具体机制如下。
2.1.1 下调生物膜形成相关基因的表达
细菌丰富的菌毛、CPS与LPS共同介导细菌与物体表面之间的相互作用,对维持生物膜结构稳定性和细胞间通讯至关重要。肺炎克雷伯菌生物膜形成较严重,其3型菌毛是一种由mrkABCDF操纵子编码的蛋白质,促进细菌黏附于物体表面;treC基因通过调节CPS的产生在生物膜形成、初始黏附、表面定植和分散中发挥积极作用;wzm和wbbM是合成LPS的相关基因,有研究发现CGA通过下调mrkA、mrkD和wbbM基因的表达抑制生物膜形成[16],且CGA处理后的所有测试菌株在定量和主观上都显示出生物膜表面积的显著减少,进一步证实了上述观点[19]。此外,CPS的厚度能够直接影响生物膜的成膜能力,CGA通过下调treC基因的表达抑制CPS合成[19],Wang等[16]最新的研究发现在1/2或1/4×MIC CGA处理后,透射电镜下发现肺炎克雷伯菌的荚膜变薄,经扫描电镜发现生物膜的网络结构被破坏,菌落数量减少并出现分散,进一步说明CGA对生物膜有破坏作用。AgrA蛋白是耐甲氧西林金黄色葡萄球菌生物膜的关键蛋白,曾铭等[14]通过分子对接技术发现CGA的3种体内代谢物苯甲酸、对香豆酸和对羟基苯甲酸可以结合在AgrA蛋白表面,占据DNA与AgrA蛋白的结合位点,直接影响AgrA蛋白与DNA的识别,下调agrA基因,降低细菌致病性。
2.1.2 抑制QS系统
CGA还被认为是1种有效的QS抑制剂。QS系统,是细菌群体密度信号的感受系統,是单个细菌为应对外部环境,通过分泌自诱导信号分子相互沟通,协调和控制细菌群体中基因表达的信号和反应;还能响应种群密度的变化来调节生物学功能,以适应环境变化,QS系统在生物膜形成全程发挥作用[24]。Las,Rhl和Pqs是铜绿假单胞菌3种主要的QS系统, CGA通过与这3种QS受体LasR,RhlR和PqsR形成氢键,干扰信号分子与其受体结合,下调QS系统本身及相关基因表达,减少外膜囊泡和外排DNA的分泌来抑制生物膜形成[15,24]。有研究通过计算建模进一步验证了CGA代谢产物奎宁酸可与RhlR、RhlA和RhlB结构上的芳香族氨基酸残基形成5~10个氢键,与受体结构上的一个口袋拟合,可能因抑制QS信号通路而降低鼠李糖脂含量,减弱对生物膜的固定、扩散、“蘑菇帽”结构形成和通道开放作用。此外,六元环周围存在大量芳香族氨基酸残基,在一定程度上限制了奎宁酸的分子流动性,进一步增强了与3种蛋白质的结合亲和力[21]。肺炎克雷伯菌QS系统中的AI-2信号分子在生物膜形成中起主要作用,其产生依赖于luxS基因,当 AI-2浓度达到阈值时,可触发信号传导的级联反应,诱导CPS、LPS和菌毛等多种基因表达,启动生物膜的形成,诱导生物膜成熟[25]。有学者筛选了CGA抗肺炎克雷伯菌QS的生物活性,发现luxS基因表达不受CGA影响,说明CGA对肺炎克雷伯菌生物膜形成的抑制与LuxS-QS系统无关,而是受其他途径调控[19]。还有研究发现,尽管CGA下调了耐碳青霉烯类肺炎克雷伯菌株(FK8002)中luxS的表达水平,但没有显著差异[16],与上述观点类似,这可能与菌株特性以及形成生物膜的能力有关系。CGA作为QS抑制剂的潜力已经被证明,但是不同的细菌CGA抗QS的活性不同。未来研究还应集中在CGA如何影响细菌生物膜空间结构,以阻止有害细菌的群体感应,促进有益细菌的群体感应。
2.1.3 抑制β内酰胺酶活性
生物膜形成与某些耐药菌产生β-内酰胺酶之间存在很大相关性,有报告表明,产生超广谱β-内酰胺酶(extended-spectrum β-lactamase, ESBLs)的肺炎克雷伯菌比不产ESBLs的菌株形成更严重的生物膜,且耐药性更普遍[26]。β-内酰胺酶通过水解β-内酰胺类抗生素赋予细菌耐药性,Rajasekharan等[19]进一步研究了CGA对β-内酰胺酶的抑制活性,分子对接结果显示CGA与巯基-可变-1β-内酰胺酶的活性位点紧密结合,有效抑制β-内酰胺酶活性,进而影响生物膜形成。
由于细菌的持续存在,细菌生物膜很难根除,因此,有研究还同时评估了CGA去除成熟生物膜的能力,CGA对大多数细菌的成熟生物膜有明显消除作用,并且呈剂量依赖性[14,27],但是CGA清除肺炎克雷伯菌生物膜的能力较差,这可能与生物膜中存在持久耐药性有关。
2.2 增加细胞膜通透性,破坏细胞完整性
Lou等[6]系统阐明了CGA对革兰阴性菌的抗菌作用机理,革兰阴性菌外膜中的LPS和蛋白质通过与二价阳离子(如Mg2+等)的静电作用维持在一起,而CGA表面负电荷通过静电作用与LPS位点结合并螯合Mg2+,破坏外膜完整性,增加细胞膜通透性,使胞质内电解质、ATP及可溶性蛋白、核酸、酶等大分子泄漏,然后使细胞膜去极化,最终细胞因失去维持膜电位和代谢产物的能力而死亡。同样的,Chen[27]和Zhan等[18]的研究结果表明CGA因分子极性强,对脂质等大分子物质亲和力高,能与细菌表面结合并改变其外膜结构,从而增加膜通透性,使细胞内重要物质部分泄漏,进而干扰蛋白质合成;同时更容易使细胞外的有害物质进入,影响细胞结构的稳定性,使细胞逐渐死亡,这与一些抗生素在细胞膜形成孔隙直接杀死细菌的方式不同。然而,关于CGA与细胞膜的哪些成分结合,如何发挥作用以及结合是否影响其他细胞代谢等还尚未有研究报道。
此外,CGA诱导大量β-半乳糖苷酶合成并泄漏至胞外,间接说明CGA改变了细胞膜通透性[28]。Ren等[29]通过杨氏模量和细菌弹簧常数K发现CGA处理后的细菌因细胞壁硬度降低而易变形,可能是因为CGA对细胞膜有损伤,进而引起膜通透性增加,导致细胞质成分泄漏,致使细胞内膨胀压力降低,细胞壁受到细胞膜的支撑减少,在外界压力下容易发生变形。Su等[9]发现铜绿假单胞菌经CGA处理4~24 h后扫描电镜发现细胞表面出现凹陷和空洞,推测CGA可能诱发了细胞表面损伤,而细胞外蛋白质含量增加、细胞内ATP水平急剧下降均说明了CGA增加细胞内膜的通透性,其后用荧光探针PI和cFDA 直接证明了上述结果。还发现CGA下调LPS合成相关基因LPxB和LPxC的表达,降低细胞外膜中LPS含量,可能通过扰乱LPS和磷脂之间的平衡,诱导外膜脱落,最终导致细胞死亡,这与Sun等[30]研究结果一致。最新关于沙门菌的研究进一步证实了CGA损害细菌的细胞完整性,细菌细胞表现出变形和萎缩,关于CGA如何损坏细胞表面,该学者证明了细胞膜损伤与ROS无关,用DPH荧光偏振检测细胞膜流动性,发现CGA呈剂量依赖性方式诱导细胞膜流动性显著增加,表明CGA诱导细胞表面损伤可能与膜流动性增加有关[31]。膜流动性对细胞膜渗透作用至关重要,膜流动性的突然变化会损害细胞膜的正常功能,而细胞膜脂质双分子层中磷脂具有物种特异性甚至菌株特异性,CGA对膜脂质组成的影响以及CGA处理后LPS降低与膜流动性增强是否存在相关性可能是一个值得探究的机制。
2.3 扰乱细胞代谢
CGA是一种酚类化合物,是酚类酶催化最适宜的反应底物,它能影响相关代谢酶的活性,降低物质和能量代谢水平,使代谢过程受阻,从而抑制细菌活性。三羧酸循环是3大营养物质(蛋白质,糖类,脂质)提供和转换能量的最终代谢途径,其产生的乙酰辅酶A是三羧酸循环的关键物质。有研究发现CGA等酚酸类物质影响大肠埃希菌的代谢水平,下调脂肪酸β氧化、苯丙氨酸和赖氨酸代谢途径中的关键酶,阻碍乙酰辅酶A合成导致三羧酸循环受抑制,进而中断细菌的物质转化和能量代谢[18]。CGA还抑制苹果酸脱氢酶和琥珀酸脱氢酶的活性,这是三羧酸循环和电子传递链中的2种主要代谢酶,最终因抑制了细胞存活的能量代谢导致细胞死亡[30]。在CGA对枯草芽孢杆菌抗菌活性的研究中,发现CGA诱导细胞内ATP含量降低,这可能与CGA影响细胞代谢有关,进一步代谢组学研究表明,CGA诱导细胞内三羧酸循环和糖酵解代谢失衡,导致细菌代谢紊乱,主要表现为CGA显著降低三羧酸循环中柠檬酸、异柠檬酸和琥珀酸水平,以及糖酵解途径中的葡萄糖6-磷酸和果糖1,6-二磷酸[11]。以上研究均表明CGA可以通过扰乱细胞代谢发挥抗菌作用。
2.4 调控信号转导通路
有学者验证了CGA通过上调lncRNA GAS5/miR-23a/PTEN轴调节p38 MAPK通路,促进自噬并抑制鼠伤寒沙门菌感染,调节肠道炎症因子平衡和减少肠道损伤[32]。同样的,CGA通过抑制NLRP3炎症小体活化,上调miR-124-3p表达并灭活p38MAPK途径来下调肺炎克雷伯菌感染的炎症水平,进一步说明了CGA对细菌感染的保护作用[33]。此外,与常见的由ROS积累引起细菌凋亡的机制相反,由于CGA具有较强的抗氧化活性,可通过消耗细胞内ROS来影响细胞代谢的信号通路,诱导细菌凋亡[34]。适当水平的ROS在体内稳态和细胞内信号传导中发挥重要作用,ROS耗竭或过量积累时细胞内氧化还原平衡被打破,影响细胞内的信号通路,导致细胞功能障碍。
2.5 CGA的其他抗菌机制
最新研究报道,CGA可能作为一种活跃的外排泵抑制剂,AcrB是来自大肠埃希菌AcrAB-TolC药物转运复合物的膜蛋白,是评估外排泵抑制剂特征化合物的优秀模型系统,分子对接技术结合分子动力学模拟分析发现,CGA通过氢键与AcrB高亲和力结合,形成稳定的复合物来抑制外排泵表达,最大限度减少耐药性;CGA还可能作为一种能量抑制剂,通过瞬时耗散膜电位抑制外排活动,干扰维持外排泵功能所需的能量来抑制细菌外排泵系统[17]。CGA还可能下调多重耐药大肠埃希菌的耐药相关蛋白(Tsr、Tar、CheA和CheW)、外膜孔蛋白F(OmpF)和鞭毛蛋白(FliC),诱导细菌鞭毛脱落[18],抑制鞭毛合成,减少鞭毛数量,使细菌形态变得更加光滑,降低细菌群集能力、生物膜稳定性和细胞壁硬度[29]。SrtA是一种“管家”分选酶,介导多达19种表面蛋白与细胞壁的共价附着,对金黄色葡萄球菌定植和感染非常重要,Wang等[35]通过体内外实验证明了CGA能明显抑制SrtA的催化活性,CGA通过氢键和疏水作用力与SrtA中C184和G192位点结合,阻止表面蛋白的分选信号进入,有效抑制SrtA转肽,降低细菌毒力,促进细菌清除,而不会施加明显的耐药选择性压力,这表明CGA可作为SrtA抑制剂阻断其活性来破坏细胞表面蛋白质发挥抗菌作用。神经氨酸酶是肺炎链球菌的关键毒力因子之一,可以去除宿主細胞表面聚糖中的唾液酸,暴露出某些受体,促进细菌黏附和定植,Guan等[36]研究CGA对肺炎链球菌神经氨酸酶的抑制作用显示,CGA通过氢键,盐桥和阳离子-π相互作用与A型神经氨酸酶活性位点Arg347强力结合并形成帽状结构,抑制其活性,降低细菌毒力。此外,有研究证明CGA促进小鼠肺泡巨噬细胞从MI型极化为M2型来缓解肺炎克雷伯菌诱导的炎症,明显提高小鼠生存率[37]。肺泡巨噬细胞是构成关键的免疫效应因子之一,肺炎克雷伯菌小鼠肺炎模型表明,耗竭肺泡巨噬细胞会加剧肺部感染[38],而临床上细菌感染的原因很大程度与患者免疫功能低下有关,因此,CGA可能具有通过调节宿主天然免疫功能增强抵抗细菌感染的潜力,但是关于CGA对宿主免疫功能的调节与抗菌作用的关系及具体机制还有待深入研究。
除了抗细菌作用,CGA还具有抗真菌活性,Martíne等[39]在2017年报道了CGA通过抑制真菌孢子的早期透膜化来控制不同植物病原真菌的生长,具有生物杀真菌剂的潜力。近年来学者更多关注CGA对唑类耐药白念珠菌的抗菌作用及机制,ALS3是白念珠菌发病机制中与黏附和生物膜形成相关的重要蛋白质,CGA与氟康唑耐药白念珠菌的ALS3活性位点残基相互作用,抑制其生物活性发挥抗生物膜作用[22]。CGA可诱导K+流出而促进白念珠菌细胞凋亡,其机制可能为K+外流导致细胞体积调节功能失调,不能满足细胞周期检查点要求而诱导 G2/M细胞周期停滞,从而导致细胞凋亡[40]。CGA的抗菌作用主要取决于其浓度,CGA抑制白念珠菌的MIC为
80 ?g/mL,虽然两性霉素B(MIC值为10 ?g/mL)抗白念珠菌活性比CGA强,但两性霉素 B 有较强的人红细胞溶血活性而CGA没有,并且还证明了40 ?g/mL的CGA能破坏菌丝和假菌丝,从而抑制白念珠菌的生长[41]。
3 CGA開发及应用前景
CGA是许多中药材、水果和蔬菜的主要活性成分,如杜仲、金银花、向日葵、咖啡、苹果、胡萝卜、大豆和马铃薯等含量较高[1]。目前,已报道的用于CGA提取、分离和定量的制备方法包括水提法、有机溶剂提取法、酶解法、超临界流体萃取法、微波辅助提取、红外辅助提取、超高压萃取、超声辅助提取,以及逆流色谱,离心分配色谱,分子印迹聚合物和双水相系统等。此外,还开发了NKA-9树脂、 X-5树脂和聚酰胺树脂技术[42]。CGA的半水合物为白色或黄色针状结晶体,在110 ℃状态下会转变成无水物,其在25 ℃水中的溶解度约4% ,易溶于极性溶剂如乙醇、 丙酮和甲醇,微溶于乙酸乙酯,难溶于氯仿、乙醚和苯等亲脂性有机溶剂。CGA为极性有机酸,不太稳定,在提取过程中易发生异构化。随着CGA的研究深入和制备技术的更新发展,极大提高了CGA的提取率和稳定性,这将有助于更好地利用各种植物来源的CGA,进而提高制药行业中的潜在价值。
目前临床抗致病菌感染以抗生素治疗为主,但是细菌耐药情况日益严重。CGA作为一种抗菌活性良好的绿色天然多酚,抗菌谱广且不易耐药。目前已有很多研究报道CGA通过纳米复合技术、微胶囊化、纳米包封和纳米乳液优化其生物活性和生物利用度,从而提高CGA的稳定性和抗菌活性[43]。用CGA代替化学试剂合成抗菌功能的纳米材料,克服了CGA水溶性低,很容易被体内的蛋白质灭活而影响药物吸收和利用的局限,还能使CGA以足够的浓度在细菌内积累,有效发挥抗菌作用,且细胞毒性小。将CGA负载到分散性好、高水溶性和良好生物相容性的纳米粒子或纤维上,表现出很强的抑菌作用和有效的生物活性,可以协同破坏细菌细胞壁和细胞膜并抑制细菌生长,可能与CGA被释放后穿过细胞膜进入细胞内,诱导ROS增加有关[44-45]。经评估发现CGA没有明显的体内毒性,不会造成内脏器官损伤,这种修饰大大提高了CGA的水溶性和稳定性,保护CGA不被蛋白质灭活,并且提高其抗菌活性,目前已有应用于肿瘤靶向治疗的研究[46]。负载CGA的纳米颗粒还可以延长CGA的释放时间,减轻小鼠牙周炎的骨质流失,并显示出良好的生物相容性和生物安全性[47]。此外,含CGA的复合海藻酸钠水凝胶/杜仲橡胶膜作为新型抗菌伤口敷料已有研究报道,体外对大肠埃希菌和金黄色葡萄球菌具有抵抗作用,且可加速伤口愈合[48]。李肖寒等[49]研究发现利用水溶性天然高分子材料透明质酸(hyaluronic acid,HA)与CGA形成的水溶性缀合物HA-CGA较CGA单体有较强的抗菌活性,大大提高CGA的水溶性和生物利用度,改善抗菌性能。尽管CGA在人类的利用、代谢和排泄方面存在较大的个体差异,这可能与剂量、模型、细胞类型、个体差异以及肠道微生物群等因素有关,但是许多基础研究和临床研究已证明CGA是一种抗菌活性好的天然化合物。
CGA可联合抗生素发挥协同抗菌作用。有研究报道CGA联合左氧氟沙星协同抑制生物膜形成,其抗菌效果比单独使用更为显著[50]。CGA破坏生物膜基质中胞外多糖的结构,使左氧氟沙星渗透到细菌生物膜的内层,影响细菌生物膜形成的多种途径和靶点,包括通过静电干扰细菌和/或糖萼对基质的黏附;激活或释放相关胞外蛋白酶以破坏胞外多糖;抑制细菌核酸的合成,减少细胞外DNA的量;以及细菌生长固定期的杀菌作用[21]。有溴化乙锭积累和棋盘协同作用的测定结果表明,CGA联合四环素对大肠埃希菌具有良好的协同作用,其FIC指数为0.25,这种协同作用直接将抗生素剂量减少了128倍[17],一般抗生素无法穿透革兰阴性菌完整的外膜,但当CGA破坏细菌外膜完整性后,使细胞膜通透性增加,使足够浓度的抗生素能够穿透受损的外膜进入细胞内,发挥效应。同样地,CGA和唑类抗生素都对膜渗透性起作用,可协同抵抗白念珠菌,提高抗菌活性。因此,CGA联合抗生素使用可以提高多重耐药菌对抗生素的敏感性,使其最大程度杀灭细菌,减少耐药性的产生,这表明CGA可能作为一种增强剂联合抗生素协同抗菌。
4 小结与展望
4.1 小结
临床上多重耐药菌的出现和广泛传播是感染患者死亡的主要原因,寻找新型抗菌药是研究的重点。近年来,越来越多的学者开始关注和研究CGA对临床菌株和多重耐药菌株的抗菌作用及机制,主要包括抑制细菌生物膜形成、增加细胞膜通透性和破坏细胞完整性、扰乱细胞代谢及调控信号转导通路等,而抗菌效果与CGA及其化合物浓度、处理时间和细菌耐药性等直接相关。已有大量研究表明CGA联合抗生素或者负载抗菌纳米材料可以提高其生物活性和抗生素敏感性,最大限度地减少药物毒性,限制耐药性。加之CGA对细菌的选择性压力小,可以克服抗生素易产生耐药性的缺点,更加坚定了CGA可作为一种安全的抗菌药物或佐剂治疗和控制微生物感染,具有很高的临床应用价值。
4.2 展望
CGA是一種分布广泛、抗菌活性好的天然化合物,主要来源于植物。而我国拥有丰富的CGA植物资源如金银花、杜仲和向日葵等,但对其利用效率远落后于发达国家,且CGA的口服生物利用度低,静脉注射可能产生过敏反应。因此,对CGA的生物利用度、抗菌作用机制、毒理学和临床研究等方面仍有待深入探索和完善。对于未来的研究应主要从以下两方面入手:一方面,应该把握优势,合理利用丰富资源,发展CGA的提取纯化技术,提高提取物功效,增加其稳定性,促进药物的研发;另一方面,加大CGA对临床菌株的抗菌作用研究,开发体外和体内模型系统,对CGA进行更多临床药理和安全性评估,同时进行更多宿主免疫学研究,以确定CGA在动物和人类中的最大有效和安全剂量,深入研究CGA及其代谢产物的抗菌机制。
参 考 文 献
王庆华, 杜婷婷, 张智慧, 等. 绿原酸的药理作用及机制研究进展[J]. 药学学报, 2020, 55(10): 2273-2280.
Naveed M, Hejazi V, Abbas M, et al. Chlorogenic acid (CGA): A pharmacological review and call for further research[J]. Biomed Pharmacother, 2018, 97: 67-74.
Bagdas D, Gul Z, Meade J A, et al. Pharmacologic overview of chlorogenic acid and its metabolites in chronic pain and inflammation[J]. Curr Neuropharmacol, 2020, 18(3): 216-228.
Lee T K, Kang I J, Kim B, et al. Experimental pretreatment with chlorogenic acid prevents transient ischemia-induced cognitive decline and neuronal damage in the hippocampus through anti-oxidative and anti-inflammatory effects[J]. Mole, 2020, 25(16): 3578
王玲娜, 姚佳欢, 马超美. 绿原酸的研究进展[J]. 食品与生物技术学报, 2017, 36(11): 1121-1130.
Lou Z X, Wang H X, Zhu S, et al. Antibacterial activity and mechanism of action of chlorogenic acid[J]. J Food Sci, 2011, 76(6): M398-403.
屈景年, 莫运春, 刘梦琴, 等. 金银花中绿原酸一步提取法及绿原酸抗菌活性[J]. 化学世界, 2005(3): 167-169.
元超, 王鸿发, 胡璇, 等. 艾纳香中绿原酸类化学成分研究 [J]. 热带作物学报, 2019, 40(6): 1176-1180.
Su M, Liu F, Luo Z, et al. The antibacterial activity and mechanism of chlorogenic acid against foodborne pathogen Pseudomonas aeruginosa[J]. Foodborne Pathog Dis, 2019, 16(12): 823-830.
Miao M S, Xiang L L. Pharmacological action and potential targets of chlorogenic acid[J]. Adv Pharmacol, 2020, 87: 71-88.
Wu Y, Liang S, Zhang M, et al. The effect of chlorogenic acid on Bacillus subtilis based on metabolomics[J]. Mole, 2020, 25(18): 4038.
Le Y J, He L Y, Li S, et al. Chlorogenic acid exerts antibacterial effects by affecting lipid metabolism and scavenging ROS in Streptococcus pyogenes[J]. FEMS Microbi Let, 2022, 369(1): 1-8.
Primavilla S, Pagano C, Roila A R, et al. Antibacterial activity of Crocus sativus L. petals extracts against foodborne pathogenic and spoilage microorganisms, with a special focus on clostridia[J]. Life (Basel), 2022, 13(1): 60.
曾铭, 鲁兰, 樊荣, 等. 绿原酸体内代谢产物抗金黄色葡萄球菌生物被膜作用及机制研究[J]. 中药药理与临床, 2021, 37(3): 34-41.
Xu W Y, Zhang X C, Wang L B, et al. Effect of chlorogenic acid on the quorum-sensing system of clinically isolated multidrug-resistant Pseudomonas aeruginosa[J]. J App Microbi, 2021, 132(2): 1008-1017.
Wang L B, Zhang Y, Liu Y, et al. Effects of chlorogenic acid on antimicrobial, antivirulence, and anti-quorum sensing of carbapenem-resistant Klebsiella pneumoniae[J]. Front Microbi, 2022, 13: 997310.
Samreen Q F A, Ahmad I. In silico screening and in vitro validation of phytocompounds as multidrug efflux pump inhibitor against E. coli[J]. J Biomol Struct Dyn, 2023, 41(6): 2189-2201.
Zhang G Y, Yang Y Q, Memon F U, et al. A natural antimicrobial agent: Analysis of antibacterial effect and mechanism of compound phenolic acid on Escherichia coli based on tandem mass tag proteomics[J]. Fronti Microbi 2021, 12: 738896.
Rajasekharan S K, Ramesh S, Satish A S, et al. Antibiofilm and anti-beta-Lactamase activities of burdock root extract and chlorogenic acid against Klebsiella pneumoniae[J]. J Microbiol Biotechnol, 2017, 27(3): 542-551.
Feng S Y, Zhang Y H, Fu S D, et al. Application of chlorogenic acid as a substitute for antibiotics in multidrug-resistant Escherichia coli-induced mastitis[J]. Inter Immuno, 2023, 114: 109536.
Lu L, Zhao Y, Yi G, et al. Quinic acid: A potential antibiofilm agent against clinical resistant Pseudomonas aeruginosa[J]. Chinese Med, 2021, 16(1): 72.
Rocha D A, Silva C, Sa L, et al. Evaluation of the antifungal effect of chlorogenic acid against strains of Candida spp. resistant to fluconazole: Apoptosis induction and in silico analysis of the possible mechanisms of action[J]. J Med Microbiol, 2022, 71(5): 1-17.
Sharma D, Misba L, Khan A U. Antibiotics versus biofilm: An emerging battleground in microbial communities[J]. Antimicr Resist Infect, 2019, 8: 76.
Wang H, Chu W H, Ye C, et al. Chlorogenic acid attenuates virulence factors and pathogenicity of Pseudomonas aeruginosa by regulating quorum sensing[J]. App Microbi Biotech, 2018, 103(2): 903-915.
贾雯, 郭瑞林. 肺炎克雷伯菌生物膜形成及调控机制的研究进展 [J]. 中国医学科学院学报, 2021, 43(6): 936-944.
Dan B Z, Dai H P, Zhou D G, et al. Relationship between drug resistance characteristics and biofilm formation in Klebsiella pneumoniae strains[J]. Infect Drug Resist , 2023, 16: 985-998.
Chen K, Peng C, Chi F, et al. Antibacterial and antibiofilm activities of chlorogenic acid against Yersinia enterocolitica[J]. Front Microbiol, 2022, 13: 885092.
羅艺晨, 黄利明, 杨颖, 等. 绿原酸抑制金黄色葡萄球菌机理研究[J]. 西南大学学报(自然科学版), 2016, 38(3): 15-19.
Ren S, Wu M, Guo J, et al. Sterilization of polydimethylsiloxane surface with Chinese herb extract: A new antibiotic mechanism of chlorogenic acid[J]. Sci Rep, 2015, 5: 10464.
Sun Z L, Zhang X X, Wu H H, et al. Antibacterial activity and action mode of chlorogenic acid against Salmonella enteritidis, a foodborne pathogen in chilled fresh chicken[J]. World J Microbi Biotech, 2020, 36(2): 24.
Yang L, Zhang C L, Su Z J, et al. Inactivation of Salmonella typhimurium SL1344 by chlorogenic acid and the impairment of cellular integrity[J]. Front Microbi, 2022, 13: 887950.
Tan S, Yan F, Li Q, et al. Chlorogenic acid promotes autophagy and alleviates Salmonella typhimurium infection through the lncRNAGAS5/miR-23a/PTEN axis and the p38 MAPK pathway[J]. Front Cell Dev Biol, 2020, 8: 552020.
Zhang Y Z, Zhu C Y, Zhao H J, et al. Anti-inflammatory effect of chlorogenic acid in Klebsiella pneumoniae-induced pneumonia by inactivating the p38MAPK pathway[J]. Inter J Med Microbi, 2023, 313(2): 151576.
Lee B, Lee D G. Depletion of reactive oxygen species induced by chlorogenic acid triggers apoptosis-like death in Escherichia coli[J]. Free Radic Res, 2018, 52(5): 605-615.
Wang L, Bi C, Cai H, et al. The therapeutic effect of chlorogenic acid against Staphylococcus aureus infection through sortase A inhibition[J]. Front Microbiol, 2015, 6: 1031.
Guan S S, Zhu K T, Dong Y J, et al. Exploration of binding mechanism of a potential Streptococcus pneumoniae neuraminidase inhibitor from herbaceous plants by molecular simulation[J]. Interna J Mole Sci, 2020, 21(3): 1003.
Li Q R, Tan S R, Yang L, et al. Mechanism of chlorogenic acid in alveolar macrophage polarization in Klebsiella pneumoniae-induced pneumonia[J]. J Leukoc Biol, 2021, 112(1): 9-21.
Liu D, Chen Z, Yuan Y, et al. Innate immune effectors play essential roles in acute respiratory infection caused by Klebsiella pneumoniae[J]. J Immunol Res, 2020: 5291714.
Martinez G, Regente M, Jacobi S, et al. Chlorogenic acid is a fungicide active against phytopathogenic fungi[J]. Pestic Biochem Physiol, 2017, 140: 30-35.
Yun J E, Lee D G. Role of potassium channels in chlorogenic acid-induced apoptotic volume decrease and cell cycle arrest in Candida albicans[J]. Biochimica et Biophysica Acta (BBA) - General Subjects, 2017, 1861(3): 585-592.
Sung W S, Lee D G. Antifungal action of chlorogenic acid against pathogenic fungi, mediated by membrane disruption[J]. Pure Appl Chem, 2010, 82(1): 219-226.
Lu H, Tian Z, Cui Y, et al. Chlorogenic acid: A comprehensive review of the dietary sources, processing effects, bioavailability, beneficial properties, mechanisms of action, and future directions [J]. Compr Rev Food Sci Food Saf, 2020, 19(6): 3130-3158.
Feitosa B F, De Alc?ntara C M, De Lima A B S, et al. Bioactive natural products for chemical control of microorganisms: Scientific prospecting (2001–2021) and systematic review[J]. Molecules, 2022, 27(18): 5917.
Wang Z, Zhai X, Sun Y, et al. Antibacterial activity of chlorogenic acid-loaded SiO2 nanoparticles caused by accumulation of reactive oxygen species[J]. Nanotechnology, 2020, 31(18): 185101.
Mei L, Ren Y, Gu Y, et al. Strengthened and thermally resistant poly(lactic acid)-based composite nanofibers prepared via easy stereocomplexation with antibacterial effects[J]. ACS Appl Mater Interfaces, 2018, 10(49): 42992-43002.
Shahabadi N, Akbari A, Karampour F, et al. In vitro cytotoxicity, antibacterial activity and HSA and ct-DNA interaction studies of chlorogenic acid loaded on gamma-Fe2O3@SiO2 as new nanoparticles[J]. J Biomol Struct Dyn, 2022: 1-21.
Li H, Xu J, Hu J F, et al. Sustained release of chlorogenic acid-loaded nanomicelles alleviates bone loss in mouse periodontitis[J]. Biomater Sci, 2022, 10(19): 5583-5595.
Guo C F, Zhou Z Y, Zhang S Q, et al. Sulfonated, quaternized, and chlorogenic acid composited sodium alginate hydrogels/Eucommia ulmoides rubber films as in vitro antibacterial wound dressings for accelerating wound healing[J]. Industrial Crops Products, 2022, 190: 115885.
李肖寒, 程雪丹, 張智博, 等. 绿原酸缀合物HA-CGA的抗菌活性研究[J]. 中国抗生素杂志, 2023, 48(1): 49-53.
Tan S R, Gao J, Li Q R, et al. Synergistic effect of chlorogenic acid and levofloxacin against Klebsiella pneumonia infection in vitro and in vivo[J]. Sci Rep, 2020, 10(1): 20013.

