抑制细菌碳酸酐酶作为应对细菌耐药性的新策略
杨江流 海珍珍 贾芳 周学章

摘要:细菌对抗生素的多重耐药和交叉耐药亟需联合其他有效的靶向替代策略进行控制。碳酸酐酶(carbonic anhydrases,CAs)是催化CO2水合生成HCO3-和H+的可逆反应的一组金属酶超家族,其活性影响细菌的增殖、生物合成及其在宿主体内的持续感染。靶向抑制CAs活性可降低细菌的生存和适应性,并且不会产生与传统抗生素相同的耐药性。细菌CAs有望成为开发尚无临床耐药性的新型抗菌药物靶标。本文对细菌CAs的分类和结构、生理功能以及细菌现有的CA抑制剂(CA inhibitors,CAIs)的研究进展进行了综述,可为新型抗菌药物研发、解决临床耐药问题提供参考。
关键词:细菌碳酸酐酶;抑制剂;细菌耐药性;控制
中图分类号:R978.1文献标志码:A
Inhibition of bacterial carbonic anhydrase as a new strategy to combat bacterial drug resistance
Abstract Bacterial multi-resistance and cross-resistance to antibiotics urgently need to be controlled in combination with other effective targeted alternative strategies. Carbonic anhydrase (CAs) is a metalloenzyme superfamily that catalyzes the reversible reaction of CO2 hydrating to HCO3- and H+, and its activity affects bacterial proliferation, biosynthesis and persistent infection of pathogens in the host. Targeted inhibition of CAs activity may reduce bacterial survival and adaptation, but it does not produce the same antibiotic resistance as conventional antibiotics. Bacterial CAs hold promise as targets for the development of novel antibacterial drugs that are not yet clinically resistant. The paper provided reviews of the classifications and structures of bacterial CAs, their physiological functions, and the progress of research on existing CA inhibitors in bacteria, which can provide a reference for the development of new antibacterial drugs and solve clinical drug resistance problems.
Key words Bacteria carbonic anhydrase; Inhibitors; Bacterial resistance; Control
近几十年,抗生素耐药性在致病菌中的出现和传播已成为一个日益严峻的公共卫生问题。由于细菌对已知的所有抗生素都可能存在耐药,导致常规治疗对耐药细菌引起的感染通常没有作用,甚至对“最后一道防线” 抗生素也失去了效力。而目前抗生素研发投资的下降和新抗生素开发的创新不足[1],迫切需要人们利用系统生物学、基因组学和结构生物学的方法重新理解细菌耐药的分子机制,利用有关抗生素耐药性的新知识指导设计不受或规避耐药机制影响的新型治疗药物[2]。
对抗耐药性的一个可行的方法是鉴定对病原微生物的生命周期和/或毒力至关重要的酶,并开发能够干扰其活性的分子[3-4]。碳酸酐酶(CAs,EC 4.2.1.1)是一组金属酶超家族,其活性影响细菌的增殖、生物合成及其在宿主体内的持续感染[5]。通过抑制CA活性可能会降低细菌的生存和宿主适应性,而且不会产生与传统抗生素相同的耐药性。另外,由于许多细菌CAs属于不同的酶家族,这些酶家族有的在人类中不存在(如β-和γ-CAs),或者与人类CAs亞型具有明显的结构差异[6]。因此,细菌CAs可能成为开发不产生临床耐药性的新型抗菌药物有希望的目标。本文对细菌CAs的结构、功能及现有的细菌CAIs进行了总结,可以为CAs作为对抗抗生素耐药性的一种新策略提供参考。
1 CAs概况
CAs于1933年由Meldrum和Roughton在研究血液CO2/碳酸氢盐转运的实验中发现,他们注意到生物体内大量代谢生成的CO2在体外生理pH值下显示相对较低的水合速率,暗示应该有一种高效的催化剂使这两种物质相互转化[5]。这种催化剂后来被证明是一种金属酶,并被命名为碳酸酐酶(CAs)。CAs普遍存在于生命体的3个领域(古细菌、细菌和真核生物)(表1)。在细胞中,CAs位于不同的亚细胞区室(例如,细胞质、周质、鞭毛、线粒体和质体)中,可高效(kcat=104~106 /s)催化CO2水合生成碳酸氢盐和质子这种简单但生理上至关重要的反应:CO2+H2O?HCO3?+H+,在生物体pH调控、呼吸、光合作用和碳代谢相关的多种生物过程中发挥关键作用[6]。现已确定的CAs家族分为α、β、γ、δ、ζ、η、θ和ι[7-8]8类,虽然8类CAs在进化上起源于同一祖先,但它们在系统发育上是不相关的,表现为不同类别CAs的代表性氨基酸序列显示出低序列相似性和不同的折叠结构。相比之下,CO2可逆水合的机制在所有CA类别中则严格保守,包括参与CA辅因子的金属离子、催化位点的氨基酸序列以及其低聚状态。说明CA超家族具有普遍的收敛进化(convergent evolution)特征[9-11]。
CA催化位点包含的催化所必需的金属离子辅因子由来自CA蛋白质骨架的3个氨基酸残基和1个H2O/OH-配位(H2O/OH-在酶的可逆催化中充当亲核试剂)组成。大多数CAs使用Zn2+作为金属辅助因子,一些CAs也可以配位如Co2+、Cd2+、Fe2+和Mn2+等金属离子[5,7,12-13]
(表1)。另外,参与金属配位的氨基酸残基在CA类之间存在差异。例如,由3个His残基配位的α-、γ-、δ-和θ-CAs;由1个His和2个Cys残基配位的β-和ζ-CAs;而在η-类中由2个His和1个Gln残基配位[13-14]。在硅藻ι-CAs中,参与Mn2+配位的假定残基是2个His、1个Asp和1个Glu,但Mn2+是否具有催化作用尚未明确[15]。
CAs晶体结构显示,α-CAs通常以单体或二聚体形式发挥催化活性;β-CAs作为二聚体、四聚体或八聚体时具有活性;γ-CAs必须以三聚体形式实现其催化功能,且γ-CAs单体中串联重复的六肽对于三聚体中β螺旋结构的左手折叠至关重要[16-18];θ-CAs的X射线结构与β-CAs非常相似;ζ-CAs被认为是由3个重复序列(R1、R2和R3)通过共价键连接形成可能的单体结构,每个重复序列都含有自己的活性位点,Zn2+和Cd2+可以在ζ-CAs的活性位点自发交换以适应海洋的贫金属环境[19](表1)。目前还缺乏关于δ-和η-CAs的结构信息。另外,α-、η-、θ- 和ι-CAs可催化酯/硫酯水解的酯酶活性,而在其他CAs家族中没有检测到[7,13]。
2 细菌CAs的分类和结构
在寻找具有新作用机制抗生素的过程中,人们开始对病原菌生命周期至关重要的CAs进行了详细研究。近几年对引起严重感染的大多数细菌病原体CAs克隆并进行了鉴定和表征。目前已知的4类细菌CAs包括α-、β-、γ-和ι-CAs,具有前文述及的CAs的普遍结构特征。以下结合每类具有代表性的细菌病原体CAs进行总结。
2.1 α-CAs
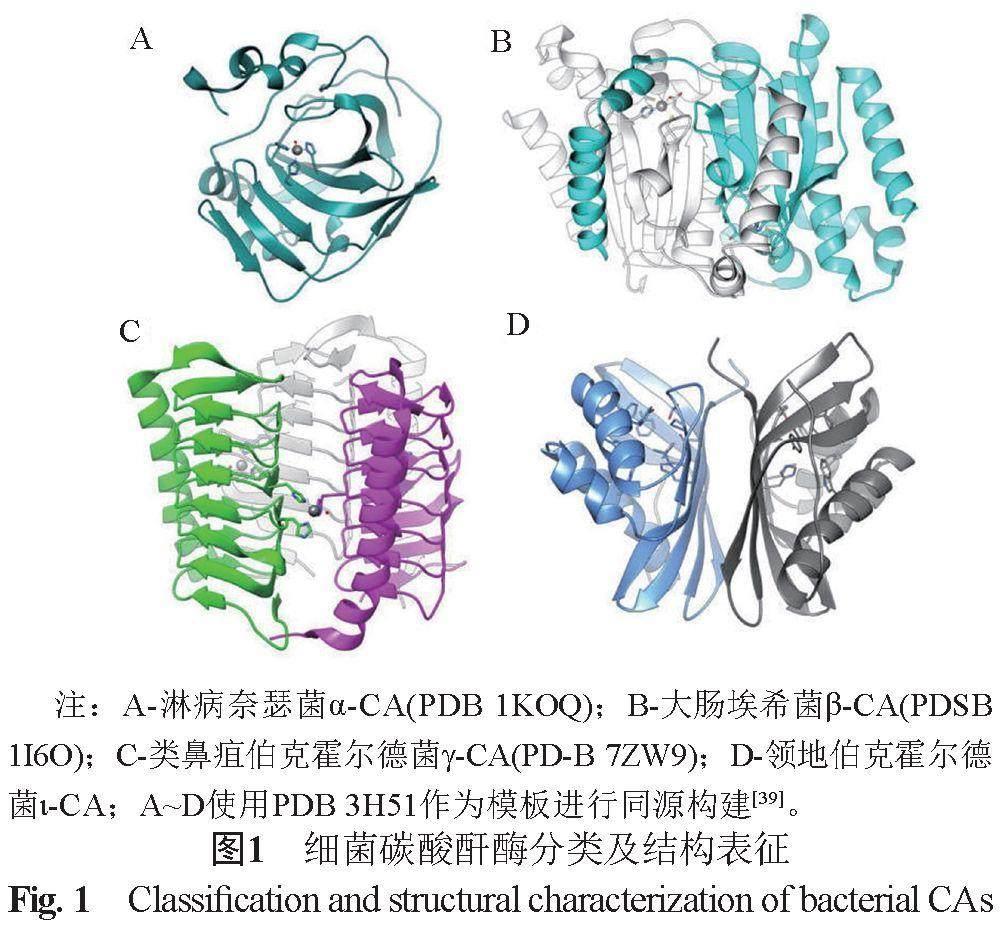
已发现的细菌α-CAs仅存在于革兰阴性菌基因组中[11]。细菌α-CAs的一个共同特征是在氨基酸序列的N末端存在分泌信号肽,该信号肽允许α-CAs在细胞周质定位。近几年,来自淋病奈瑟菌(Neisseria gonorrhoeae)、干燥奈瑟菌(Neisseriaceae sicca)、幽门螺杆菌(Helicobacter pylori)和霍乱弧菌(Vibrio cholerae)的α-CA已经被克隆,并对其进行了详细描述。淋病奈瑟菌α-CA(α-NgCA)的分子量为28 kDa,与人CA II(hCAII)高度同源,两者具有基本相同的三维结构,α-NgCA中仅有的2个Cys残基通过二硫键连接并在细胞周质定位。α-NgCA多以单体形式存在,显示出高CO2水合酶活性(类似于hCA II)以及水解对硝基苯乙酸酯的酯酶活性[21-22]。hCAII活性位点中的所有氨基酸残基在α-NgCA中都是保守的,并且具有相似的结构位置。α-NgCA的金属辅因子Zn2+位于酶活性位点疏水腔的底部,可由3个His残基和磺酰胺部分的N原子(或可由未受抑制的酶中的水分子)四面体配位(图1A)。与其他细菌α-CAs一样,α-NgCA少数螺旋区域的长缺失导致结合Zn2+的3个表面显著缩短,使活性位点腔疏水部分的入口扩大[21]。因此,与哺乳动物α-CAs相比,细菌α-CAs显示出更紧凑的结构。细菌CAs的三维结构显示,α-CAs的催化口袋较β-CAs大,γ-CAs最小(细菌ι-CAs尚无晶体结构)。因此,α-CAs的催化效率比β-CAs和γ-CAs的要高[11,23-24],
而一些细菌γ-CAs的催化转换数(Kcat)高于β-类,例如牙龈卟啉单胞菌(Porphyromonas gingivalis)和霍乱弧菌γ-CA的Kcat值高于其对应菌β- CA的Kcat值[25-26]。
2.2 β-CAs
在一些缺乏α-CAs的革兰阴性细菌中,已经发现存在β-、γ-和ι-CAs。X射线晶体已经解析了如大肠埃希菌(Escherichia coli)、流感嗜血杆菌(Haemophilus influenzae)、结核分枝杆菌(Mycobacterium tuberculosis)、肠炎沙门菌(Salmonella enteritidis)、类鼻疽伯克霍尔德菌(Burkholderia pseudomallei)和霍乱弧菌以及其他几种细菌的β-CA[16, 27-31]。这些酶的三维结构相当保守,目前发现的所有结晶的细菌β-CAs都具有二聚体或四聚体活性。与α-和γ-CAs不同的是,β-CAs类的成员具有显著的α螺旋特性,酶的活性位點呈现出一个相当长的通道,通道底部的Zn2+由一组不同的氨基酸残基配体进行四面体配位[32](图1B)。β-CAs的活性高度依赖于细菌生理pH值,当pH值<8.3时,酶活性位点处于封闭状态(“封闭活性位点”),酶无催化活性;当pH值>8.3时,“封闭活性位点”转化为有催化活性的“开放活性位点”, 酶催化活性增加;pH值接近9.0时显示出最大活性。这与β-CAs中Zn2+结合的保守Asp残基的移动以及水分子与Zn2+的配位有关。
大多数细菌β-CAs表现出优异的CO2水合酶活性,但缺乏酯酶活性,类似于从其他生物体(植物、节肢动物等)分离的β-CAs。从病原体中克隆、纯化并鉴定的相当数量的β-CAs可以在体外被磺胺类药抑制(可达低纳摩尔范围)[6]。然而,在体内仅可观察到幽门螺杆菌、肺炎链球菌(Streptococcus pneumoniae)、猪布鲁菌(Brucella suis)、粪肠球菌(Enterococcus faecalis)和结核分枝杆菌(Mycobacterium tuberculosis)的生长被抑制[33-35]。
2.3 γ-CAs
在古细菌中,Ferry小组首次报道了来自嗜热甲烷八叠球菌(Methanosarcina thermophila)的γ-CA(carbonic anhydrase methanosarcina,Cam),Cam采用左旋的平行β螺旋折叠形成活性三聚体,3个含Zn2+的活性位点位于2个单体之间的界面,1个Glu残基(α-CAs中为His残基)作为质子穿梭残基(proton shuttle residue,PSR) 将催化过程中产生的质子转移出活性位点[36]。尽管γ-CAs类成员间具有显著的结构相似性,但这些蛋白质显示出从非活性CA(如流产布鲁菌的γ-CA和嗜热杆菌HB8 γ-CA)到强活性CA(如Cam)完全不同的催化活性水平[37]。这些密切相关的蛋白质活性差异的分子基础尚不清楚,γ-CAs的功能在很大程度上仍未确定[38]。
类鼻疽伯克霍尔德菌是1种广泛存在于环境和人体中的革兰阴性菌,感染人类可引起类鼻疽。该菌对多种抗生素存在广泛耐药性。最近对来自类鼻疽伯克霍尔德菌的γ-CA(BpsγCA)进行了晶体学结构表征,BpsγCA表现出与先前表征的其他γ-CA家族成员相似的结构[37]。BpsγCA具有非常稳定的三聚体结构,每个单体结构由1个左旋平行β螺旋、1个反平行β链和1个与β螺旋轴反平行的长α螺旋组成(图1C)。在单体-单体之间的界面上具有3个活性位点,每个活性位点都包含一个由3个His残基和1个H2O/OH-进行四面体配位的Zn2+。研究发现,2-β-巯基乙醇(BME)分子可以通过氢键固定在与Zn2+结合的水分子上,使BME位于BpsγCA活性位点的碳酸氢盐结合口袋处[37]。这一发现,以及结合几种hCA抑制剂(如酚、羧酸和多胺)可以锚定在Zn2+配位的水分子上的抑制机制,可能为BpsγCA的选择性抑制剂的设计提供思路。
2.4 ι-CAs
2019年,Jensen等[7]在研究硅藻Thalassosira pseudonana的基因組时首先发现了ι-CA(LCIP63-ιCAs),LCIP63-ιCAs的同系物在其他硅藻、藻类、细菌和古细菌的基因组中也被发现。LCIP63-ιCAs及其同系物显示出与先前鉴定的任何已知CA类完全不同的一级序列和催化所必需的相同的保守氨基酸残基。细菌ι-CAs的多肽链在N末端呈现出19个或更多氨基酸残基的前肽序列,并包含一个或两个重复的结构域。氨基酸序列与一组注释为SgcJ/EcaC氧化还原酶家族的蛋白质同源,具有疏水口袋,可以构成假定的底物结合或催化活性位点。值得注意的是,在所有ι-CAs的C末端结构域中存在(H)HHSS氨基酸残基基序,可能是ι-CAs的一个特定结构特征[15]。
2020年,Del Prete等[20]在领地伯克霍尔德菌(Burkholderia territorii)基因组中鉴定了重组ι-CA(BteCAι)。BteCAι可以以二聚体形式存在,是CO2水合成碳酸氢盐和质子的良好催化剂。结构预测模型表明,BteCAι由2个等效单体形成,表现为“蝴蝶”结构,其中Zn2+活性位点的离子辅因子可能由1个单体的2个His和另1个单体的1个His配位。BteCAι对磺胺、氨基磺酸盐和磺酰胺的抑制敏感(图1D)。
3 细菌CAs的生理功能
在细菌中,CAs催化的反应是唯一已知的快速获得和平衡内源性CO2、H2CO3、HCO3-和CO32-的途径[10]。凭借其催化活性,CAs为细菌生物合成提供不可或缺的CO2和碳酸氢盐,确保微生物的生存和/或满足微生物的代谢需求。体内实验已证明,大气CO2浓度下的细菌生长取决于细菌CAs的活性。罗氏真养菌(Ralstonia eutropha, 一种在土壤和水中发现的兼性化能自养菌)Δcan(can编码β-CA)突变株25-1与野生株H16相比,仅在CO2浓度升高的情况下允许异养生长(高CO2需求表型),表明细菌在低CO2浓度下的生长需要足够的CA活性[40]。大肠埃希菌中的两种β-CA(CynT和CynT2)均可催化CO2生成HCO3-,以防止在大气CO2浓度下氰酸盐依赖性碳酸氢盐水解和细菌膨胀导致的碳酸氢盐耗竭[41]。布鲁菌属和立克次体属细菌[42]、流感嗜血杆菌[43]以及结核分枝杆菌[44]中的CA基因缺失使得它们只能适应高CO2水平的生态位。幽门螺杆菌基因组编码的CA对胃内病原体的酸适应和生存至关重要[45]。
体内证据表明CAs还参与了人类致病菌(如霍乱弧菌[46]、猪布鲁菌[47]、肠炎沙门菌[48-49]、铜绿假单胞菌[50]和肠球菌[35]等)的致病性和毒力。研究表明,碳酸氢盐通过上调霍乱弧菌ToxT(一种直接激活编码霍乱毒素活性的基因转录调节蛋白)来刺激霍乱毒素毒力基因的表达[11],CAIs的加入可显著降低毒力基因表达。HCO3-在被霍乱弧菌定植的小肠上部以高浓度存在,表明霍乱弧菌可能使用CA作为一种宿主定植系统并增强细菌毒力[51]。当肠道血清型鼠伤寒沙门菌感染巨噬细胞时,预测的细菌β-CA基因(mig5)上调,该基因编码的蛋白质参与了小鼠肠道细菌定植的适应[48]。铜绿假单胞菌在感染过程中可能导致软组织钙化或结石形成,引发囊性纤维化和感染性心内膜炎。研究发现,铜绿假单胞菌携带的β-CA(psCA1)在细胞CaCO3沉积中起主要作用。psCA1基因的缺失显著降低了细胞周围的钙沉积,同时减弱了病原体的毒力(与感染野生型铜绿假单胞菌相比,感染ΔpsCA1突变体的蜡虫未观察到死亡)。另外,氨基苯磺酰胺和乙酰唑胺(AAZ)在纳摩尔水平上可抑制psCA1活性,显著减少CaCO3的沉积[50]。
4 细菌CAIs种类
目前已在多种细菌病原体中鉴定出属于α-、β-和/或γ-CA类的CAs[11],而在已知的8类CA中,只有α-CAs存在于人类[52]。基于这一结果,β-和γ-CAs已被列为潜在的新型抗菌药物靶标。文献报道细菌CAs可被磺胺类及其等排物、阴离子、二硫代氨基甲酸酯盐类和羧酸类等化合物抑制[53-54]。
4.1 磺胺类药及其等排物
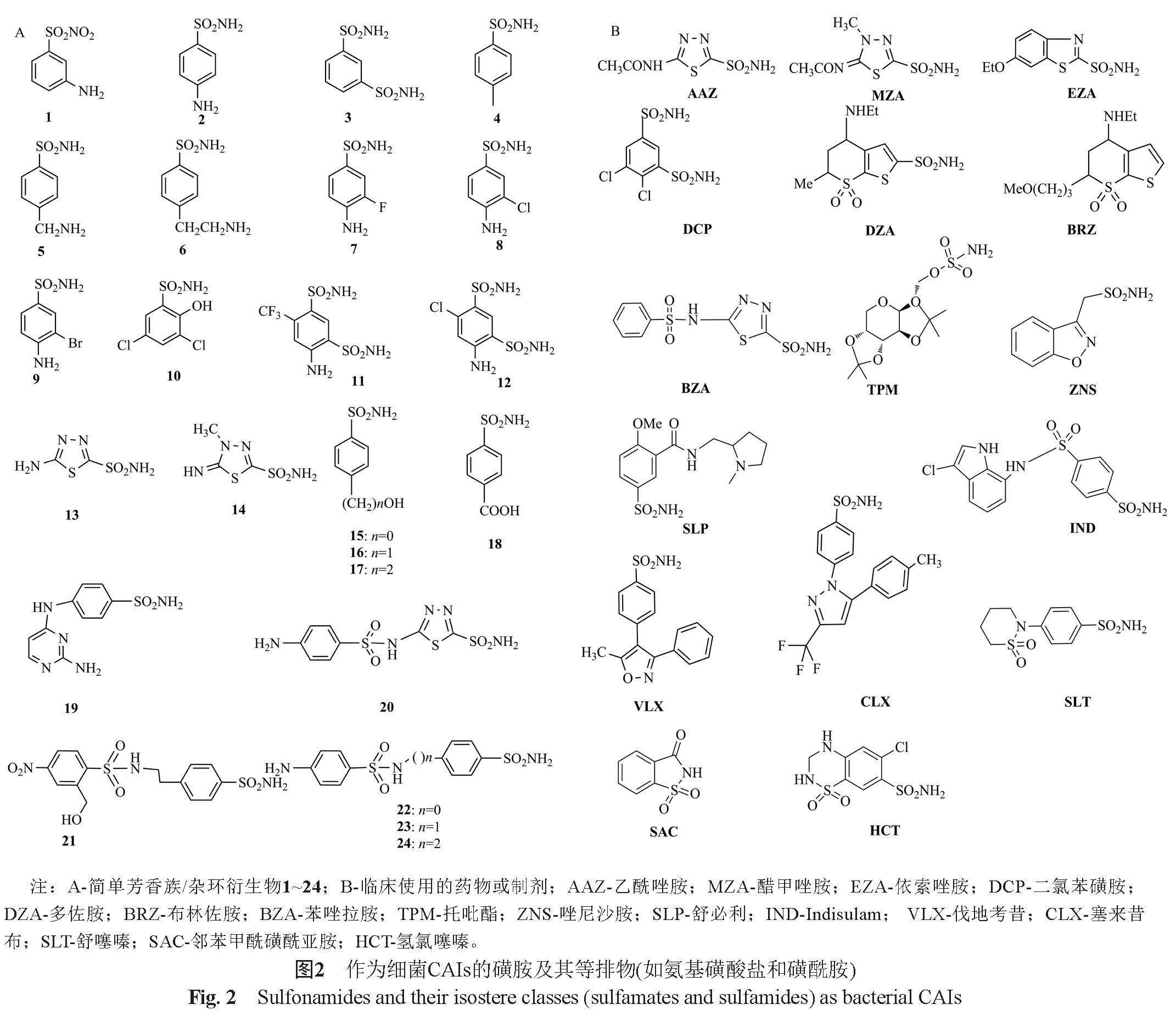
从发现磺胺作为抑菌剂开始,一系列磺胺类抗菌药物已进入临床应用,其中许多化合物仍被广泛使用。磺胺及其等排物(如氨基磺酸盐和磺酰胺)具有结构通式A-SO2NH-R[A可以是脂肪族、芳香族、杂环基团或糖支架,R可以是氢(伯磺胺/氨基磺酸盐/磺酰胺),或包含杂原子的多个部分(如-OH、-NH2等),以及如A所述的有机支架]。包含伯磺胺部分(-SO2NH2)的磺胺及其等排物以四面体几何结构结合到CAs去质子化的Zn2+上(其中磺胺部分的氮原子与Zn2+配位),CAs氨基酸残基参与锚定抑制剂以形成扩展的氢键网络,芳香族/杂环部分与酶活性中心空腔的亲水和疏水残基相互作用,进而特异地抑制细菌CAs活性[39]。因此,磺胺类及其等排物对细菌CAs的抑制可能用于对抗许多病原体对现有抗菌药物的耐药性。图2展示了这些磺胺类抑制剂的简单衍生物(化合物1~24)和临床使用中的药物或制剂(AAZ-HCT)。
一系列含有-SO2NH2基团的化合物已在体外和体内(包括耐药菌感染小鼠模型)被证实是CAs的有效抑制剂。AAZ在体外和小鼠生殖道感染模型中抑制了淋病奈瑟菌的生长[55]。以AAZ为支架合成的两种衍生物(参考文献[56]中的化合物22和26)能以耐万古霉素肠球菌(vancomycin-resistant Enterococcus, VRE)编码的α-和γ-CA为靶点,高效抑制VRE活性[56];另外,在两种VRE感染的小鼠模型(小鼠VRE去定植模型和VRE败血症模型)中测试时,AAZ的表现优于利奈唑胺(一种抗VRE感染的一线药物)[57]。依索唑胺(EZA)是一种经授权的利尿剂和CAIs,可以在体外杀死幽门螺杆菌,表明它具有转化为抗幽门螺杆菌药物的潜力[58]。Portela等[59]证明,使用两种强效细菌CAs磺胺衍生物抑制剂(芳基磺酰基脲基苯磺酰胺SULFA1和SULFA2)预处理对牙本质强度和预防变形链球菌在牙齿中的定殖具有积极治疗效果。
4.2 阴离子
阴离子,如无机金属络合阴离子(硫氰酸盐、氰化物、叠氮化物、硫化氢、氨基磺酸盐)或羧酸盐(三硫代碳酸酯,TTC),可以与CAs酶活性位点四面体或三角-双锥体结构中的金属离子结合抑制酶活性[60]。和磺胺类药一样,阴离子抑制剂在病原体细菌中也进行了大量研究(表2)。相对于磺胺类药物抑制剂的亚微摩尔至纳摩尔浓度抑制常数(KI),阴离子抑制剂抑制效率通常较低(KI通常为毫摩尔或亚毫摩尔)。阴离子抑制剂对于理解CAs在许多生理过程的催化机制,以及设计具有有机支架的新型抑制剂,从而发现此类药物的全新家族都有重要意义。Del Prete等[61]研究了一组无机阴离子和小分子对霍乱弧菌VchCAα、VchCAβ和VchCAγ的抑制作用发现,硫酸盐是VchCAα和VchCAγ的中度抑制剂(KI=0.85~
9.65 mmol/L),最有效的VchCAγ抑制剂是N, N-二乙基二硫代氨基甲酸酯、氨基磺酸酯、氨基磺酰胺、苯硼酸和苯砷酸,其KI值范围为44~91 mmol/L,最活跃的VchCAα抑制剂是亚硫酸氢盐、亚硫酸氢盐、三硫代碳酸酯、N,N-二乙基二硫代氨基甲酸酯、氨基磺酰胺、氨基磺酸酯、苯硼酸和苯砷酸,其中KI值在 8~88 μmol/L
之間;而最有效的VchCAβ抑制剂是磺酰胺、氨基磺酸、苯硼酸和苯砷酸,其中KI值在54~86 μmol/L 之间。
4.3 二硫代氨基甲酸酯盐类
二硫代氨基甲酸酯(DTC)是化学式为R(R')CNS2(-)(R,R'=H、烷基和芳基)的单阴离子1,1-二硫代酸酯配体,DTC阴离子及其过渡金属和主族元素的金属盐作为多位点的广谱抗真菌杀菌剂,到目前为止仍没有任何有关其耐药性的记载。DTC作为CAIs是最近在研究无机阴离子作为CAIs时发现的。三硫代碳酸酯(TTC,CS32-)对hCA II有相对较弱的抑制作用,酶动力学和X射线晶体学显示,TTC通过其3个等效硫原子之一与hCA II催化位点的Zn2+配位,第二个硫原子与酶保守的Thr199氨基酸残基相互作用,第三个硫原子没有与酶发生相互作用。通过氮原子和有机支架取代TTC的第三个硫原子后合成了DTC,由于DTC的有机支架参与了与CAs活性位点的相互补充作用,DTC表现出对许多CAs异构体的微摩尔至低纳米摩尔的抑制作用。已有研究证实这些化合物对一些致病性结核分枝杆菌[33]、牙龈卟啉单胞菌[26,62]和淋病奈瑟菌[63]CA的微摩尔抑制作用。
4.4 羧酸类
羧酸类(图3)是一类非经典CAIs,包括苯酚、多胺、富勒烯、香豆素及其衍生物[64]。它们可以单齿或双齿的方式结合在CAs活性位点外阻止底物进入,或者锚定在Zn2+配位的H2O/OH-上,抑制CAs的催化活性,从而阻止底物的结合催化[65-66],表现出经典磺胺CAIs的非典型结合机制[64]。羧酸类已在霍乱弧菌、结核分枝杆菌,肺炎链球菌和淋病奈瑟菌等少数病原体细菌中进行了研究(表2)。
5 细菌CAIs的代谢及安全性
作为临床上主要使用的CAIs,磺胺类抑制剂已经在数百万患者中使用超过70年,证明其具有良好的药代动力学特性和耐受性。例如,临床研究最好的AAZ的I期临床试验中,89.5%的特发性颅内高压患者能够耐受>1 g/d的剂量6个月,45%的患者在同一时间段内耐受高达4 g/d的剂量,在成人口服250 mg后,其血浆消除半衰期为4~6 h,药物全部通过尿液排泄,不产生代谢产物[94-95]。研究还表明,由于hCAI和hCAII在红细胞中的表达,AAZ很容易进入血液中的红细胞部分,有效地形成了一个封存药物的池使AAZ的消除半衰期延长了一倍(~12 h)[94]。AAZ已被批准用作利尿剂,并用于治疗青光眼、癫痫以及与充血性心力衰竭的相关症状。由于α-CA存在于人体大多数组织中,并且大多数临床可用的CAIs对该酶的15种亚型中的多数具有相对的非选择性(取决于剂量),所以患者经常会出现由CA抑制引起的轻微副作用,并且在极少数情况下发生更严重的不良事件。如CA磺胺抑制类药物的典型副作用,包括刺痛、恶心、疲劳、体重减轻和厌食症,但在多数情况下会自行消失[96]。关于碳酸酐酶抑制剂安全性和代谢特征的详细描述可参阅文献[96]。
除临床已有的α-CA抑制剂以外,细菌其他CAIs(特别是新合成的CAIs)的安全性和药代动力学的研究很少。一项关于单硫代氨基甲酸酯(MTC)和二硫代氨基甲酸酯(DTC)系列的14种化合物对结核分枝杆菌β-CA3的抑制研究表明,该系列中的4种DTCs(参考文献[97]中的8~10和12)显示出非常显著的抑制效力(KI=2.4~43 nmol/L),有9种化合物在暴露5 d时对发育中的斑马鱼幼虫没有不良的表型影响[97]。以AAZ为支架合成的两种新化合物(参考文献[81]中的20和23)对淋病奈瑟菌的最小抑制浓度值为0.25 μg/mL,
抗菌活性比AAZ提高了8~16倍,并且可能对NgCA具有靶向作用。此外,浓度高达1 μg/mL的两种化合物对人宫颈管细胞系(End1/E6E7)和结直肠腺癌細胞系(Caco-2)没有表现出任何毒性影响[81] 。
6 细菌CAIs的耐药性
与传统抗生素相比,对细菌CAIs耐药的产生及相应的分子机制只有个别报道。一般认为,细菌不容易产生对CAIs的耐药性,相关的报道也证实了这一结论。例如,AAZ和EZA对淋病奈瑟菌均表现出抑菌活性,抗生素后效应(post-antibiotic effects)长达10 h,并且细菌对这两种药物的单步自发耐药突变频率(<5.42×10?9)低于利福平(1.1×1.0?7~1.5×1.0?7)[80]。另一项研究发现,EZA对幽门螺杆菌具有高抗菌活性,与利福平、甲硝唑和四环素相比,EZA对幽门螺杆菌具有较低的单步自发耐药突变频率(<5×10-9),表明细菌对EZA不容易形成耐药性[58]。该研究还发现,幽门螺杆菌在中性pH值时对EZA的抗性与3个基因突变有关。笔者认为UppS基因(编码磺胺类化合物靶标的十一碳烯基焦磷酸合酶)的突变(Glu173Lys)可能消除了EZA与该酶的有利相互作用或引入与EZA的空间位阻冲突(steric clashes),Cys29Arg和移码突变可能影响细菌代谢酶的整体调节和EZA进入幽门螺杆菌的途径,三者共同作用赋予EZA耐药性。另外,EZA与临床使用的抗幽门螺杆菌抗生素之间没有交叉耐药性[58]。未来需要对EZA和其他细菌CAIs引起的耐药性遗传决定因素深入研究,以探索CAIs成为开发新型抗菌药物的潜力。
7 结论与展望
目前,许多细菌已被研究是否存在CAs。一些细菌的CAs已被制备为重组酶,并从生物化学的角度对其进行了详细表征,发现了各种类型的抑制剂。许多细菌CAs可被经典的CAIs有效的抑制,如磺胺类及其衍生物和阴离子,其中一些可被二硫代氨基甲酸酯和羧酸抑制。最近关于AAZ及其衍生物作为VRE抑制剂的有效性的研究是该领域的一个突破。与临床使用的利奈唑胺相比,磺胺类药物对VRE的效率要高几个数量级[57]。
尽管目前在鉴定细菌CAs的结构与功能以及具有抗菌活性的CAIs方面取得了一些进展,但相对于人类CAs药物的发现,该领域仍处于起步阶段。迄今为止,还没有一种微生物CAs被证实为药物靶标,以细菌CAs作为可行的抗菌靶点仍存在相当大的挑战。例如,与人类CA亚型相比,对细菌表达的许多CA亚家族了解相对较少, CAs在细菌之间甚至在同一物种内的多样性和重要性可能限制了其开发为广谱抗生素的潜力;另外,CAs不是物种特异性酶,细菌CAIs(如磺胺类和异羟肟酸)的脱靶效应可能会干扰宿主CAs活性,导致宿主的毒副作用以及减少药物到达作用部位,从而阻止细菌CAIs成为可行的抗微生物靶标。因此,将来需要设计针对细菌而非人CAs的特异性和选择性的、不基于经典的磺胺类、氨基磺酸盐或氨基磺酰胺类的细菌CAIs(如酚类、多胺类、羧酸类和香豆素及其衍生物),使细菌CAs成为可行的抗菌药物靶点。
参 考 文 献
Frieri M, Kumar K, Boutin A. Antibiotic resistance[J]. J Infect Public Health, 2017, 10(4): 369-378.
Munita J M, Arias C A. Mechanisms of antibiotic resistance[J]. Microbiol Spectr, 2016, 4(2): VMBF-0016-2015.
Stokes J M, Lopatkin A J, Lobritz M A, et al. Bacterial metabolism and antibiotic efficacy[J]. Cell Metab, 2019, 30(2): 251-259.
Egorov A M, Ulyashova M M, Rubtsova M Y. Bacterial enzymes and antibiotic resistance[J]. Acta Natur, 2018, 10(4): 33-48.
Meldrum N U, Roughton F J. Carbonic anhydrase. Its preparation and properties[J]. J Physiol, 1933, 80(2): 113-142.
Capasso C, Supuran C T. Bacterial, fungal and protozoan carbonic anhydrases as drug targets[J]. Expert Opin Ther Targets, 2015, 19(12): 1689-1704.
Jensen E L, Clement R, Kosta A, et al. A new widespread subclass of carbonic anhydrase in marine phytoplankton[J]. Isme J, 2019, 13(8): 2094-2106.
Supuran C T. Emerging role of carbonic anhydrase inhibitors[J]. Clin Sci (Lond), 2021, 135(10): 1233-1249.
Smith K S, Ferry J G. Prokaryotic carbonic anhydrases[J]. FEMS Microbiol Rev, 2000, 24(4): 335-366.
Supuran C T, Capasso C. An overview of the bacterial carbonic anhydrases[J]. Metabolites, 2017, 7(4): 56.
Capasso C, Supuran C T. An overview of the alpha-, beta- and gamma-carbonic anhydrases from bacteria: Can bacterial carbonic anhydrases shed new light on evolution of bacteria[J]? J Enzyme Inhib Med Chem, 2015, 30(2): 325-332.
Hirakawa Y, Senda M, Fukuda K, et al. Characterization of a novel type of carbonic anhydrase that acts without metal cofactors[J]. BMC Biol, 2021, 19(1): 105.
Supuran C T. Structure and function of carbonic anhydrases[J]. Biochem J, 2016, 473(14): 2023-2032.
Supuran C T, Capasso C. The η-class carbonic anhydrases as drug targets for antimalarial agents[J]. Expert Opin Ther Targets, 2015, 19(4): 551-563.
Nocentini A, Supuran C T, Capasso C. An overview on the recently discovered iota-carbonic anhydrases[J]. J Enzyme Inhib Med Chem, 2021, 36(1): 1988-1995.
Ferraroni M, Del Prete S, Vullo D, et al. Crystal structure and kinetic studies of a tetrameric type II β-carbonic anhydrase from the pathogenic bacterium Vibrio cholerae[J]. Acta Crystallogr D Biol Crystallogr, 2015, 71(Pt 12): 2449-2456.
De Simone G, Monti S M, Alterio V, et al. Crystal structure of the most catalytically effective carbonic anhydrase enzyme known, SazCA from the thermophilic bacterium Sulfurihydrogenibium azorense[J]. Bioorg Med Chem Lett, 2015, 25(9): 2002-2006.
Fiore A D, Capasso C, Luca V D, et al. X-ray structure of the first extremo-α-carbonic anhydrase, a dimeric enzyme from the thermophilic bacterium Sulfurihydrogenibium yellowstonense YO3AOP1[J]. Acta Crystallogr D Biol Crystallogr, 2013, 69(Pt 6): 1150-1159.
Alterio V, Langella E, Viparelli F, et al. Structural and inhibition insights into carbonic anhydrase CDCA1 from the marine diatom Thalassiosira weissflogii[J]. Biochimie, 2012, 94(5): 1232-1241.
Del Prete S, Nocentini A, Supuran C T, et al. Bacterial ι-carbonic anhydrase: A new active class of carbonic anhydrase identified in the genome of the Gram-negative bacterium Burkholderia territorii[J]. J Enzyme Inhib Med Chem, 2020, 35(1): 1060-1068.
Huang S, Xue Y, Sauer-Eriksson E, et al. Crystal structure of carbonic anhydrase from Neisseria gonorrhoeae and its complex with the inhibitor acetazolamide[J]. J Mol Biol, 1998, 283(1): 301-310.
Chiric? L C, Elleby B, Jonsson B H, et al. The complete sequence, expression in Escherichia coli, purification and some properties of carbonic anhydrase from Neisseria gonorrhoeae[J]. Eur J Biochem, 1997, 244(3): 755-760.
Ozensoy Guler O, Capasso C, Supuran C T. A magnificent enzyme superfamily: Carbonic anhydrases, their purification and characterization[J]. J Enzyme Inhib Med Chem, 2016, 31(5): 689-694.
Capasso C, Supuran C T. Inhibition of bacterial carbonic anhydrases as a nvel approach to escape drug resistance[J]. Curr Top Med Chem, 2017, 17(11): 1237-1248.
Del Prete S, Vullo D, De Luca V, et al. Comparison of the sulfonamide inhibition profiles of the α-, β- and γ-carbonic anhydrases from the pathogenic bacterium Vibrio cholerae[J]. Bioorg Med Chem Lett, 2016, 26(8): 1941-1946.
Prete S D, Vullo D, Osman S M, et al. Sulfonamide inhibition study of the carbonic anhydrases from the bacterial pathogen Porphyromonas gingivalis: the β-class (PgiCAb) versus the γ-class (PgiCA) enzymes[J]. Bioorg Med Chem, 2014, 22(17): 4537-4543.
Supuran C T. Bacterial carbonic anhydrases as drug targets: toward novel antibiotics?[J]. Front Pharmacol, 2011, 2: 34.
Angeli A, Ferraroni M, Pinteala M, et al. Crystal structure of a tetrameric type II β-carbonic anhydrase from the pathogenic bacterium Burkholderia pseudomallei[J]. Molecules, 2020, 25(10): 2269.
Cronk J D, Oneill J W, Cronk M R, et al. Cloning, crystallization and preliminary characterization of a beta-carbonic anhydrase from Escherichia coli[J]. Acta Crystallogr D Biol Crystallogr, 2000, 56(Pt 9): 1176-1179.
Rowlett R S, Tu C, Lee J, et al. Allosteric site variants of Haemophilus influenzae beta-carbonic anhydrase[J]. Biochemistry, 2009, 48(26): 6146-6156.
Covarrubias A S, Bergfors T, Jones T A, et al. Structural mechanics of the pH-dependent activity of beta-carbonic anhydrase from Mycobacterium tuberculosis[J]. J Biol Chem, 2006, 281(8): 4993-4999.
Vullo D, Nishimori I, Minakuchi T, et al. Inhibition studies with anions and small molecules of two novel β-carbonic anhydrases from the bacterial pathogen Salmonella enterica serovar Typhimurium[J]. Bioorg Med Chem Lett, 2011, 21(12): 3591-3595.
Aspatwar A, Winum J Y, Carta F, et al. Carbonic anhydrase inhibitors as novel drugs against Mycobacterial β-carbonic anhydrases: An update on in vitro and in vivo studies[J]. Molecules, 2018, 23(11): 2911.
Shahidzadeh R, Opekun A, Shiotani A, et al. Effect of the carbonic anhydrase inhibitor, acetazolamide, on Helicobacter pylori infection in vivo: A pilot study[J]. Helicobacter, 2005, 10(2): 136-138.
Abutaleb N S, Elhassanny A E M, Flaherty D P, et al. In vitro and in vivo activities of the carbonic anhydrase inhibitor, dorzolamide, against vancomycin-resistant enterococci[J]. Peer J, 2021, 9: e11059.
Kisker C, Schindelin H, Alber B E, et al. A left-hand beta-helix revealed by the crystal structure of a carbonic anhydrase from the archaeon Methanosarcina thermophila[J]. Embo J, 1996, 15(10): 2323-2330.
Di Fiore A, De Luca V, Langella E, et al. Biochemical, structural, and computational studies of a γ-carbonic anhydrase from the pathogenic bacterium Burkholderia pseudomallei[J]. Comput Struct Biotechnol J, 2022, 20: 4185-4194.
Wang W, Zhang Y, Wang L, et al. Molecular structure of thermostable and zinc-ion-binding γ-class carbonic anhydrases[J]. Biometals, 2019, 32(2): 317-328.
Nocentini A, Capasso C, Supuran C T. Carbonic Anhydrase inhibitors as novel antibacterials in the era of antibiotic resistance: Where are we now[J]? Antibiotics (Basel), 2023, 12(1): 142.
Kusian B, Sültemeyer D, Bowien B. Carbonic anhydrase is essential for growth of Ralstonia eutropha at ambient CO(2) concentrations[J]. J Bacteriol, 2002, 184(18): 5018-5026.
Merlin C, Masters M, Mcateer S, et al. Why is carbonic anhydrase essential to Escherichia coli[J]? J Bacteriol, 2003, 185(21): 6415-6424.
Ueda K, Nishida H, Beppu T. Dispensabilities of carbonic anhydrase in proteobacteria[J]. Int J Evol Biol, 2012, 2012: 324549.
Langereis J D, Zomer A, Stunnenberg H G, et al. Nontypeable Haemophilus influenzae carbonic anhydrase is important for environmental and intracellular survival[J]. 2013, 195(12): 2737-2746.
Carta F, Maresca A, Covarrubias A S, et al. Carbonic anhydrase inhibitors. Characterization and inhibition studies of the most active beta-carbonic anhydrase from Mycobacterium tuberculosis, Rv3588c[J]. Bioorg Med Chem Lett, 2009, 19(23): 6649-6654.
Marcus E A, Moshfegh A P, Sachs G, et al. The periplasmic alpha-carbonic anhydrase activity of Helicobacter pylori is essential for acid acclimation[J]. J Bacteriol, 2005, 187(2): 729-738.
Abuaita B H, Withey J H. Bicarbonate induces Vibrio cholerae virulence gene expression by enhancing ToxT activity[J]. Infect Immun, 2009, 77(9): 4111-4120.
Joseph P, Ouahrani-Bettache S, Montero J L, et al. A new β-carbonic anhydrase from Brucella suis, its cloning, characterization, and inhibition with sulfonamides and sulfamates, leading to impaired pathogen growth[J]. Bioorg Med Chem, 2011, 19(3): 1172-1178.
Valdivia R H, Falkow S. Fluorescence-based isolation of bacterial genes expressed within host cells[J]. Science, 1997, 277(5334): 2007-2011.
Rollenhagen C, Bumann D. Salmonella enterica highly expressed genes are disease specific[J]. Infect Immun, 2006, 74(3): 1649-1660.
Lotlikar S R, Kayastha B B, Vullo D, et al. Pseudomonas aeruginosa β-carbonic anhydrase, psCA1, is required for calcium deposition and contributes to virulence[J]. Cell Calcium, 2019, 84: 102080.
Vullo D, Isik S, Del Prete S, et al. Anion inhibition studies of the α-carbonic anhydrase from the pathogenic bacterium Vibrio cholerae[J]. Bioorg Med Chem Lett, 2013, 23(6): 1636-1638.
Alterio V, Di Fiore A, Dambrosio K, et al. Multiple binding modes of inhibitors to carbonic anhydrases: How to design specific drugs targeting 15 different isoforms[J]? Chem Rev, 2012, 112(8): 4421-4468.
Capasso C, Supuran C T. Anti-infective carbonic anhydrase inhibitors: A patent and literature review[J]. Expert Opin Ther Pat, 2013, 23(6): 693-704.
Supuran C T. Advances in structure-based drug discovery of carbonic anhydrase inhibitors[J]. Expert Opin Drug Discov, 2017, 12(1): 61-88.
Abutaleb N S, Elhassanny A E M, Seleem M N. In vivo efficacy of acetazolamide in a mouse model of Neisseria gonorrhoeae infection[J]. Microb Pathog, 2022, 164: 105454.
Kaur J, Cao X, Abutaleb N S, et al. Optimization of acetazolamide-based scaffold as potent inhibitors of vancomycin-resistant Enterococcus[J]. J Med Chem, 2020, 63(17): 9540-9562.
Abutaleb N S, Elkashif A, Flaherty D P, et al. In vivo antibacterial activity of acetazolamide[J]. Antimicrob Agents Chemother, 2021, 65(4) : e01715-20.
Modak J K, Tikhomirova A, Gorrell R J, et al. Anti-Helicobacter pylori activity of ethoxzolamide[J]. J Enzyme Inhib Med Chem, 2019, 34(1): 1660-1667.
Portela M B, Barboza C M, Da Silva E M, et al. Dentine biomodification by sulphonamides pre-treatment: Bond strength, proteolytic inhibition, and antimicrobial activity[J]. J Enzyme Inhib Med Chem, 2023, 38(1): 319-329.
De Simone G, Supuran C T. (In)organic anions as carbonic anhydrase inhibitors[J]. J Inorg Biochem, 2012, 111: 117-129.
Del Prete S, Vullo D, De Luca V, et al. Anion inhibition profiles of α-, β- and γ-carbonic anhydrases from the pathogenic bacterium Vibrio cholerae[J]. Bioorg Med Chem, 2016, 24(16): 3413-3417.
Supuran C T, Capasso C. Carbonic anhydrase from Porphyromonas gingivalis as a drug target[J]. Pathogens, 2017, 6(3): 30.
Nocentini A, Hewitt C S, Mastrolorenzo M D, et al. Anion inhibition studies of the α-carbonic anhydrases from Neisseria gonorrhoeae[J]. J Enzyme Inhib Med Chem, 2021, 36(1): 1061-1066.
Lomelino C L, Supuran C T, Mckenna R. Non-classical inhibition of carbonic anhydrase[J]. Int J Mol Sci, 2016, 17(7): 1150.
Supuran C T. How many carbonic anhydrase inhibition mechanisms exist[J]? J Enzyme Inhib Med Chem, 2016, 31(3): 345-360.
Aspatwar A, Tolvanen M E, Ortutay C, et al. Carbonic anhydrase related proteins: Molecular biology and evolution[J]. Subcell Biochem, 2014, 75: 135-156.
Campestre C, De Luca V, Carradori S, et al. Carbonic anhydrases: New perspectives on protein functional role and inhibition in Helicobacter pylori[J]. Front Microbiol, 2021, 12: 629163.
Urbanski L J, Vullo D, Parkkila S, et al. An anion and small molecule inhibition study of the β-carbonic anhydrase from Staphylococcus aureus[J]. J Enzyme Inhib Med Chem, 2021, 36(1): 1088-1092.
Del Prete S, Isik S, Vullo D, et al. DNA cloning, characterization, and inhibition studies of an α-carbonic anhydrase from the pathogenic bacterium Vibrio cholerae[J]. J Med Chem, 2012, 55(23): 10742-10748.
Giovannuzzi S, Hewitt C S, Nocentini A, et al. Coumarins effectively inhibit bacterial α-carbonic anhydrases[J]. J Enzyme Inhib Med Chem, 2022, 37(1): 333-338.
De Luca V, Carginale V, Supuran C T, et al. The Gram-negative bacterium Escherichia coli as a model for testing the effect of carbonic anhydrase inhibition on bacterial growth[J]. J Enzyme Inhib Med Chem, 2022, 37(1): 2092-2098.
Del Prete S, Bua S, Supuran C T, et al. Escherichia coli γ-carbonic anhydrase: Characterisation and effects of simple aromatic/heterocyclic sulphonamide inhibitors[J]. J Enzyme Inhib Med Chem, 2020, 35(1): 1545-1554.
Del Prete S, De Luca V, Nocentini A, et al. Anion inhibition studies of the beta-carbonic anhydrase from Escherichia coli[J]. Molecules, 2020, 25(11): 2564.
Rahman M M, Tikhomirova A, Modak J K, et al. Antibacterial activity of ethoxzolamide against Helicobacter pylori strains SS1 and 26695[J]. Gut Pathog, 2020, 12: 20.
Vullo D, Sai Kumar R S, Scozzafava A, et al. Anion inhibition studies of a β-carbonic anhydrase from Clostridium perfringens[J]. Bioorg Med Chem Lett, 2013, 23(24): 6706-6710.
Vullo D, Kumar R S S, Scozzafava A, et al. Sulphonamide inhibition studies of the β-carbonic anhydrase from the bacterial pathogen Clostridium perfringens[J]. J Enzyme Inhib Med Chem, 2018, 33(1): 31-36.
K?hler S, Ouahrani-Bettache S, Winum J Y. Brucella suis carbonic anhydrases and their inhibitors: Towards alternative antibiotics[J]? J Enzyme Inhib Med Chem, 2017, 32(1): 683-687.
Aspatwar A, Kairys V, Rala S, et al. Mycobacterium tuberculosis β-Carbonic Anhydrases: Novel targets for developing antituberculosis drugs[J]. Int J Mol Sci, 2019, 20(20): 5153.
Burghout P, Vullo D, Scozzafava A, et al. Inhibition of the β-carbonic anhydrase from Streptococcus pneumoniae by inorganic anions and small molecules: Toward innovative drug design of antiinfectives[J]? Bioorg Med Chem, 2011, 19(1): 243-248.
Abutaleb N S, Elhassanny A E M, Nocentini A, et al. Repurposing FDA-approved sulphonamide carbonic anhydrase inhibitors for treatment of Neisseria gonorrhoeae[J]. J Enzyme Inhib Med Chem, 2022, 37(1): 51-61.
Hewitt C S, Abutaleb N S, Elhassanny A E M, et al. Structure-activity relationship studies of acetazolamide-based carbonic anhydrase inhibitors with activity against Neisseria gonorrhoeae[J]. ACS Infect Dis, 2021, 7(7): 1969-1984.
Rubin D H F, Ma K C, Westervelt K A, et al. CanB is a metabolic mediator of antibiotic resistance in Neisseria gonorrhoeae[J]. Nat Microbiol, 2023, 8(1): 28-39.
Supuran C T. Legionella pneumophila carbonic anhydrases: underexplored antibacterial drug targets[J]. Pathogens, 2016, 5(2): 44.
Nishimori I, Vullo D, Minakuchi T, et al. Anion inhibition studies of two new β-carbonic anhydrases from the bacterial pathogen Legionella pneumophila[J]. Bioorg Med Chem Lett, 2014, 24(4): 1127-1132.
Nishimori I, Minakuchi T, Vullo D, et al. Inhibition studies of the β-carbonic anhydrases from the bacterial pathogen Salmonella enterica serovar Typhimurium with sulfonamides and sulfamates[J]. Bioorg Med Chem, 2011, 19(16): 5023-5030.
Dedeoglu N, De Luca V, Isik S, et al. Cloning, characterization and anion inhibition study of a β-class carbonic anhydrase from the caries producing pathogen Streptococcus mutans[J]. Bioorg Med Chem, 2015, 23(13): 2995-3001.
An W, Holly K J, Nocentini A, et al. Structure-activity relationship studies for inhibitors for vancomycin-resistant Enterococcus and human carbonic anhydrases[J]. J Enzyme Inhib Med Chem, 2022, 37(1): 1838-1844.
Kaur J, Cao X, Abutaleb N S, et al. Optimization of acetazolamide-based scaffold as potent inhibitors of vancomycin-resistant Enterococcus[J]. J Med Chem, 2020, 63(17): 9540-9562.
Urbanski L J, Bua S, Angeli A, et al. Sulphonamide inhibition profile of Staphylococcus aureus β-carbonic anhydrase[J]. J Enzyme Inhib Med Chem, 2020, 35(1): 1834-1839.
Del Prete S, Vullo D, Di Fonzo P, et al. Comparison of the anion inhibition profiles of the β- and γ-carbonic anhydrases from the pathogenic bacterium Burkholderia pseudomallei[J]. Bioorg Med Chem, 2017, 25(6): 2010-2015.
Akgul O, Angeli A, Selleri S, et al. Taurultams incorporating arylsulfonamide: First in vitro inhibition studies of α-, β- and γ-class carbonic anhydrases from Vibrio cholerae and Burkholderia pseudomallei[J]. Eur J Med Chem, 2021, 219: 113444.
Del Prete S, Vullo D, Osman S M, et al. Sulfonamide inhibition profiles of the β-carbonic anhydrase from the pathogenic bacterium Francisella tularensis responsible of the febrile illness tularemia[J]. Bioorg Med Chem, 2017, 25(13): 3555-3561.
Del Prete S, Vullo D, Osman S M, et al. Anion inhibitors of the β-carbonic anhydrase from the pathogenic bacterium responsible of tularemia, Francisella tularensis[J]. Bioorg Med Chem, 2017, 25(17): 4800-4804.
Ritschel W A, Paulos C, Arancibia A, et al. Pharmacokinetics of acetazolamide in healthy volunteers after short- and long-term exposure to high altitude[J]. J Clin Pharmacol, 1998, 38(6): 533-539.
Ten Hove M W, Friedman D I, Patel A D, et al. Safety and tolerability of acetazolamide in the idiopathic intracranial hypertension treatment Trial[J]. J Neuroophthalmol, 2016, 36(1): 13-19.
Swenson E R. Safety of carbonic anhydrase inhibitors[J]. Expert Opin Drug Saf, 2014, 13(4): 459-472.
Aspatwar A, Hammaren M, Parikka M, et al. In vitro inhibition of Mycobacterium tuberculosis β-carbonic anhydrase 3 with mono- and dithiocarbamates and evaluation of their toxicity using zebrafish developing embryos[J]. J Enzyme Inhib Med Chem, 2020, 35(1): 65-71.

