异位垂体后叶的成因、影像特征及临床意义
顾芳 罗义琳 张国平
[摘要] 异位垂体后叶(EPP)是鞍区的一个重要影像学征象,可出现在多种先天性和后天性鞍区病变中。在T1WI上,EPP表现为正中隆起或沿垂体柄区域分布的高信号结节。对EPP的形成机制进行分析,包括遗传因素和后天性因素的影响,探讨EPP的相关疾病、影像学特征及其临床意义;分析EPP研究中存在的不足和未来研究的可能方向。
[关键词] 异位垂体后叶;磁共振成像;抗利尿激素;垂体柄;中枢性尿崩症
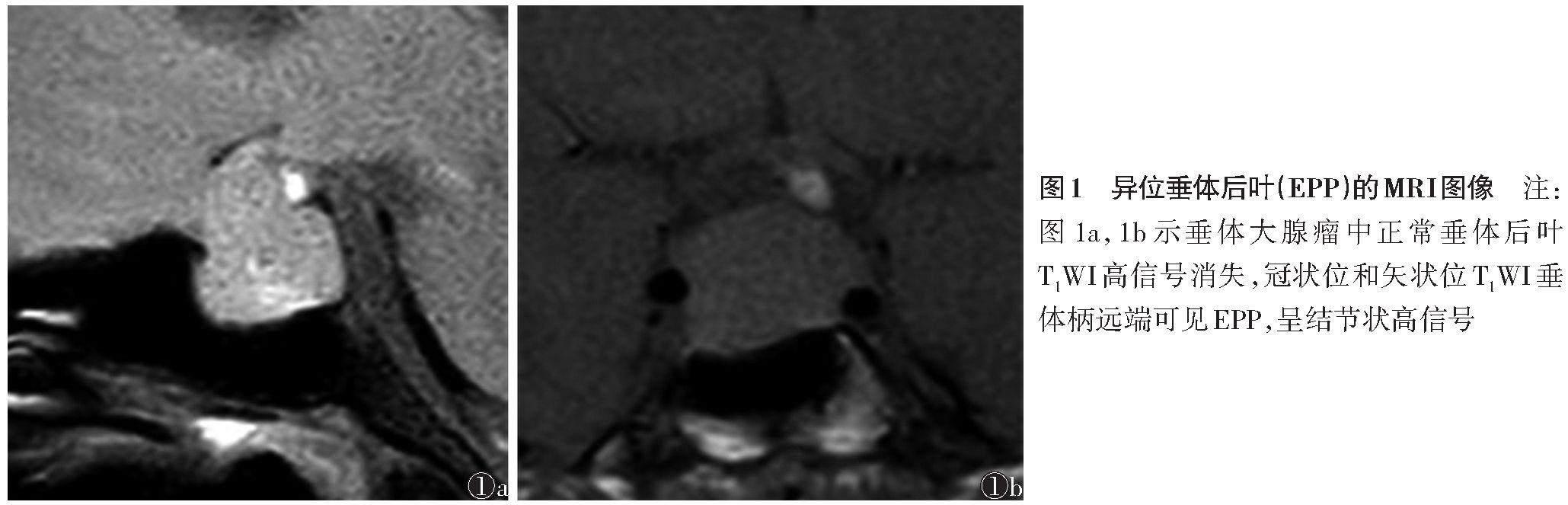
异位垂体后叶(ectopic posterior pituitary lobe,EPP)是指在正常位置(垂体窝内)未显示垂体后叶,而T1WI示垂体后叶(高信号小结节)位于鞍上。EPP被视为下丘脑-垂体区域的重要影像学特征,对诊断和理解某些垂体和下丘脑疾病具有重要意义。EPP可出现在多种先天性和后天性鞍区病变中,在头颅MRI T1WI上可检测到EPP,表现为正中隆起或沿垂体柄区域分布的高信号结节,伴或不伴鞍内正常的垂体后叶高信号[1-3](图1)。EPP的影像学特征和临床意义已有一定研究,但其具体的形成机制仍需深入探讨。本研究旨在探讨与EPP相关的疾病类型,分析其形成机制,包括先天性和后天性因素的影响,总结EPP的影像学特征,并探讨EPP在临床中的应用,以及研究中存在的不足和未来的研究方向。
1 EPP的相关疾病
EPP的出现与多种鞍区病变相关,包括先天性病变和后天性病变。EPP在先天性疾病,如孤立性生长激素缺乏和多种激素缺乏的垂体柄阻断综合征(pituitary stalk interruption syndrome,PSIS)中被广泛描述,常伴垂体柄缺如或变细、腺垂体发育不良[4]。根据垂体柄是否中断或缺失,PSIS被分为部分型和完全型,EPP在完全型PSIS中更多见[5]。此外,卡尔曼综合征、小头畸形、Chiari Ⅰ型畸形、视交叉发育不良、全前脑畸形、脑室旁结节状灰质异位等多种畸形与EPP相关[6-10]。
目前,临床对EPP相关的后天性病变关注较少,研究主要集中于垂体大腺瘤患者中。研究表明,垂体大腺瘤发生率与其体积呈正相关,高度≥20 mm即可形成EPP;高度<20 mm的垂体瘤,如突然發生瘤内出血压迫垂体柄,也可形成EPP[11-13]。创伤后垂体柄截断综合征(post-traumatic pituitary stalk transection syndrome,PSTS)是儿童EPP形成的另一个罕见原因,PSTS与PSIS具有相似的影像学特征,但PSTS不伴其他的中线缺陷,PSTS中EPP的形成被认为与胎儿在臀位分娩过程中垂体柄的损伤有关[14-16]。EPP还可出现在严重的头部外伤、垂体术后及蛇毒毒素损伤的患者中[17-19],但较罕见。
2 EPP的影像学特征
EPP通常位于鞍外垂体柄或正中隆起处[20],而正常垂体后叶位于鞍内后部,在垂体大腺瘤中,EPP主要出现在垂体柄的远端、鞍隔压痕的上方[1];而在PSIS及PSTS患者中,EPP更倾向于出现在正中隆起区,且常伴随垂体柄缺失和腺垂体发育不良[14]。正常垂体后叶在T1WI上表现为蝶鞍内后部结节状高信号,代表该区域含有抗利尿激素的神经分泌颗粒[21-22]。与正常垂体后叶类似,在T1WI上,EPP呈结节状或弧形的高信号。由于垂体后叶和垂体柄分别由垂体下动脉和垂体上动脉供血,垂体前叶则主要通过垂体门脉系统间接接受来自垂体上动脉的血供。因此,在行垂体MRI动态增强扫描时,正常垂体后叶和垂体柄通常比垂体前叶更早强化[23]。Takahashi等[12]利用MRI动态增强扫描研究发现,垂体大腺瘤中EPP与正常垂体后叶具有相似的动态强化特征。此外,EPP非常稳定,部分垂体大腺瘤患者即使手术解除垂体柄周围结构的压力,EPP在术后仍在垂体柄显示,术后随访数年其位置相对于垂体柄不会发生变化,且鞍内正常垂体后叶高信号也未重新出现[24],这表明EPP非短暂或偶然现象。在极罕见情况下,部分EPP可在鞍内及中央隆起或沿漏斗柄区域同时观测到2个T1WI亮点,这在少数垂体大腺瘤患者及先天发育异常的患者中也有文献报道,在部分先天性EPP中,其被认为可能与其他中线缺陷和垂体前叶激素缺乏有关[2,13,25]。
3 EPP的临床意义
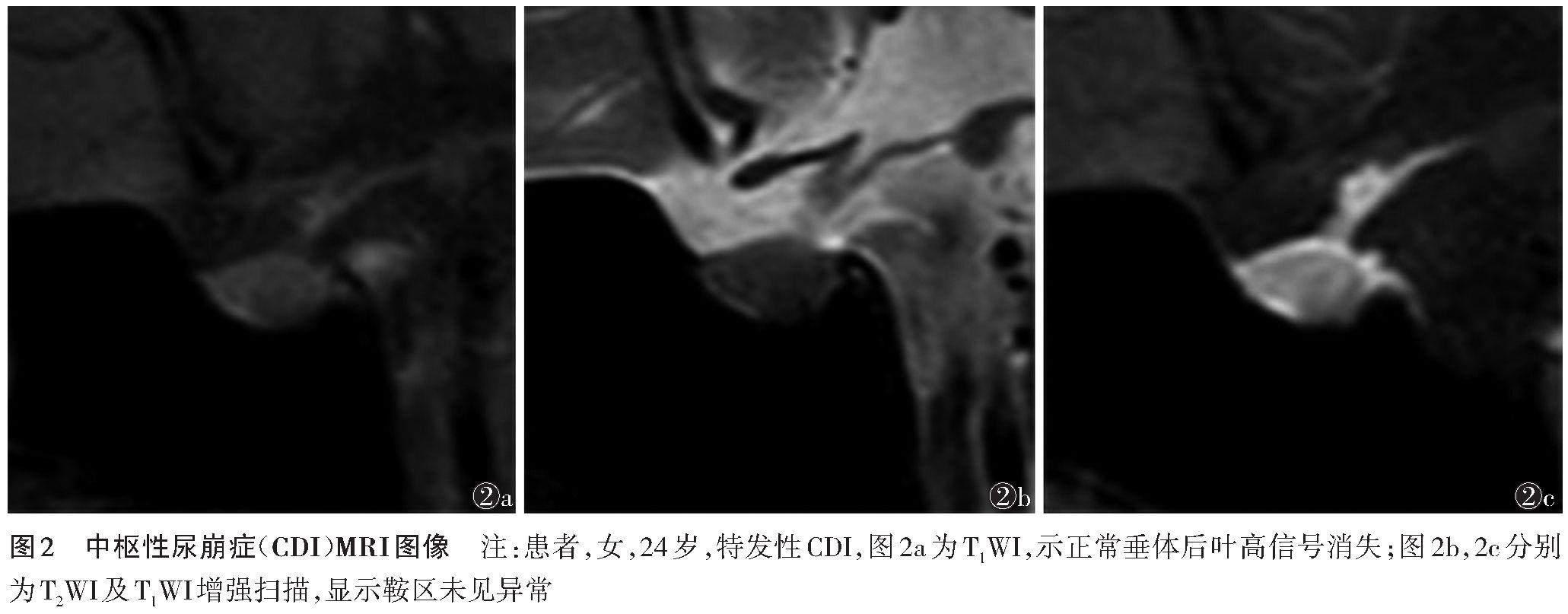
下丘脑-神经垂体轴是神经内分泌系统的重要枢纽。位于下丘脑的视上核和室旁核的神经元合成抗利尿激素(ADH)和催产素,其轴突从下丘脑的神经元延伸至垂体后叶构成下丘脑-神经垂体束,并将ADH和催产素经轴突运输至垂体后叶储存,在身体需要时释放至血液中[26-27]。当下丘脑神经元或下丘脑-神经垂体束损伤,导致ADH合成或分泌不足时,则会导致中枢性尿崩症(central diabetes insipidus,CDI)的发生,临床表现为多饮和多尿。MRI在CDI的诊断中具有重要作用,当垂体后叶T1WI高信号存在时,代表下丘脑-神经垂体轴功能完整,而CDI患者垂体后叶T1WI高信号消失(图2)[28]。
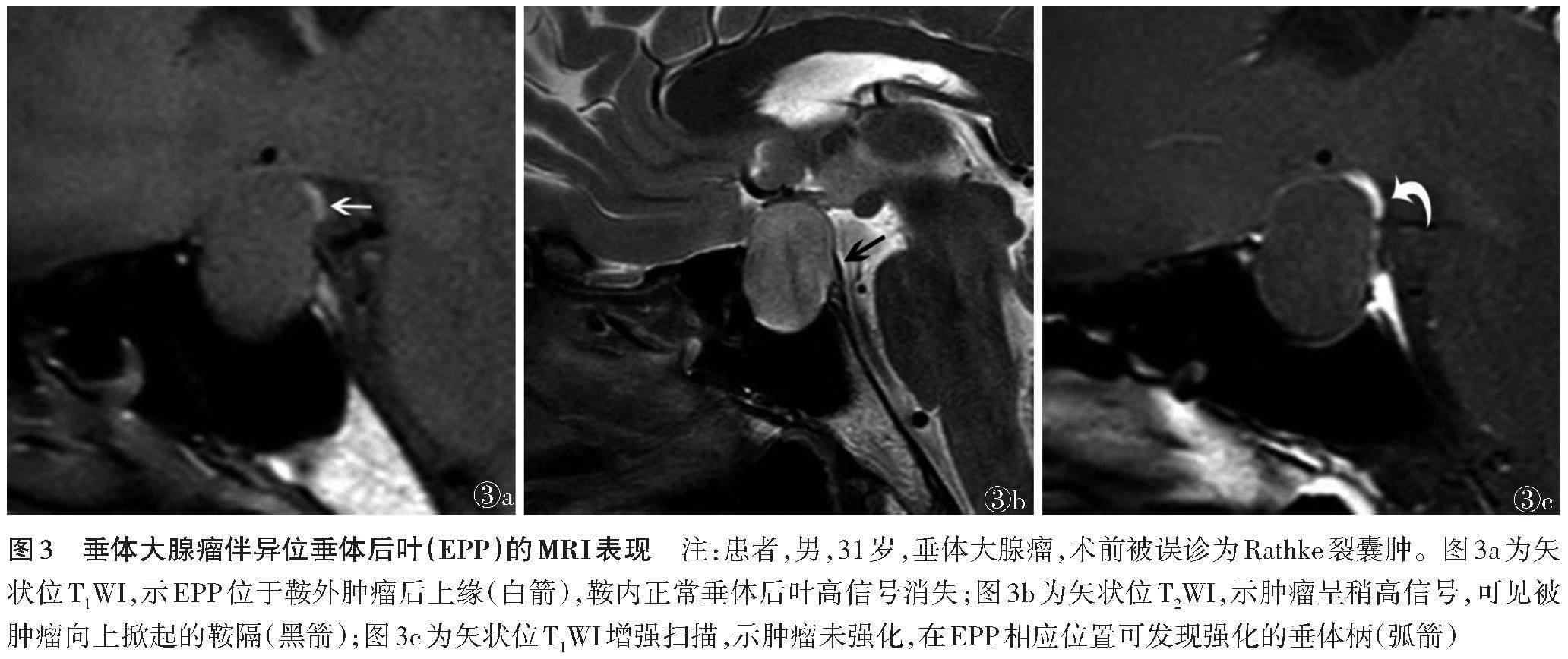
无论先天性病变还是后天性病变,即使正常垂体后叶缺失,只要患者存在EPP,就不会发生永久性CDI;反之,当EPP与正常垂体后叶T1WI高信号同时缺失时,患者更有可能发生永久性CDI[14,24,29]。动物实验也证实,垂体柄损伤后,伴随EPP的形成,术后受试动物CDI症状逐步消失[30]。然而,神经垂体T1WI高信号的缺失并不一定表示病理状态,在一些非CDI人群中,神经垂体T1WI高信号也可消失,其可能与受到垂体大腺瘤内不均质信号的干扰、肿瘤的遮蔽、血浆渗透压增高、ADH浓度的降低、孕期、血液透析或糖尿病未得到良好控制、严重的神经厌食及应激状态的影响等有关[13,11,31]。虽然EPP的存在表明神经垂体功能完整,但在某些患者垂体术后早期且EPP可见的情况下,也有可能发生短暂CDI,这可能是由于手术损伤垂体柄远端EPP的血管,继而导致ADH的释放或分泌机制出现短暂障碍[29]。EPP在鞍区肿瘤或肿瘤样病变的术前影像诊断中具有重要作用。之前研究发现,EPP是垂体大腺瘤的特征性影像学表现,在鉴别垂体大腺瘤和其他鞍区肿瘤或肿瘤样病变中具有很高的价值[1](图3)。
4 EPP的形成機制
4.1 先天性EPP的形成机制
某些先天性EPP可能由胚胎发生过程中的神经元迁移受阻导致,通常与转录因子基因突变相关,涉及垂体腺和其他中线前脑结构的发育路径。有研究发现,PITI、PROPI、HES X1、LHX3、LHX4、SOX3与EPP有关,这些基因通常与下丘脑-垂体轴的发育相关[6,32]。在PSIS中,约5%的患者存在已知基因(如TGIF、SHH、CDON、GPR161、PROKR2、GLI2、LHX4、OTX2、SOX3)的突变,这些突变引起早期胎儿中线结构发育异常,导致垂体柄和腺垂体发育不良或缺失,以及神经垂体未完全下降至蝶鞍,继而形成EPP[14]。
4.2 后天性EPP形成机制的假说
Saeki等[13]发现垂体大腺瘤的形态与EPP的形成相关。EPP在有压痕的垂体大腺瘤中发生率更高,因此推测EPP的形成主要是由于下丘脑-神经垂体轴受压,导致抗利尿激素在垂体柄的近端发生堵塞积累所致。然而,即使在垂体大腺瘤术后,解除了肿瘤对垂体柄的压迫,EPP相对于垂体柄的位置并未发生改变,且鞍内正常垂体后叶T1WI高信号也未重新出现,说明EPP的发生和形成不是暂时性改变。此外,EPP在动态增强扫描后还可强化,说明其具有良好的血液供应。另外,出现EPP的患者均无永久性CDI发生,提示EPP可正常分泌垂体后叶激素。
4.3 垂体柄损伤与EPP的形成的实验性证据
在神经内分泌学发展的时代,进行了各种实验来研究下丘脑垂体系统,包括对实验动物和垂体手术的患者行垂体柄离断和垂体切除术。有研究发现,在垂体柄切断一段时间后,离断的近端垂体柄残端会增大、重构,形成一个异位的类垂体后叶组织,该组织神经支配良好,高度血管化,并含大量的神经内分泌物质,不仅能提供基础的垂体后叶激素,还能在机体需要时增加激素分泌[33-37]。Dellmann[38]对此进行了概述:①垂体柄的远端残端及垂体后叶发生了显著的退行性变化,包括神经轴突解体,神经内分泌物质逐渐耗尽,神经胶质细胞增生。②离断垂体柄近端的变化则较独特。一部分神经轴突退化并迅速消失,另一部分则似乎未受损伤,并显示出再生迹象。这种再生表现为轴突内神经内分泌物质含量的增高,轴突末梢体积的增加,并与周围血管间隙形成紧密连接,这些膨胀的轴突最终重构形成一种新的类垂体后叶组织。③视上核和视旁核中大量神经元凋亡,且凋亡数量与垂体柄离断的位置相关,即离断位置越接近下丘脑,细胞凋亡数量越多。此外,垂体柄离断的部位对EPP的发育有重要影响:当离断位置靠近垂体时,EPP良好发育;相反,当离断位置靠近下丘脑时,EPP的发育相对较差[39]。虽然动物模型揭示了垂体柄损伤后EPP组织的详细再生过程,但这些研究并未系统地将EPP的影像学特征与病理改变联系起来。最近的一项研究利用大鼠垂体柄损伤模型,并结合病理学和影像学技术,对损伤后的垂体柄残端进行深入观察,发现垂体柄损伤后的残端会膨大形成类垂体后叶组织,且T1WI呈高信号,明确了EPP在T1WI上呈高信号的现象与其病理学改变之间的相关性[40]。
5 不足与展望
目前,虽然已知先天性病变中EPP的形成与某些基因变异有关,但这些基因变异是如何具体导致EPP的形成尚未完全阐明。未来研究需进一步探索基因变异与EPP形成之间的确切关系。这可能需对EPP患者进行更深入的基因分析,以及在动物模型中进行基因操纵实验,以更好地理解这些基因如何影响垂体和下丘脑的发育。虽然目前很多证据支持后天性因素导致的EPP可能与垂体柄损伤后神经纤维的再生有关。但这一发现与中枢神经系统的一般原则矛盾,即中枢神经纤维轴突受损后的再生能力通常有限[41]。因此,未来仍需进一步对受损垂体柄的病理学和分子生物学进行研究,以及对受伤后神经元和轴突残端的存活和恢复机制进行研究。
[参考文献]
[1] LUO Y L,GU F,FAN H Q,et al. Diagnostic value of magnetic resonance imaging ectopic posterior pituitary hyperintense signal in pituitary macroadenoma[J]. Front Oncol,2022,12:971730.
[2] ALHATMI A,RANIGA S,AL SHIDHANI A,et al. Partial ectopic posterior pituitary:a rare imaging entity with literature review[J]. Neuroradiol J,2023:19714009231212369.
[3] YEHOUENOU TESSI R T,ADEYEMI B,EL MSAADI S,et al. Pituitary stalk interruption syndrome on MRI:case report[J]. Clin Case Rep,2023,11(9):7899.
[4] SRIDHAR S,RAJA B R,PRIYANKA R,et al. Clinico-radiological correlation of pituitary stalk interruption syndrome in children with growth hormone deficiency[J]. Pituitary,2023,26(5):622-628.
[5] WANG Q,HU Y,LI G,et al. Pituitary stalk interruption syndrome in 59 children:the value of MRI in assessment of pituitary functions[J]. Eur J Pediatr,2014,173(5):589-595.
[6] LAHIRI A K,SUNDAREYAN R,JENKINS D,et al. MRI of ectopic posterior pituitary gland with dysgenesis of pituitary stalk in a patient with hypogonadotropic hypogonadism[J]. Radiol Case Rep,2018,13(4):764-766.
[7] AKYEL N G,ALIMLI A G,DEMIRKAN T H,et al. Persistent craniopharyngeal canal,bilateral microphthalmia with colobomatous cysts,ectopic adenohypophysis with Rathke cleft cyst,and ectopic neurohypophysis:case report and review of the literature[J]. Childs Nerv Syst,2018,34(7):1407-1410.
[8] TAJIMA T,HATTORI T,NAKAJIMA T,et al. A novel missense mutation (P366T) of the LHX4 gene causes severe combined pituitary hormone deficiency with pituitary hypoplasia,ectopic posterior lobe and a poorly developed sella turcica[J]. Endocr J,2007,54(4):637-641.
[9] BERGSON J C,GARG V K,CHANG J. Ectopic posterior pituitary lobe and cortical dysplasia[J]. AJNR Am J Neuroradiol,2007,28(2):198-199.
[10] MITCHELL L A,THOMAS P Q,ZACHARIN M R,et al. Ectopic posterior pituitary lobe and periventricular heterotopia:cerebral malformations with the same underlying mechanism[J]. AJNR Am J Neuroradiol,2002,23(9):1475-1481.
[11] BONNEVILLE J F. The ectopic posterior lobe[M]//BONNEVILLE F. MRI of the pituitary gland. Cham:Springer International Publishing,2016:347-354.
[12] TAKAHASHI T,MIKI Y,TAKAHASHI J A,et al. Ectopic posterior pituitary high signal in preoperative and postoperative macroadenomas:dynamic MR imaging[J]. Eur J Radiol,2005,55(1):84-91.
[13] SAEKI N,HAYASAKA M,MURAI H,et al. Posterior pituitary bright spot in large adenomas:MR assessment of its disappearance or relocation along the stalk[J]. Radiology,2003,226(2):359-365.
[14] RUSZA?A A,W?JCIK M,KRYSTYNOWICZ A,et al. Distinguishing between post-trauma pituitary stalk disruption and genetic pituitary stalk interruption syndrome-case presentation and literature overview[J]. Pediatr Endocrinol Diabetes Metab,2019,25(3):155-162.
[15] KIKUCHI K,FUJISAWA I,MOMOI T,et al. Hypothalamic-pituitary function in growth hormone-deficient patients with pituitary stalk transection[J]. J Clin Endocrinol Metab,1988,67(4):817-823.
[16] FUKUTA K,HIDAKA T,ONO Y,et al. Case of pituitary stalk transection syndrome ascertained after breech delivery[J]. J Obstet Gynaecol Res,2016,42(2):202-205.
[17] SU D H,CHANG Y C,CHANG C C. Post-traumatic anterior and posterior pituitary dysfunction[J]. J Formos Med Assoc,2005,104(7):463-467.
[18] DAS L,BHANSALI A,AHUJA C K,et al. Acquired ectopic posterior pituitary bright spot due to vasculotoxic snakebite[J]. AACE Clinical Case Rep,2020,6(5):207-211.
[19] DANIEL P M,PRICHARD M M. The human hypothalamus and pituitary stalk after hypophysectomy or pituitary stalk section[J]. Brain,1972,95(4):813-824.
[20] WANG S,LIN K,XIAO D,et al. MR imaging analysis of posterior pituitary in patients with pituitary adenoma[J]. Int J Clin Exp Med,2015,8(5):7634-7640.
[21] GOBARU M,SAKAI K,SUGIYAMA Y,et al. Transient antidiuretic hormone insufficiency caused by severe hyperosmolar hyperglycemic syndrome based on nephrogenic diabetes insipidus[J]. AACE Clin Case Rep,2021,7(6):372-375.
[22] MEIRA A S,LYRA A,KOCHI C,et al. Adding T2-weighted images to FAST1 protocol to evaluate the anatomy of the hypothalamic-pituitary region[J]. Horm Res Paediatr,2022,95(3):244-254.
[23] LEE H B,KIM S T,KIM H J,et al. Usefulness of the dynamic gadolinium-enhanced magnetic resonance imaging with simultaneous acquisition of coronal and sagittal planes for detection of pituitary microadenomas[J]. Eur Radiol,2012,22(3):514-518.
[24] SAEKI N,HOSHI S,SUNADA S,et al. Correlation of high signal intensity of the pituitary stalk in macroadenoma and postoperative diabetes insipidus[J]. AJNR,Am J Neuroradiol,2002,23(5):822-827.
[25] YBARRA M,HAFIZ R,ROBINSON M E,et al. A new imaging entity consistent with partial ectopic posterior pituitary gland:report of six cases[J]. Pediatr Radiol,2020,50(1):107-115.
[26] APPLEBY I,JOHN R,HIRSCH N. Pituitary disease and anaesthesia[J]. Anaesth Intens Care Med,2020,21(6):312-316.
[27] CAMPBELL I. Hypothalamic and pituitary function[J]. Anaesth Intens Care Med,2016,17(12):652-654.
[28] TOMKINS M,LAWLESS S,MARTIN-GRACE J,et al. Diagnosis and management of central diabetes insipidus in adults[J]. J Clin Endocrinol Metab,2022,107(10):2701-2715.
[29] SAEKI N,TOKUNAGA H,WAGAI N,et al. MRI of ectopic posterior pituitary bright spot with large adenomas:appearances and relationship to transient postoperative diabetes insipidus[J]. Neuroradiology,2003,45(10):713-716.
[30] FENG Z,OU Y,ZHOU M,et al. Functional ectopic neural lobe increases GAP-43 expression via PI3K/AKT pathways to alleviate central diabetes insipidus after pituitary stalk lesion in rats[J]. Neurosci Lett,2018,673:1-6.
[31] WANG S,LIN K,XIAO D,et al. The relationship between posterior pituitary bright spot on Magnetic Resonance Imaging (MRI) and postoperative diabetes insipidus for pituitary adenoma patients[J]. Med Sci Monit,2018,24:6579-6586.
[32] SAYLISOY S,YORULMAZ G. Coexistence of ectopic posterior pituitary and sellar/suprasellar arachnoid cyst:a case report[J]. Curr Med Imaging,2020,16(8):1055-1057.
[33] BILLENSTIEN D C,LEVEQUE T F. The reorganization of the neurohypophyseal stalk following hypophysectomy in the rat[J]. Endocrinology,1955,56(6):704-717.
[34] ANTUNES J L,LOUIS K M,HUANG S,et al. Section of the pituitary stalk in the rhesus monkey:morphological and endocrine observations[J]. Ann Neurol,1980,8(3):308-316.
[35] ADAMS J H,DANIEL P M,PRICHARD M M. Degeneration and regeneration of hypothalamic nerve fibers in the neurohypophysis after pituitary stalk section in the ferret[J]. J Comp Neurol,1969,135(2):121-144.
[36] BECK E,DANIEL P M,PRICHARD M M. Regeneration of hypothalamic nerve fibres in the goat[J]. Neuroendocrinology,1969,5(3):161-182.
[37] ADAMS J H,DANIEL P M,PRICHARD M M. Changes in the hypothalamus associated with regeneration of the hypothalamo-neurohypophysial tract after pituitary stalk section in the ferret[J]. J Comp Neurol,1971,142(1):109-123.
[38] DELLMANN H D. Degeneration and regeneration of neurosecretory systems[J]. Int Rev Cytol,1973,36:215-315.
[39] FUJISAWA I. Magnetic resonance imaging of the hypothalamic-neurohypophyseal system[J]. J Neuroendocrinology,2004,16(4):297-302.
[40] 歐毅超. 垂体柄末端功能性膨大在大鼠垂体柄损伤后中枢性尿崩症的作用研究[D]. 广州:南方医科大学,2018.
[41] JACOBI A,TRAN N M,YAN W,et al. Overlapping transcriptional programs promote survival and axonal regeneration of injured retinal ganglion cells[J]. Neuron,2022,110(16):2625-2645.e7.

