原发性失眠相关情绪障碍的低频振幅静息态fMRI研究
王忠艳 霍健伟 付清楠 陈鹏
[摘要] 目的:探討原发性失眠相关情绪障碍患者的脑内神经活动异常改变。方法:纳入18~60岁原发性失眠相关情绪障碍患者(失眠组)和正常受试者(对照组)各20例,对比2组低频振幅(ALFF)差异,并分析ALFF值与临床评估量表的相关性。结果:2组匹兹堡睡眠质量指数(PSQI)、焦虑自评量表(SAS)评分、抑郁自评量表(SDS)评分差异均有统计学意义(均P<0.05)。与对照组相比,失眠组ALFF值升高的脑区有左侧颞下回、右侧眶额皮质、右侧前扣带回、右侧颞中回、双侧额上回、右侧枕上回、左侧中央后回,ALFF值降低的脑区有左侧中扣带回、左侧额中回、右侧额上回(AlphaSim校正,P<0.01)。SDS评分与右侧眶额皮质的ALFF值呈正相关(r=0.528,P=0.024),SDS、SAS评分与左侧中扣带回ALFF值均呈正相关(r=0.641,0.494;均P<0.05)。结论:通过ALFF可发现原发性失眠相关情绪障碍患者的脑内异常神经活动,主要是情感、认知相关网络脑区(扣带回、眶额皮质等)存在脑自发活动异常,且部分脑区的自发活动与临床指标存在相关性。异常脑活动改变可能是原发性失眠相关情绪障碍患者的有效神经影像标志物,可为远期疾病严重性评估及疾病治疗提供影像学依据。
[关键词] 原发性失眠;磁共振成像;低频振幅
A resting-state fMRI study of alterations in amplitude of low-frequency fluctuation in primary insomnia patients with emotional disorders
[Abstract] Objective:To investigate the changes of brain nerve activity in primary insomnia patients with emotional disorders. Methods:Twenty primary insomnia patients (the insomnia group) and 20 healthy subjects (the control group) were recruited and subjected to resting-state fMRI. The amplitude of low-frequency fluctuation (ALFF) values were compared between the two groups and the correlations between ALFF values and the evaluation scales were analyzed. Results:The Pittsburgh sleep quality index (PSQI),self-rating anxiety scale (SAS),and self-rating depression scale (SDS) scores in the insomnia group were significantly different from those in the control group (all P<0.05). Compared with the control group,the primary insomnia group showed increased ALFF values in the left inferior temporal gyrus,right orbitofrontal cortex,right anterior cingulate,right middle temporal gyrus,bilateral superior frontal gyrus,right superior occipital gyrus and left posterior central gyrus,and decreased ALFF values in the left middle cingulate,left middle frontal gyrus and right superior frontal gyrus (P<0.01,AlphaSim corrected). Furthermore,the SDS scores were positive correled with ALFF values in the right orbitofrontal cortex and left cingulate gyrus (r=0.528,0.641,both P<0.05),and the SAS score had a positive correlation with ALFF value in the left cingulate gyrus (r=0.494,P=0.037). Conclusions:The changes of brain nerve activity in primary insomnia patients with emotional disorders can be analyzed by ALFF,mainly the abnormal spontaneous brain activity in the brain regions related to emotion-cognition (cingulate gyrus,orbitofertal cortex,etc.),and the spontaneous brain activity in some brain regions is correlated with clinical indicators. Abnormal spontaneous activity could be an efficient neuroimaging biomarker for primary insomnia and could establish a foundation for the assessment of disease severity and treatment recommendations.
[Key words] Primary insomnia;Magnetic resonance imaging;Amplitude of low-frequency fluctuation
原发性失眠是最常见的睡眠障碍之一,表现为入睡及维持睡眠困难,可伴随不同程度的日间功能障碍,如情绪波动、认知缺失及记忆下降等。失眠的患病率为10%~15%,发病率为5%,女性明显多于男性,且患病率随年龄增加而增加;失眠是神经系统紊乱疾病(认知功能损伤)、神经退行性疾病(阿尔茨海默病)、精神疾病(抑郁和/或自杀)的重要危险因素[1-3]。失眠的神经病理学机制尚不明确,既往认为过度觉醒机制及情感认知障碍是失眠的重要机制之一。有学者认为,失眠可能是一种夜间情绪记忆调节障碍,失眠患者在夜间睡眠过程中不能消除负面情绪,如恐惧、焦虑、压力、紧张或悲伤的干扰,这种不良体验可能在大脑功能激活的过程中存在数十年,易合并抑郁和焦虑情绪障碍[4]。但失眠与抑郁、焦虑情绪之间的神经机制需进一步研究,临床上常用的评估焦虑、抑郁情绪量表相对主观。静息态fMRI是神经功能影像学技术的一种,能发现疾病发病机制的脑内活动改变。有研究认为,睡眠障碍存在脑实质结构与功能改变,丘脑和海马、眶额回、额上回存在灰质密度和体积的减少,丘脑、杏仁核、前运动皮质和感觉运动皮质、前扣带回和前额中回及岛叶存在异常的功能连接[4]。可通过低频振幅(amplitude of low-frequency fluctuation,ALFF)观察脑部功能活动信号相对基线变化的幅度提示脑部神经元的自发活动。本研究在静息状态下采用ALFF研究原发性失眠患者相关情绪障碍脑部自发神经活动变化及其与临床指标的相关性,探索原发性失眠相关情绪障碍的神经病理学机制及有效的神经影像标志物,为疾病的评估及治疗提供依据。
1 资料与方法
1.1 一般资料
选取2016年6—12月原发性失眠相关情绪障碍患者20例(失眠组),男5例,女15例;年龄26~64岁,平均(49.10±11.37)岁。另招募20例年龄、性别、受教育年限匹配的健康受试者(对照组),男5例,女15例,年龄26~64岁,平均(50.00±11.44)岁。
失眠组纳入标准:①符合第4版《精神障碍诊断和统计手册》[5]的诊断标准;②匹兹堡睡眠质量指数(Pittsburgh sleep quality index,PSQI)评分
对照组纳入标准:①无精神、神经类疾病;②良好的睡眠状态,PSQI评分<5分;③3个月内未服用兴奋性药物。排除标准同失眠组的②③④。本研究经医院伦理委员会批准(2014BL-003-01),所有受试者均签署知情同意書。
1.2 睡眠状态及临床量表评估
2组均在MRI检查前行PSQI、焦虑自评量表(self-
rating anxiety scale,SAS)、抑郁自评量表(self-rating depression scale,SDS)评估。PSQI评分内容包括过去1个月的睡眠质量、睡眠潜伏期、睡眠时间、睡眠效率、睡眠障碍、安眠药的使用及白天的功能障碍,总分
1.3 仪器与方法
采用Siemens Magnetom Skyra 3.0 T MRI扫描仪。受试者取仰卧位,闭眼,使用泡沫垫控制头部运动。扫描序列与参数:静息态fMRI扫描方位平行于前颅底和前后联合,采用EPI序列,TR 3 000 ms,TE 30 ms,视野220 mm×220 mm,翻转角90°,层厚3.0 mm,层数40,体素大小2.3 mm×2.3 mm×3.0 mm,隔行扫描;T1WI三维磁化强度预备梯度回波序列,176幅图像,TR 2 300 ms,TE 2.32 ms,矩阵256×256,视野240 mm×240 mm,翻转角8°;采集常规T2WI图像,以排除其他病变。
1.4 统计学分析
应用SPSS 20.0统计软件分析数据,采用Kolmogorov-Smirnov(K-S)检验对计量资料行正态性分布检验,符合正态分布的计量资料以[x]±s表示,组间比较行独立样本t检验;非正态分布的计量资料以M(QL,QU)表示,组间比较行非参数秩和检验。
使用REST软件分别提取所有数据重要区域体素的平均ALFF值,2组ALFF值比较行双样本t检验,经AlphaSim校正(P<0.01为差异统计学意义)。PSQI、SAS、SDS与异常脑区平均ALFF值行Spearman相关分析,以P<0.05为差异有统计学意义。
2 结果
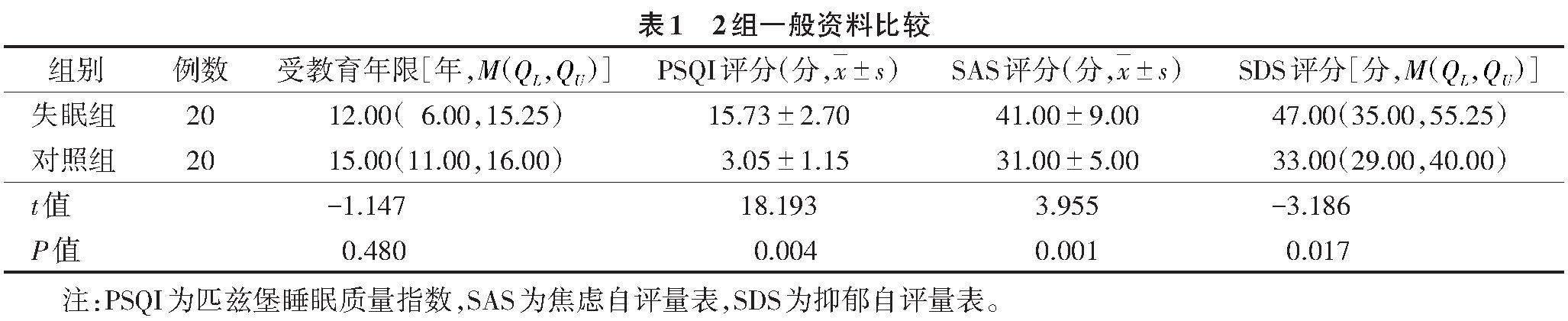
2.1 2组一般资料比较(表1)
2组年龄、性别、受教育程度差异均无统计学意义(均P>0.05),而PSQI、SAS、SDS评分差异均有统计学意义(均P<0.05)。
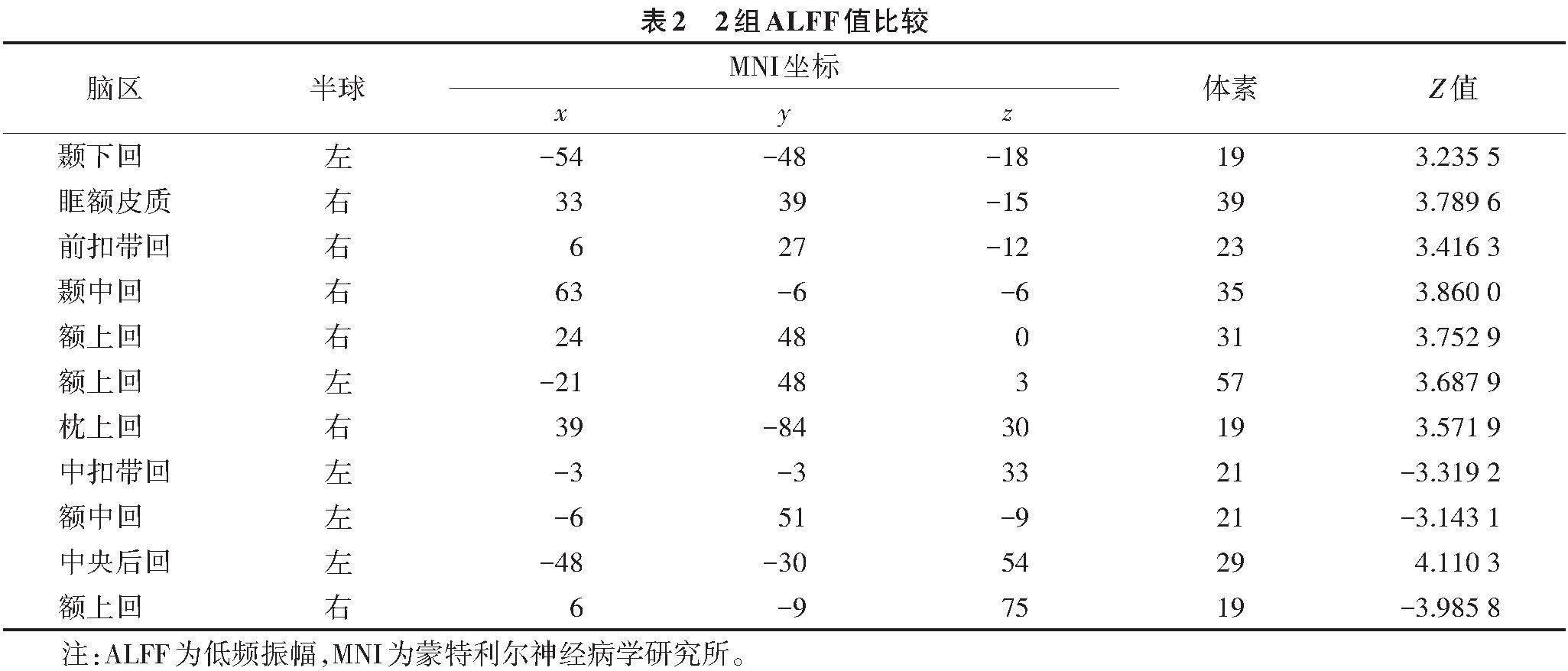
2.2 2组ALFF值及其与临床指标的相关性
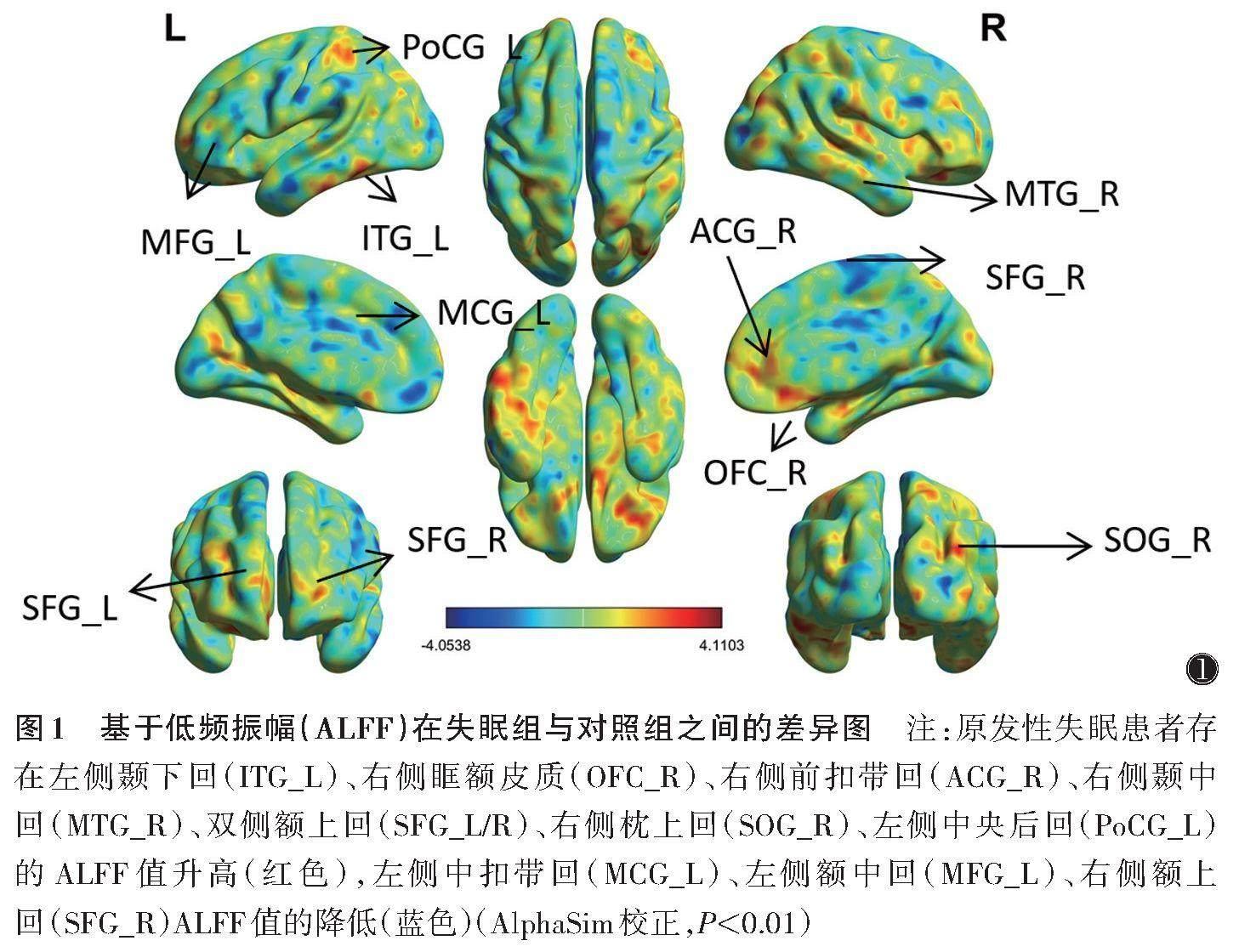
失眠组患者左侧颞下回、右侧眶额皮质、右侧前扣带回、右侧颞中回、双侧额上回、右侧枕上回、左侧中央后回的ALFF值升高,左侧中扣带回、左侧额中回、右侧额上回ALFF值降低(AlphaSim校正,P<0.01)(表2,图1)。SDS评分与右侧眶额皮质、左侧中扣带回ALFF值均呈正相关(r=0.528,0.641;均P<0.05),SAS评分与左侧中扣带回呈正相关(r=0.494,P=0.037);其他脑区与临床指标均无明显相关性(图2)。
3 讨论
失眠与不良童年经历、近期创伤和重大生活事件有关,如近亲或朋友的死亡、家庭成员重病及经受身体、性或情感暴力等事件。失眠易引起焦虑抑郁、恐惧等负面情绪,负面情绪又可导致失眠加重,造成恶性循环[4]。
本研究中,原发性失眠患者ALFF值脑区升高区域在左侧颞下回、右侧眶额皮质、右侧前扣带回、右侧颞中回、双侧额上回、右侧枕上回、左侧中央后回,ALFF值的降低区域在左侧中扣带回、左侧额中回、右侧额上回。
前扣带回主要参与认知控制、学习加强及情绪调节,属于边缘系统的组成部分。边缘系统参与负面情绪和认知的调节。失眠患者的边缘系统在面对既往负面经历情绪方面反应更强烈,特别是前扣带回。前扣带回脑神经自发活动异常升高说明对负面情绪调节失衡。同时,前扣带回和杏仁核也被认为是突显网络的重要组成部分,突显网络具有情感与生理状态整合功能,突显网络功能连接的增加与对外在和内在负面刺激的过度敏感察觉有关。前扣带回脑功能连接增加也相应引起脑局部活动的增加[6],既往研究也发现,失眠患者存在前扣带回的ReHo值升高[7],与本研究中前扣带回脑神经自发活动升高结果相符。
本研究发现,左侧中扣带回脑自发活动减少。中扣带回属于边缘系统,又称为前扣带回运动区,中扣带回与辅助运动区、背外侧前额叶皮质、初级运动皮质、顶下皮质、网状结构和运动丘脑、红核、脊髓之间具有纤维投射,是调控执行功能的高级神经网络[8]。中扣带回与运动的准备和启动有关,作用于响应选择和反馈导向决策,在连接运动和认知方面具有确定作用[9]。原发性失眠患者中扣带回脑自发活动减弱,对事物的认知能力与运动应对能力存在功能障碍,可解释临床出现日间功能反应迟钝症状。日间功能障碍会引起患者对工作、生活及人际关系处理的异常,也使患者产生抑郁、焦虑等负面情绪。部分研究表明前中扣带回与负面情绪、疼痛及认知控制有关[10]。眶额皮质、前扣带回还与恐惧-惊恐网络有关[11]。失眠患者看到与睡眠相关的图片会表现出更强的中央前回和前额叶皮质的激活,而认知行为治疗后这种增强的反应减弱[12],这也表明失眠患者对睡眠本身具有很强的恐惧心理。原发性失眠患者的左侧眶额皮质增厚,左侧眶额皮质体积增加[13]。眶额皮质及扣带回中部是边缘网络的核心部分,边缘皮质在认知和情绪处理方面发挥着中枢作用,包括冲突监视、情绪唤醒及激励和情绪调节中的注意力控制[14]。本研究中失眠组和对照组的SAS、SDS评分差异有统计学意义,单因素相关分析表明SAS、SDS评分均与左侧中扣带回ALFF值呈正相关,说明中扣带回可能是2种情绪障礙不同的神经环路中共同参与的一个重要脑区,SDS评分也与眶额皮质呈正相关,表明负面情绪的调节失控会引起中扣带回及眶额皮质的过度激活,情绪障碍可能是失眠神经机制的重要环节。
前额叶不仅参与内外环境的整合、情绪整合及环境记忆的提取,还同时与其他脑区合作维持静息状态脑内活动的基本功能[15],也与警觉性、注意力和执行功能有关。本研究额上回及额中回存在ALFF值升高或减低的区域,认知功能和情绪调节能力下降可能与额前叶皮质的活动减少有关;最近一项动物实验也表明,在长期睡眠不足的情况下,前额叶功能障碍可能与投射至前额叶皮质的蓝斑神经元的神经疲劳有关[16]。额中回与注意力和联想记忆有关[17-18]。额中回的脑自发活动减低与失眠患者存在注意力减弱或记忆能力受损有关。既往研究发现,失眠患者额中回灰质体积减少,但ALFF分析发现有额中回脑活动升高的表现,尚需进一步验证[19]。
本研究中,ALFF值升高的脑区还包括颞下回、颞中回及枕上回。既往关于失眠患者工作记忆任务态fMRI的研究发现,失眠组相比正常受试者存在右侧额下回和右侧颞上回脑活动增加,部分失眠患者空间记忆任务态fMRI研究显示其双侧海马旁回、双侧颞叶皮质,以及顶上小叶活动明显增强,认为是维持认知表现出的脑活动补偿效应[20]。部分研究也发现,原发性失眠患者枕叶与颞叶的ALFF值升高[21],认为视觉相关区域不仅被真实视觉激活,也被视觉心理意象激活,故视觉皮质因为情绪变化可能导致更高的脑神经活动反应区。
本研究存在的不足:样本量较小;失眠本身受机体状态和周围环境的影响较大,干扰因素较多。未来将加大样本量,制订更加严格的纳入和排除标准。
综上所述,ALFF分析结果表明,原发性失眠患者的脑神经活动出现异常改变。异常脑区主要表现为情绪和认知相关区域神经活动异常,主要涉及额叶及扣带回,而中扣带回脑区是抑郁和焦虑情绪不同神经环路的重要组成部分。这些发现为原发性失眠的神经病理机制提供了重要信息,中扣带回脑活动异常可评估患者合并焦虑和抑郁状态的情况,提供相对客观的神经影像指标,为疾病评估及治疗打下基础。
[参考文献]
[1] SCHIEL J E,HOLUB F,PETRI R,et al. Affect and arousal in insomnia:through a lens of neuroimaging studies[J]. Curr Psychiatry Rep,2020,22(9):44.
[2] ZHANG B,WING Y K. Sex differences in insomnia:a meta-analysis[J]. Sleep,2006,29(1):85-93.
[3] RIEMANN D,BAGLIONI C,BASSETTI C,et al. European guideline for the diagnosis and treatment of insomnia[J]. J Sleep Res,2017,26(6):675-700.
[4] VAN SOMEREN E J W. Brain mechanisms of insominia:new perspectives on causes and consequences[J]. Physiol Rev,2021,101(3):995-1046.
[5] AMERICAN PSYCHIATRIC ASSOCIATION.Diagnostic and statistical manual of mental disorders[M]. 4th ed. Washington DC:American Psychiatric Association,1994.
[6] CAI W,ZHAO M,LIU J,et al. Right arcuate fasciculus and superior longitudinal fasciculus abnormalities in primary insomnia[J]. Brain Imaging Behav,2019,13(6):1746-1755.
[7] YU S,FENG F,ZHANG Q,et al. Gray matter hypertrophy in primary insomnia:a surface-based morphometric study[J]. Brain Imaging Behav,2020,14(5):1309-1317.
[8] REGEN W,KYLE S D,NISSEN C,et al. Objective sleep disturbances are associated with greater waking resting-state connectivity between the retrosplenial cortex/hippocampus and variou nodes of the default mode network[J]. J Psychiatry Neurosci,2016,41(5):295-303.
[9] WANG P,CAI H,LUO R,et al. Measurement of cortical atrophy and its correlation to memory impairment in patients with asymptomatic carotid artery stenosis based on VBM-DARTEL[J]. Front Aging Neurosci,2021,13:620763.
[10] 王薇薇,吳逊. 扣带回的解剖、生理及扣带回癫痫[J]. 中国现代神经疾病杂志,2018,18(5):315-323.
[11] LIM E C,TAN J J,ONG B K,et al. Generalized myoclonus evolving into epilepsia partialis continua due to a cingulate gyrus lesion:case report and review of the literature[J]. Parkinsonism Relat Disord,2004,10(7):447-449.
[12] LEE M H,LEE K H,OH S M,et al. The moderating effect of prefrontal response to sleep-related stimuli on the association between depression and sleep disturbance in insomnia disorder[J]. Scientific Reports,2022,12(1):17739.
[13] YU S,FENG F,ZHANG Q,et al. Gray matter hypertrophy in primary insomnia:asurface-based morphometricstudy[J]. BrainImaging Behav,2020,14(5):1309-1317.
[14] JAPEE S,HOLIDAY K,SATYSHUR M D,et al. A role of right middle frontal gyrus in reorienting of attention:a case study[J]. Front Syst Neurosci,2015,9:23.
[15] CHEN M C,CHANG C,GLOVER G H,et al. Increased insula coactivation with salience networks in insomnia[J]. Biol Psychol,2014,97:1-8.
[16] DAI X J,NIE X,LIU X,et al. Gender differences in regional brain activity in patients with chronic primary insomnia:evidence from a resting-state fMRI study[J]. J Clin Sleep Med,2006,12(3):363-374.
[17] 王忠艳,霍健伟,李俊秋,等. 慢性原发性失眠局部一致性的静息态fMRI研究[J]. 医学影像学杂志,2020,30(12):2179-2182.
[18] BELLESI M,TONONI G,CIRELLI C,et al. Region-specific dissociation between cortical noradrenaline levels and the sleep/wake cycle[J]. Sleep,2016,39(1):143-154.
[19] WU Y,ZHUANG Y,QI J. Explore structural and functional brain changes in insomnia disorder:a PRISMA-compliant whole brain ALE meta-analysis for multimodal MRI[J]. Medicine(Baltimore),2020,99(14):19151.
[20] VOGT B A. Submodalities of emotion in the context of cingulate subregions[J]. Cortex,2014,59:197-202.
[21] SON Y D,KANG J M,CHO S J,et al. fMRI brain activation in patients with insomnia disorder during a working memory task[J]. Sleep Breath,2018,22(2):487-493.

