基于独立成分分析对伴脑室周围白质损伤的痉挛型脑性瘫痪患儿脑功能网络的研究
赵纯风 罗丹 喻皓月 彭莹 杨艳丽 刘衡
[摘要] 目的:使用独立成分分析(ICA)方法探讨伴脑室周围白质损伤(PWMI)的痉挛型脑性瘫痪(SCP)患儿网络内和网络间功能连接改变。方法:对28例伴PWMI的SCP患儿(患儿组)及性别、年龄匹配的19例正常儿童(对照组)行fMRI,应用ICA方法提取2组网络成分,并用SPM12及NBS软件比较2组网络内和网络间功能连接差异,同时应用Pearson或Spearman相关性分析验证患儿组功能连接差异脑区与临床变量之间的相关性。结果:与对照组相比,患儿组默认模式网络(DMN)内左侧额中回、左侧楔前叶及右侧角回,vAN内右侧中央后回,VNm内双侧舌回功能连接减低。以上功能连接差异脑区与临床变量均未发现显著相关性。结论:SCP与大脑网络功能连接异常有关,推测网络功能连接改变可能成为早期识别和诊断SCP的影像学生物指标。
[关键词] 脑室周围白质损伤;痉挛型脑性瘫痪;独立成分分析;磁共振成像
An independent component analysis-based study of functional brain networks in children with spastic cerebral palsy complicated with periventricular white matter injury
[Abstract] Objective:To investigate intra- and internetwork functional connectivity changes in children with spastic cerebral palsy (SCP) complicated with periventricular white matter injury (PWMI) using independent component analysis (ICA). Methods:Resting-state fMRI was performed on 28 SCP children with PWMI (the SCP group) and 19 normal children (the control group). The ICA method was applied to extract the network components of the two groups,and SPM12 and NBS software were used to compare the differences in intra- and internetwork functional connectivity between the two groups,and Pearson or Spearman correlation analysis were applied to verify the correlation between functional connectivity differences and clinical variables in the SCP group. Results:Compared with the control group,the functional connectivity of the left middle frontal gyrus,left precuneus and right angular gyrus within the default mode network,the right postcentral gyrus within the ventral attention network,and the bilateral lingual gyrus within the medial visual network were weakened in the patient group,but no significant correlations were found between the above functional connectivity difference and clinical variables. Conclusions:Patients with SCP have abnormal functional brain network patterns,and it is hypothesized that alterations in functional conectivity may serve as an imaging bioindicator for early diagnosis and recognition of SCP.
[Key words] Periventricular white matter injury;Spastic cerebral palsy;Independent component analysis;Magnetic resonance imaging
腦性瘫痪是由于发育中的大脑缺陷或病变导致的一组非进行性运动和姿势障碍,是最常见的儿童运动障碍综合征,该病在我国儿童及青少年中的患病率约为2.07‰,且呈逐年上升趋势[1]。脑性瘫痪患儿常伴感觉、认知、交流和行为障碍,以及癫痫和继发性肌肉骨骼问题,给家庭及社会带来沉重负担[2]。痉挛型脑性瘫痪(spastic cerebral palsy,SCP)是脑性瘫痪最常见的亚型,以肌张力增高、反射亢进、运动障碍、姿势异常、肢体畸形为主要临床表现[2]。脑室周围白质损伤(periventricular white matter injury,PWMI)是新生儿白质损伤的主要形式,也是SCP常见原因,早产儿发病率更高(>4%)[3-5]。然而,由于SCP病因复杂,其神经病理机制尚未完全阐明。
近年来,针对SCP的神经影像学研究多集中在大脑结构的改变,并取得了一定成果,如发现SCP患儿双侧感觉运动皮质、后扣带回皮质、基底节区、顶叶、颞叶、枕叶、丘脑和小脑的灰质体积显著减少[6-7]。伴PWMI的SCP患儿皮质脊髓束、丘脑后辐射、胼胝体膝部及压部各向异性分数降低,且皮质脊髓束各向异性分数降低与运动功能评分相关[5]。但有关SCP脑功能改变与临床特征间的相关性研究较少。
静息态fMRI作为一种无创检查方式,不仅可反映脑组织局部区域活动功能,还有助于临床医师理解大脑如何实现复杂的数据处理及其在静息状态下如何响应任务需求而发挥作用[8]。其中,功能连接通过检测BOLD信号的时间相关性在2个ROI之间建立联系[9],已被用于检测脑性瘫痪患儿大脑异常通路(如体感、运动和丘脑皮质通路)[6,10-11]。但从受试者中提取的静息态fMRI信号实际上是包含ROI和其他伪影的复合信号。独立成分分析(independent component analysis,ICA)是一种基于盲源分离算法的数据驱动方法,其通过数学算法将全脑体素的信号分解为空间上和时间上相互独立的成分,从而有助于提取不同的静息态网络[12-13]。其中,功能连接可用于表示静息态网络间的时间相关性。因此,本研究基于静息态fMRI,采用ICA方法,探讨SCP患儿网络内和网络间功能连接改变及其与临床变量之间的相关性。
1 资料与方法
1.1 一般资料
收集2019年5月至2022年4月我院诊断的SCP患儿96例。纳入标准:①符合《中国脑性瘫痪康复指南(2015)》[14]中SCP的诊断标准;②年龄4~14岁;③常规MRI均有PWMI表现。排除标准:①运动障碍或共济失调型脑性瘫痪;②临床信息不完整;③MRI图像质量差。最终28例伴PWMI的SCP患儿(患儿组)纳入研究。
同时纳入19例性别、年龄匹配的正常儿童(对照组)。纳入标准:①MRI未见异常;②无神经、精神疾病史;③无围生期缺血性或缺氧性脑病病史。排除标准:①MRI图像质量差。
MRI检查前3 d,患儿组采用韦氏智力量表(中文版,第Ⅳ版)(包括言语理解评分、工作记忆评分、加工速度评分、总智商)、粗大运动功能分级系统[15]、手功能分级系统[16]、沟通功能分级系统[17]行智力、粗大运动功能、手功能及沟通功能评估。对照组采用韦氏智力量表(中文版,第Ⅳ版)进行智力评估。本研究在中国临床试验中心完成注册(注册号:ChiCTR2100049497),經遵义医科大学医学伦理委员会批准(编号:KLL-2021-108)。所有受试儿童家属或监护人均签署知情同意书。
1.2 仪器与方法
使用GE Signa HDx 3.0 T MRI扫描仪。扫描过程中受试者佩戴降噪耳塞保持静止,并固定头部,以减少运动伪影。不配合者,可口服10%水合氯醛(0.25~0.50 mL/kg体质量,最大剂量为10 mL/d)镇静,并告知监护人注意事项及潜在的不良反应。扫描序列及参数:①3D-T1WI采用翻转恢复快速自旋回波序列,TR 7.8 ms,TE 3.0 ms,视野256 mm×256 mm,矩阵256×256,激励次数1,层数146层,层厚1 mm,无间隔,扫描时间6 min 49 s。②T2WI采用翻转恢复快速自旋回波序列,TR 4 480 ms,TE 120 ms,视野256 mm×256 mm,矩阵256×256,激励次数1,扫描层数146层,层厚5 mm,无间隔,扫描时间23 s。③T2 FLAIR采用翻转恢复快速自旋回波序列,TR 9 500 ms,TE 140 ms,视野240 mm×240 mm,矩阵240×240,激励次数1,层数146层,层厚2 mm,无间隔,扫描时间5 min 43 s。④BOLD采用梯度回波-回波平面成像序列,TR 2 000 ms,TE 30 ms,视野256 mm×256 mm,矩阵64×64 mm,层厚4.0 mm,无间隔,翻转角90°,扫描时间7 min。
1.3 数据处理
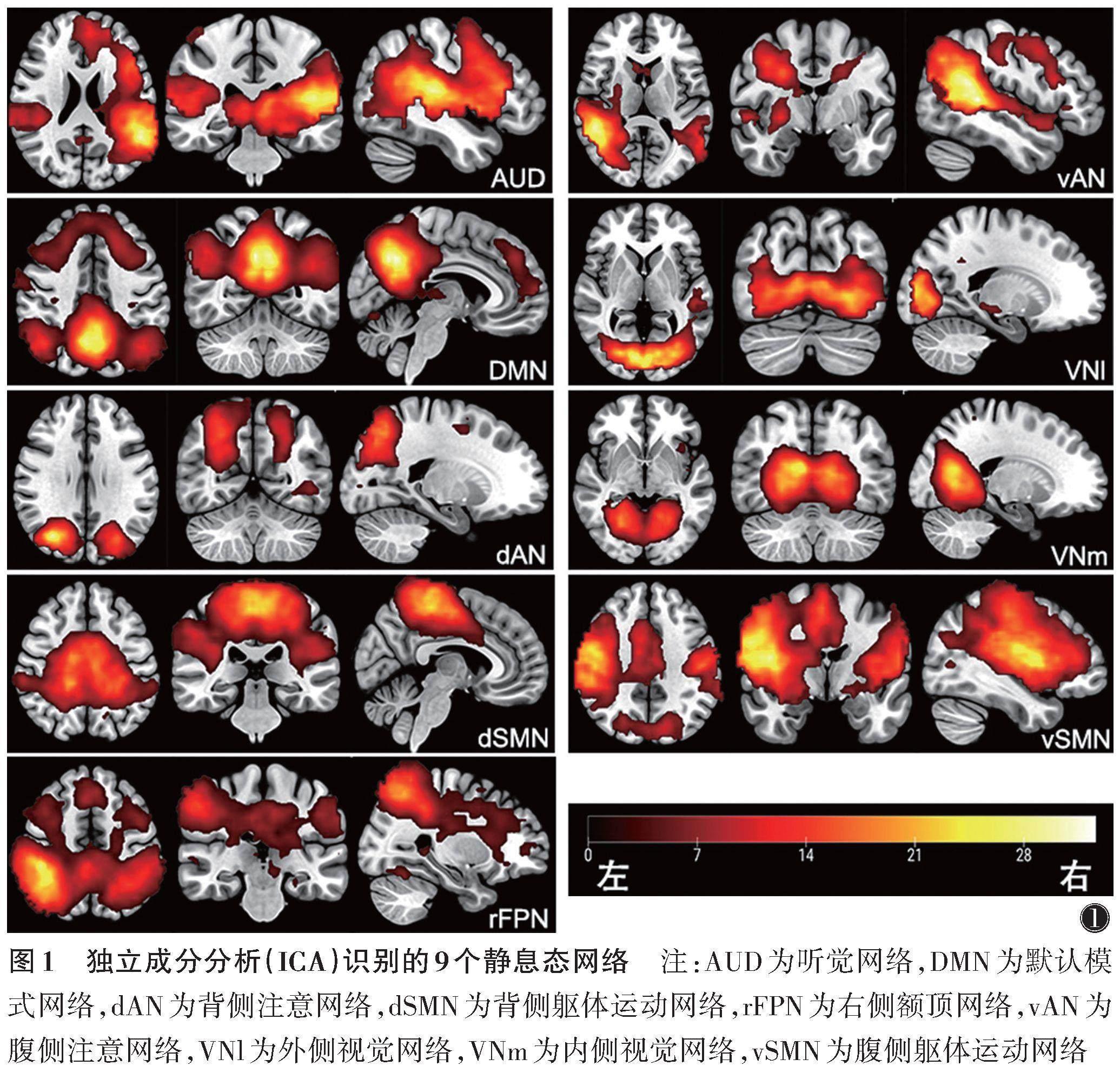
使用FSL软件(http://www.fmrib.ox.ac.uk)对静息态fMRI数据行ICA。预处理过程包括剔除前10个时间点、时间层校正、头动校正、空间标准化及空间平滑。预处理后,使用数据驱动方法(在FSL MELODIC中实现时间级联ICA)识别所有受试者共有的静息态网络。从ICA识别的30个成分中选择9个成分作为静息态相关网络(图1),包括听觉网络(AUD)、默认模式网络(DMN)、背侧注意网络(dAN)、腹侧注意网络(vAN)、背侧躯体运动网络(dSMN)、腹侧躯体运动网络(vSMN)、右侧额顶网络(rFPN)、外侧视觉网络(VNl)及内侧视觉网络(VNm)。
1.4 统计学分析
应用SPSS 29.0软件对2组年龄、性别、临床变量行统计分析,正态分布数据比较行独立样本t检验,非正态分布数据比较行Mann-Whitney U检验;2组间性别差异行χ2检验或Fisher确切概率法检验。以P<0.05为差异有统计学意义。应用SPM12软件(http://www.fil.ion.ucl.ac.uk/spm/software/spm12/)对影像学数据进行分析。将提取的所有受试者的静息态网络行单样本t检验(FEW校正,检验水准取α=0.05),将P<0.05的结果保存为二值掩模。将掩模作为统计分析范围,对所有静息态网络行两样本t检验(团块水平FDR校正,其中体素水平P<0.001,团块水平P<0.05),年龄、性别作为协变量。
提取2组静息态网络内功能连接差异显著脑区,患儿组差异脑区与临床变量行相关性分析,2组均服从正态分布的脑区行Pearson相关分析,不服从正态分布的脑区行Spearman相关分析。以P<0.05为差异有统计学意义。
2 结果
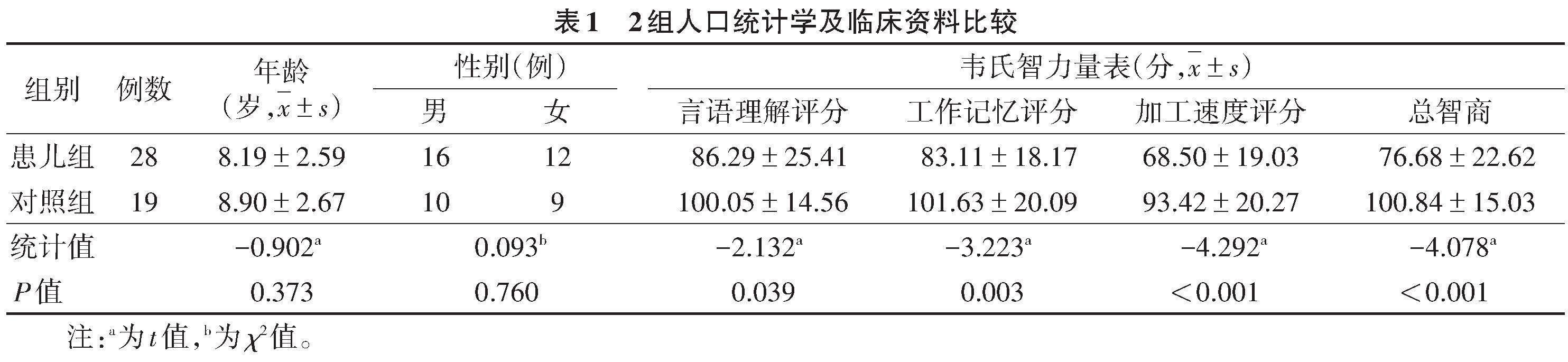
2.1 2组人口统计学及临床资料(表1)
2组间性别、年龄差异均无统计学意义(均P>0.05)。2组韦氏智力量表中的言语理解评分、工作记忆评分、加工速度评分及总智商比较,差异均有统计学意义(均P<0.05)。患儿组28例中,粗大运动功能分级Ⅰ级15例,Ⅱ级4例,Ⅲ级5例,Ⅳ級2例,Ⅴ级3例;手功能分级Ⅰ级14例,Ⅱ级7例,Ⅲ级4例,Ⅳ级2例,Ⅴ级1例;沟通功能分级Ⅰ级22例,Ⅱ级、Ⅲ级、Ⅳ级各2例。
2.2 2组网络间功能连接比较
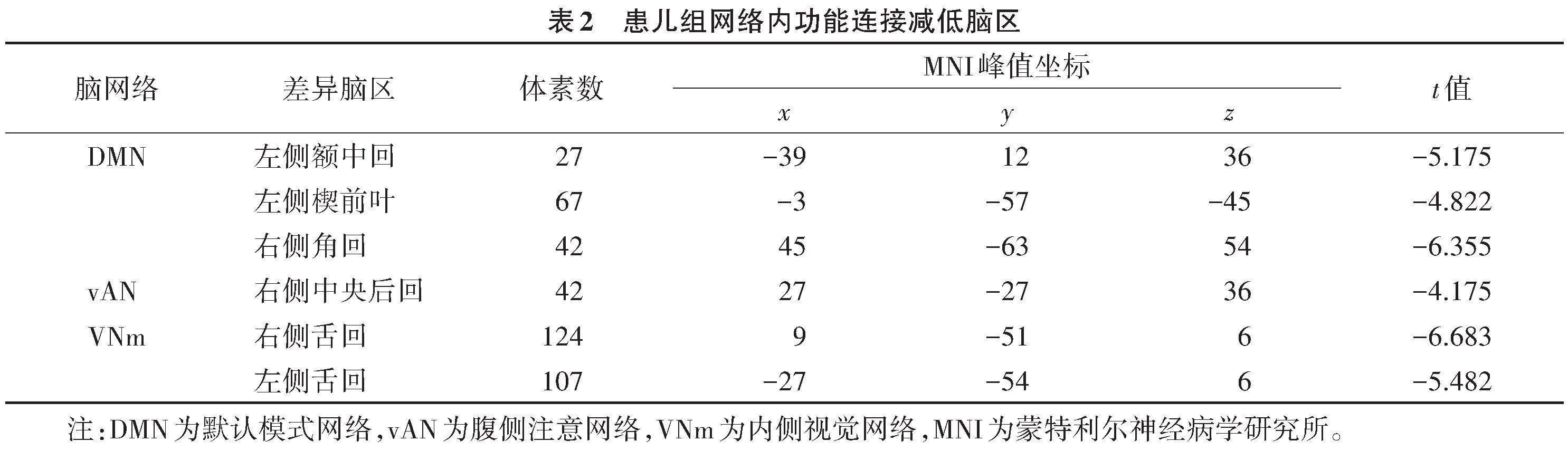
与对照组相比,患儿组DMN内左侧额中回、左侧楔前叶及右侧角回,vAN内右侧中央后回,VNm内双侧舌回功能连接减低(表2,图2)。以上功能连接差异脑区与韦氏智力量表评分、粗大运动功能分级、手功能分级及沟通功能分级均未发现显著相关性。2组网络间功能连接差异无统计学意义(P>0.05)。
3 讨论
本研究基于ICA探讨SCP患儿静息态网络内功能连接改变,与对照组相比,患儿组DMN、vAN、VNm内的功能连接改变,表明SCP患儿存在大脑功能连接障碍,这些发现可能促进对SCP神经病理学机制的理解。
DMN被定义为一组区域,包括后扣带回/楔前叶、前扣带回/中额叶皮质和颞顶叶交界区[18]。DMN在多个认知领域发挥着重要作用,尤其是在自我参照、社会认知、情景记忆、语言和语义记忆等方面[19]。在神经精神病学领域,DMN一直是研究关注的重点,如自闭症谱系障碍、精神分裂症、抑郁症等[20-22],但在有关脑性瘫痪的研究中却很少提及。本研究发现,SCP患儿DMN内部连接减弱,包括左侧额中回、左侧楔前叶和右侧角回。其中,额中回属于额叶分区,与认知功能相关[23]。楔前叶位于顶叶内侧,其生理功能尚不完全清楚,目前主要认为其在高层次认知功能整合中发挥重要作用[24]。角回属于视觉语言中枢,参与情景记忆和语义记忆[25]。SCP患儿DMN内以上区域连接减低,可能与认知障碍发病机制相关,而Qin等[26]研究发现,SCP患儿DMN内功能连接与对照组儿童无显著差异,但DMN与其他网络连接减低。造成这种差异的原因可能是患儿个体差异较大,不同类型及损伤模式的脑性瘫痪,其大脑改变也不一致[27]。未来研究需更加细化脑性瘫痪的亚型及损伤模式,并扩大样本量进一步探讨脑性瘫痪的神经病理学机制。
本研究还发现,SCP患儿vAN内右侧中央后回、VNm双侧舌回功能连接减低。中央后回位于初级体感皮质,涉及体感功能,SCP患儿中央后回局部区域一致性降低[28],这与本研究结果相似,因此,中央后回功能连接减低很可能与SCP患儿感觉运动障碍有关。另外,SCP患儿VNm双侧舌回功能连接减低。舌回作为枕叶一部分,与视觉记忆、面部及空间识别有关。在重度抑郁患者中,舌回可能是抗抑郁反应和维持正常认知功能的关键区域[29]。本研究SCP患儿VNm内双侧舌回功能连接减弱,进一步解释了患儿认知功能受损的潜在原因。之前一项基于全脑功能连接分析对SCP的研究发现,SCP患儿双侧舌回功能连接减低[11],与本研究结果相符。
本研究存在的局限:①属于横向研究,样本量较小,后续应扩大样本量进一步验证结果的可重复性。②药物诱导镇静对静息态网络存在一定影响[30],目前仍未得到很好的解决,其对功能连接的结果不容忽视。③ICA是一种无监督学习方法,在识别静息态网络时仍有间接限制。独立成分数量的确定及识别独立成分的可靠性仍未解决。未来的研究需不同的神经影像分析方法探讨SCP大脑功能连接改变。
综上所述,本研究基于ICA探讨伴PWMI的SCP患儿静息态网络功能连接改变,推测静息态网络功能连接改变可能成为早期诊断和识别SCP的影像学指标。
[参考文献]
[1] YANG S,XIA J,GAO J,et al. Increasing prevalence of cerebral palsy among children and adolescents in China 1988-2020:a systematic review and meta-analysis[J]. J Rehabil Med,2021,53(5):00195.
[2] GULATI S,SONDHI V. Cerebral palsy:an overview[J]. Indian J Pediatr,2018,85(11):1006-1016.
[3] LIU C,PENG Y,YANG Y,et al. Structure of brain grey and white matter in infants with spastic cerebral palsy and periventricular white matter injury[J]. Dev Med Child Neurol,2024,66(4):514-522.
[4] REID L B,ROSE S E,BOYD R N. Rehabilitation and neuroplasticity in children with unilateral cerebral palsy[J]. Nat Rev Neurol,2015,11(7):390-400.
[5] JIANG H,LI X,JIN C,et al. Early diagnosis of spastic cerebral palsy in infants with periventricular white matter injury using diffusion tensor imaging[J]. AJNR Am J Neuroradiol,2019,40(1):162-168.
[6] LEE J D,PARK H J,PARK E S,et al. Motor pathway injury in patients with periventricular leucomalacia and spastic diplegia[J]. Brain,2011,134(Pt 4):1199-1210.
[7] MU X,NIE B,WANG H,et al. Spatial patterns of whole brain grey and white matter injury in patients with occult spastic diplegic cerebral palsy[J]. PLoS One,2014,9(6):e100451.
[8] AL-ARFAJ H K,AL-SHARYDAH A M,ALSUHAIBANI S S,et al. Task-Based and resting-state functional MRI in observing eloquent cerebral areas personalized for epilepsy and surgical oncology patients:a review of the current evidence[J]. J Pers Med,2023,13(2):370.
[9] SMITHA K A,AKHIL RAJA K,ARUN K M,et al. Resting state fMRI:a review on methods in resting state connectivity analysis and resting state networks[J]. Neuroradiol J,2017,30(4):305-317.
[10] BURTON H,DIXIT S,LITKOWSKI P,et al. Functional connectivity for somatosensory and motor cortex in spastic diplegia[J]. Somatosens Mot Res,2009,26(4):90-104.
[11] MU X,WANG Z,NIE B,et al. Altered regional and circuit resting-state activity in patients with occult spastic diplegic cerebral palsy[J]. Pediatr Neonatol,2018,59(4):345-351.
[12] LV H,WANG Z,TONG E,et al. Resting-State functional MRI:everything that nonexperts have always wanted to know[J]. AJNR Am J Neuroradiol,2018,39(8):1390-1399.
[13] DE LUCA M,BECKMANN C F,DE STEFANO N,et al. fMRI resting state networks define distinct modes of long-distance interactions in the human brain[J]. Neuroimage,2006,29(4):1359-1367.
[14] 唐久來,秦炯,邹丽萍,等. 中国脑性瘫痪康复指南(2015):第一部分[J]. 中国康复医学杂志,2015,30(7):747-754.
[15] PALISANO R J,ROSENBAUM P,BARTLETT D,et al. Content validity of the expanded and revised Gross Motor Function Classification System[J]. Dev Med Child Neurol,2008,50(10):744-750.
[16] ELIASSON A C,KRUMLINDE-SUNDHOLM L,ROSBLAD
B,et al. The manual Ability Classification System (MACS) for children with cerebral palsy:scale development and evidence of validity and reliability[J]. Dev Med Child Neurol,2006,48(7):549-554.
[17] 王燕娜,史惟. 复旦中文版沟通功能分级系统的信度和效度研究[J]. 中国循证儿科杂志,2017,12(5):321-327.
[18] VANHAUENHUYSE A,NOIRHOMME Q,TSHIBANDA L J,et al. Default network connectivity reflects the level of consciousness in non-communicative brain-damaged patients[J]. Brain,2010,133(Pt 1):161-171.
[19] MENON V. 20 years of the default mode network:a review and synthesis[J]. Neuron,2023,111(16):2469-2487.
[20] LAJINESS-ONEILL R,BRENNAN J R,MORAN J E,et al. Patterns of altered neural synchrony in the default mode network in autism spectrum disorder revealed with magnetoencephalography (MEG):relationship to clinical symptomatology[J]. Autism Res,2018,11(3):434-449.
[21] ZHOU L,PU W,WANG J,et al. Inefficient DMN suppression in schizophrenia patients with impaired cognitive function but not patients with preserved cognitive function[J]. Sci Rep,2016,6:21657.
[22] SCALABRINI A,VAI B,POLETTI S,et al. All roads lead to the default-mode network-global source of DMN abnormalities in major depressive disorder[J]. Neuropsychopharmacology,2020,45(12):2058-2069.
[23] GARCIA-ALVAREZ L,GOMAR J J,SOUSA A,et al. Breadth and depth of working memory and executive function compromises in mild cognitive impairment and their relationships to frontal lobe morphometry and functional competence[J]. Alzheimers Dement (Amst),2019,11:170-179.
[24] 王薇薇,吳逊. 顶叶内侧——解剖、生理与癫痫[J]. 癫痫杂志,2022,8(6):550-554.
[25] BONNICI H M,RICHTER F R,YAZAR Y,et al. Multimodal feature integration in the angular gyrus during episodic and semantic retrieval[J]. J Neurosci,2016,36(20):5462-5471.
[26] QIN Y,LI Y,SUN B,et al. Functional connectivity alterations in children with spastic and dyskinetic cerebral palsy[J]. Neural Plast,2018,2018:7058953.
[27] RADWAN A,DECRAENE L,DUPONT P,et al. Exploring structural connectomes in children with unilateral cerebral palsy using graph theory[J]. Hum Brain Mapp,2023,44(7):2741-2753.
[28] LI X,ZHANG M,LI K,et al. The altered somatic brain network in state anxiety[J]. Front Psychiatry,2019,10:465.
[29] JUNG J,KANG J,WON E,et al. Impact of lingual gyrus volume on antidepressant response and neurocognitive functions in major depressive disorder:a voxel-based morphometry study[J]. J Affect Disord,2014,169:179-187.
[30] QIU M,SCHEINOST D,RAMANI R,et al. Multi-modal analysis of functional connectivity and cerebral blood flow reveals shared and unique effects of propofol in large-scale brain networks[J]. Neuroimage,2017,148:130-140.

