不同MoCA评分下血管性认知障碍患者的灰质体积差异基于体素的形态学分析
李凯琳 魏翔宇
[摘要] 目的:采用基于体素的形态学分析(VBM)方法,探究血管性认知障碍(VCI)患者灰质体积与认知障碍程度的关系。方法:选取157例确诊的VCI患者,根据蒙特利尔认知量表(MoCA)评分结果分为轻、中、重度组,均行颅脑MRI扫描和VBM分析。比较3组的颅脑总体积、灰质体积、白质体积、脑室或脑脊液体积,以及灰/白质体积与颅脑总体积之比。对组间差异脑区灰质体积与MoCA评分行相关性分析。结果:与轻度组相比,重度组右侧颞下回、右侧颞中回、右侧额中回、右侧额下回、右侧海马、右侧补充运动区和左侧中央旁小叶的脑灰质体积均显著减少(均P<0.05)。全部患者脑灰质体积与MoCA评分呈正相关(r=0.249,P<0.001);右侧海马区灰质体积与MoCA评分呈正相关(r=0.432,P<0.001)。结论:不同认知功能障碍水平的VCI患者存在额叶、颞叶、顶叶和海马等多个脑区的灰质体积变化,这为认知障碍程度的划分提供了神经影像学证据支持。
[关键词] 血管性认知障碍;灰质;蒙特利尔认知量表;基于体素的形态学测量;磁共振成像
A voxel-based morphometry (VBM) study of gray matter volume in patients with vascular cognitive impairment according to different MoCA scores
[Abstract] Objective:To explore the relationship of the gray matter volume and the degree of cognitive impairment in patients with vascular cognitive impairment (VCI) by the voxel-based morphometry (VBM) method. Methods:A total of 157 VCI patients were divided into the mild,moderate and severe groups based on the score of Montreal Cognitive Assessment (MoCA). All patients underwent MRI scan and VBM analysis. Finally,the volumes of total intracranial,gray matter,white matter,ventricle/cerebrospinal fluid and the ratio of the gray/white matter volume to the total intracranial volume were compared among the three groups. The correlations between gray matter volumes of different brain regions and MoCA score were analyzed. Results:Compared with the mild group,the gray matter volumes in the right inferior temporal gyrus,right middle temporal gyrus,right middle frontal gyrus,right inferior frontal gyrus,right hippocampus,right supplementary motor area and left paracentral lobule were significantly lower in the severe group (all P<0.05). There was a positive correlation between gray matter volume and MoCA score (r=0.249,P<0.001). The gray matter volume in the right hippocampus was positively correlated with the MoCA score (r=0.432,P<0.001). Conclusions:VCI patients with different levels of cognitive impairment have gray matter volume changes in the frontal lobe,temporal lobe,parietal lobe and hippocampus. From the perspective of gray matter volume differences,this study provides neuroimaging evidence supporting the classification to the degree of cognitive impairment.
[Key words] Vascular dementia;Gray matter;Montreal Cognitive Scale;Voxel-based morphometry;Magnetic resonance imaging
血管性認知障碍(vascular cognitive impairment,VCI)是由脑血管病变或危险因素引起认知功能受损的一组综合征[1],其发病率随年龄增长而逐年上升[2]。因此,探讨VCI的早期神经病理学特点对高危人群的筛查和预测,以及制订有效的缓解及预防策略等至关重要。多数指南根据病程将VCI分为轻度和重度[3-5]。局部梗死灶、局灶性神经元萎缩等病理改变是引起VCI的关键,这可能导致VCI患者局部脑区结构发生改变[6]。MRI是VCI影像学诊断的金标准[7],然而VCI患者的影像学表现常滞后于临床表现,且多数影像特征为定性资料,难以与认知损害程度进行关联。基于体素的形态学分析(voxel based morphometry,VBM)[8]可对灰质、白质和脑脊液等不同成分进行分割并开展亚区水平比较,在捕捉微小病灶并对早期病灶精准定位方面具有显著优势。此外,VBM扫描时间较短,极大降低了因扫描时间过长带来的头动等问题,使其成为分析VCI患者脑结构改变的理想工具[9]。本研究拟通过VBM技术分析不同认知障碍水平VCI患者的脑结构影像学特征。
1 资料与方法
1.1 一般资料
招募2021年1月至2022年12月在上海中医药大学附属曙光医院拟诊为VCI的患者。由具有10年以上脑病工作经验的医师对所有患者进行蒙特利尔认知量表(montreal cognitive assessment,MoCA)评估。
1.2 VCI诊断标准
参考美国精神病学协会发布的《精神疾病诊断与统计手册第5版》[10]中关于VCI的诊断标准:①经神经心理学检测确认存在≥1个认知领域的功能损害。②主诉或检查确认有血管性中枢神经受损病史。③血管性神经功能受损在认知损害中起主要作用。④认知障碍的发生与≥1个脑血管事件相关且在脑血管事件发生后3个月仍持续存在。认知障碍为突然发生,呈阶梯式加重。⑤满足≥1个VCI相关的MRI诊断标准,即MRI上有≥1个大血管供血区部位的脑梗死灶;存在广泛或关键部位(如丘脑或基底节区)脑梗死;存在>2个非脑干区域的腔隙性梗死灶;存在2个关键部位的腔隙性梗死灶,或非关键部位的腔隙性梗死灶合并广泛脑白质T2WI和FLAIR序列高信号;存在广泛或融合的脑白质T2WI和FLAIR序列高信号;存在关键部位的脑出血。
1.3 纳入及排除标准
纳入标准:①年龄45~70岁;②小学以上文化程度;③右利手;④符合VCI诊断标准;⑤充分了解本研究过程并签署MRI扫描知情同意书。排除标准:①有帕金森病、多发性硬化、脑炎等原发性神经系统疾病;②神经影像学检查缺乏血管性损伤特征;③患有肿瘤、梅毒、艾滋病、抑郁、中毒、药物或酒精依赖及其他能明显影响认知功能的神经和/或代谢系统疾病;④有幽闭恐惧症或心脏起搏器等MRI扫描禁忌证;⑤存在可能影响本研究的其他情况。
1.4 病情程度分级
以MoCA评分>25分为正常;18~24分为轻度认知功能障碍(轻度组);10~17分为中度认知功能障碍(中度组);<10分为重度认知功能障碍(重度组)。其中受教育年限≤12年(高中水平),加1分,总分≤30分。
1.5 仪器与方法
采用Siemens Magnetom Skyra 3.0 T MRI机和16通道相控阵线圈。患者取仰卧位,头部固定,戴耳塞,闭目并保持清醒。采用三维磁化强度预备梯度回波(3D-MPRAGE)序列。扫描参数:TR 7.2 ms,TE 3.1 ms,翻转角10°,视野256 mm×256 mm,矩阵512×512,层厚1 mm,层数192层,体素1 mm×1 mm×1 mm。
1.6 数据预处理
基于Matlab 2019a平台,采用SPM12和CAT12工具包进行预处理。步骤主要包括:①图像格式转换,将原始DICOM图像转换成NIFIT格式;②图像分割,基于DARTEL工具包,应用CAT12工具箱将图像分割为灰质、白质和脑脊液;③图像标准化和配准,以DARTEL工具包对灰质、白质和脑脊液数据分别行6次重复配准和平均,获得最佳灰质模板,将所有初始分割图像通过非线性变换配准至最对应的变形场,再基于变形场将分割后的图像标准化至加拿大蒙特利尔神经病学研究所(Montreal Neurological Institute,MNI)空间;④空间平滑,设置全宽半高为8 mm的高斯核行平滑处理,提高SNR;⑤质量控制,对标准化后的图像行质量检查,排除分割、配准效果不佳的数据。
1.7 VBM分析
提取并计算全部受试者的颅脑总体积、灰质体积、白质体积、脑室或脑脊液体积等指标,再计算灰/白质体积与颅脑总体积的比值。将年龄、性别及颅脑总体积作为协变量用于组间分析。使用XJView10.0软件分析差异脑区坐标、体素大小等,脑区划分标准采用解剖自动标记模板。使用BrainNetviewer软件(https://www.nitrc.org/projects/bnv/)展示差异脑区。
1.8 统计学分析
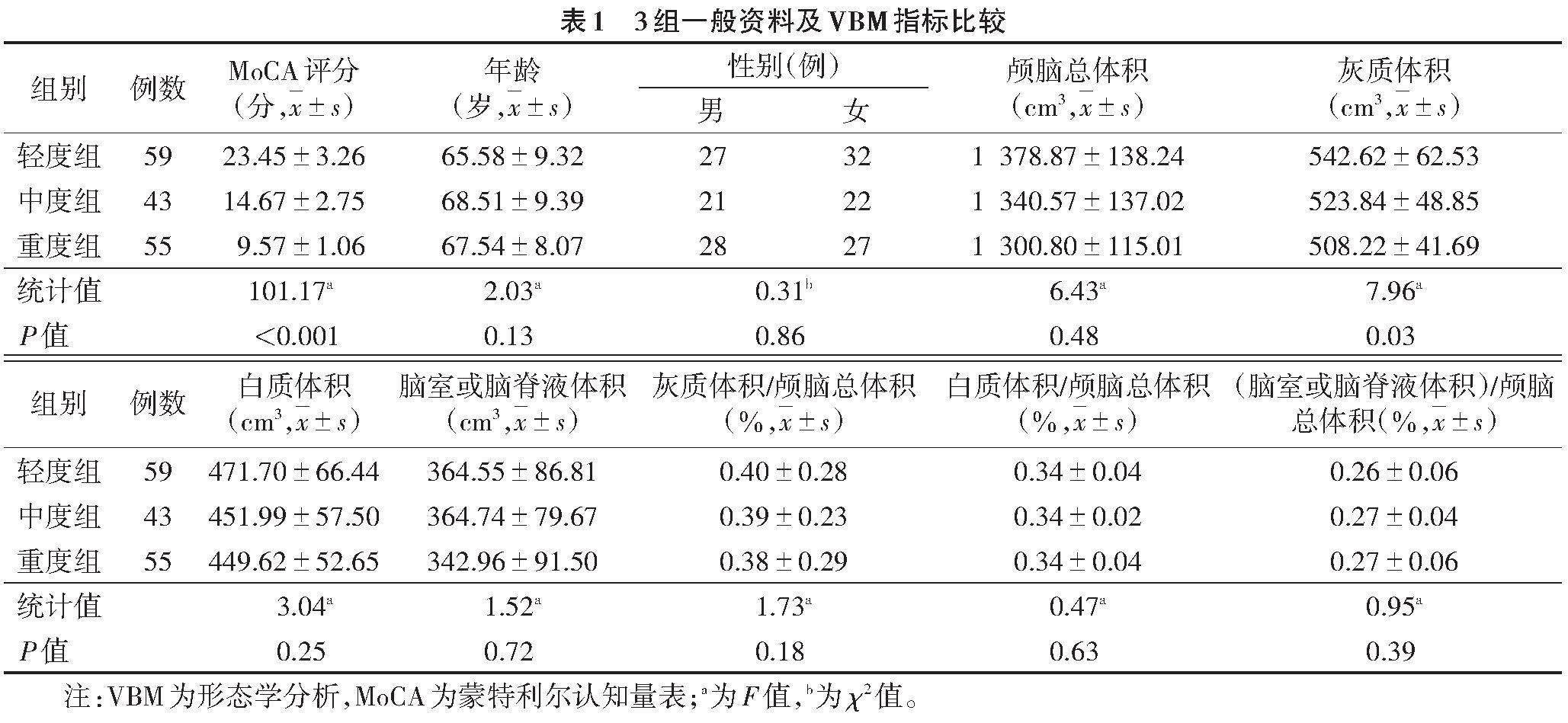
采用SPSS 25.0软件进行统计分析。计量资料符合正态分布以[x]±s表示,3组间比较采用单因素方差分析,事后多重比较行LSD-t检验,组间两两比较行独立样本t检验,性别构成比行χ2检验。VBM指标采用SPM12软件进行分析,行FWE多重比较校正,以体素数>100,P<0.001为差异有统计学意义。对组间差异脑区灰质体积与MoCA评分行相关性分析,以P<0.05为差异有统计学意义。
2 结果
共纳入符合VCI诊断标准的患者157例,其中轻度组59例,中度组43例,重度组55例。3组平均年龄、性别构成比差异均无统计学意义(均P>0.05)。3组VBM指标比较,除灰质体积差异有统计学意义(P<0.05)外,其余差异均无统计学意义(均P>0.05)。两两比较,轻度组和重度组灰质体积差异有统计学意义(P<0.05);而轻度组和中度组,以及中度组和重度组之间差异均无统计学意义(均P>0.05)(表1)。
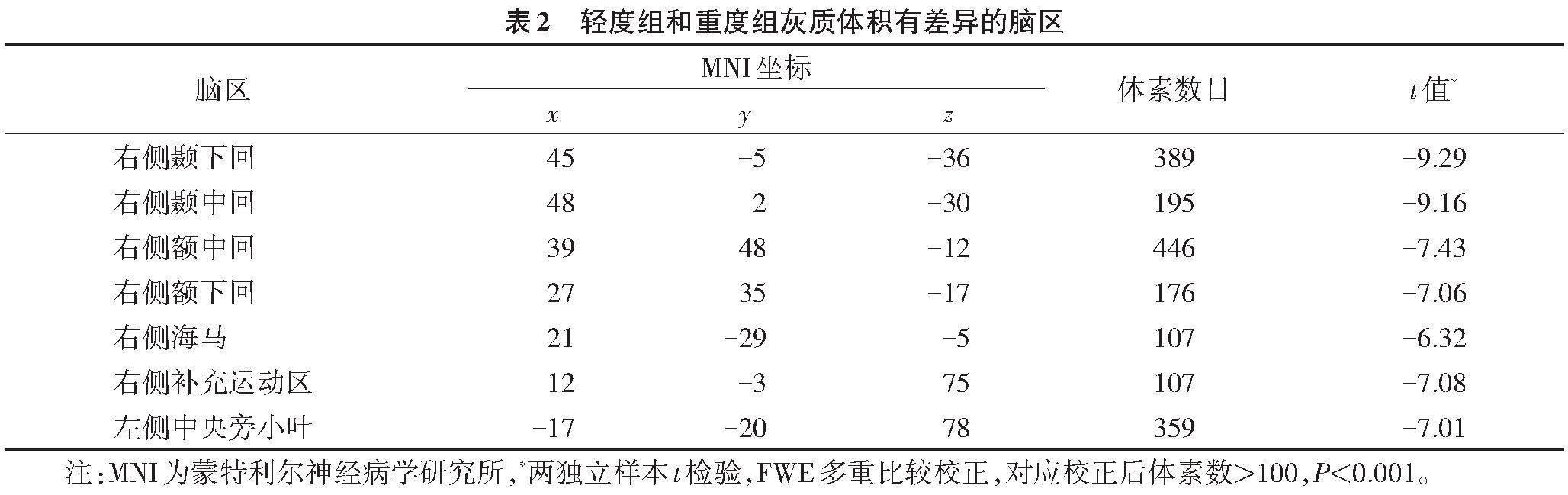
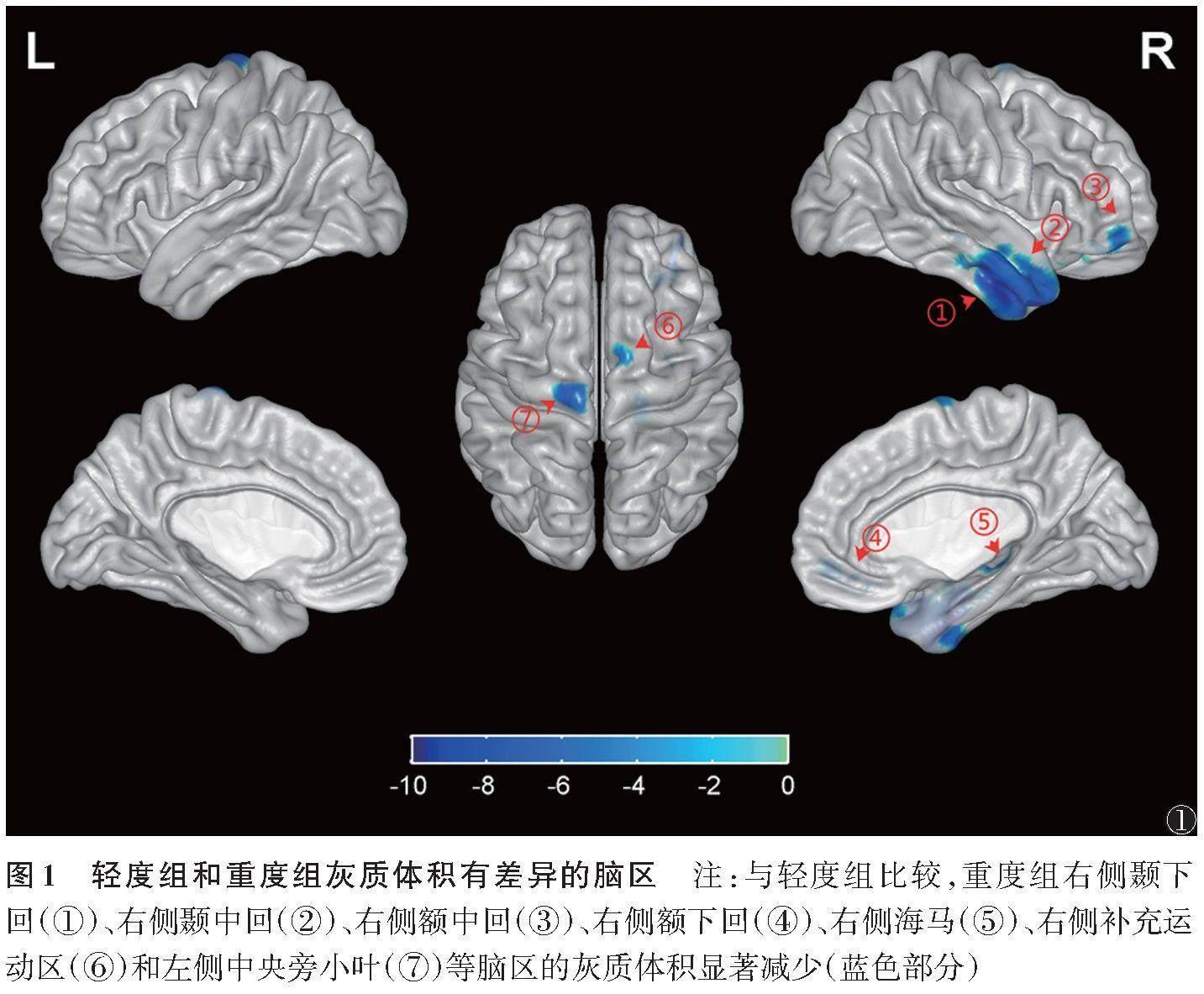
与轻度组相比,重度组右侧颞下回、右侧颞中回、右侧额中回、右侧额下回、右侧海马、右侧补充运动区和左侧中央旁小叶等脑区的脑灰质体积显著减少(表2,图1)。
将年龄作为控制变量,提取全部患者所有差异脑区的灰质体积,并与MoCA评分行相关性分析(图2)。结果显示,脑灰质总体积与MoCA评分呈正相关(r=0.249,P<0.001),右侧海马区灰质体积与MoCA评分呈正相关(r=0.432,P<0.001)。
3 討论
MoCA评分是筛查认知功能障碍的常用工具[11]。临床研究表明,MoCA评分对各种原因导致的轻度认知功能损害的敏感度高于简易精神状态检查(minimum mental state examination,MMSE)量表[12-13]。尽管MoCA评分的轻、中、重3级划分有助于理解患者认知功能障碍的连续变化过程,但本研究的神经影像学结果可能更支持VCI的轻、重2级划分法。本研究轻度组和重度组的灰质体积差异有统计学意义,而轻度组和中度组,以及中度组和重度组的差异均无统计学意义。这也提示单一的MoCA评分更适合对轻度认知功能障碍群体进行筛查,而对中、重度认知功能障碍的评估或痴呆的病因诊断,需进一步分析,如结合认知能力筛查测验、Hachinski缺血指数量表、临床痴呆评定量表等。此前也有研究对MoCA评分提出了异议,如认为将26分作为正常人群与认知障碍的界值可能增加筛查结果的假阳性率[14],以及相较MMSE题目变复杂而带来的地板效应[15]。因此,MoCA评分更大的价值在于对VCI患者的早期筛查,而对重度VCI患者的病因诊断及预后评估等方面的价值,还需进一步分析。
本研究事后分析顯示,重度组患者灰质体积显著减少的区域涉及部分颞叶、额叶、顶叶和边缘脑区。额中回属于大脑书写性语言中枢,负责识别语言表达中的细微差别,如语义、语法、语言流畅性和言语记忆等认知功能[16-17]。以往研究发现,额中回在语言流畅性试验中表现出持续激活[18]。额下回是运动性语言中枢且包含了Broca区[19]。一项双语研究表明,使用2种声调语言的双语者(如普通话和方言),其内在的语言中枢结构有别于单语者,特别是右侧额下回在双语者对声调语言进行加工时起着整合作用[20]。因此,推测重度VCI患者右侧额中回、额下回的灰质体积减少可能是导致语言功能障碍的重要原因。颞下回同样参与了高级认知功能,包括视觉和语义理解及情绪调节。此前一项结构影像学研究显示,慢性精神分裂症患者双侧颞下回体积减少[21]。颞下回的结构缺陷可能导致语义相关的多模态感觉整合和复杂视觉感知处理的功能障碍。颞下回通过白质纤维投射接收来自枕叶的视觉信息输入,并将综合信息连接至前额叶皮质,以实现更高阶层的认知功能[22]。研究表明,颞下回参与了需要对物体进行视觉识别的学习任务,对熟悉面孔的重复识别、视觉空间工作记忆和视觉心理想象尤其敏感[23]。颞下回区域的灰质萎缩在阿尔茨海默病中常见,这解释了颞下回参与高阶视觉处理的原因[24]。此外,颞下回在言语表达流畅性中也起重要作用,而部分VCI患者以语言表达困难为早期特征。
本研究中轻、重度组患者差异脑区还包含了海马。海马对学习、记忆和认知功能至关重要。海马位于颞叶深部,易受到缺血性损伤的影响。海马区的血液供应主要依赖大脑后动脉的侧支,颈动脉或大脑后动脉系统的血管闭塞可使海马供血中断,导致海马缺血和卒中后记忆功能受损[25-26]。因此,推测重度VCI患者海马区灰质体积减少可能是海马区缺血的进一步表现。补充运动区是除了颞叶与额下回等脑区之外另一处与语言产生任务密切相关的脑区,主要在默读词汇和区分语义等任务中被激活[27]。在一项关于帕金森病的脑影像研究中,帕金森病患者的轻度认知障碍与补充运动区及中央旁小叶的脑白质微观结构退变有关[28]。中央旁小叶属于跨脑区结构,是中央前回和中央后回的内侧延续。它是支配下肢运动和会阴部活动的重要功能区[29]。在一项与自杀行为有关的抑郁症研究中发现,右侧杏仁核与中央旁小叶之间的异常功能连接增加了患者自杀的风险[30]。结合这些研究结果,本研究中重度VCI患者中央旁小叶灰质的减低,暗示患者随病情加重而出现的肢体运动功能障碍和负性情绪的增加。本研究对差异脑区灰质体积与MoCA评分的相关性分析显示,所有患者灰质总体积及右侧海马区灰质体积均与MoCA评分存在相关性。这也提示VCI患者的认知功能障碍与特定脑区的灰质结构变化具有潜在关联,值得继续探索。
本研究存在的不足:仅通过VBM指标分析VCI患者的脑结构特征,而鉴别轻度和中度,以及中度和重度认知功能障碍的差异,可能需从更细致的结构影像学指标入手;未对认知功能障碍的具体领域进行分析,今后应进一步采用基于表面的形态学分析比较皮质厚度、曲率、表面积、脑沟深度等指标,以更精确地区分VCI患者的脑结构随认知功能障碍的变化;本研究现阶段未能纳入认知功能正常的健康同龄受试群体作为参照,这可能影响研究结论的推广。
总之,本研究初步探讨了VCI患者随认知障碍程度的加深而发生的脑实质结构变化特点,并从灰质体积差异的角度,为VCI的病程划分提供了神经影像学依据。
[参考文献]
[1] FLIER W M,SKOOG I,SCHNEIDER J A,et al. Vascular cognitive impairment[J]. Nat Rev Dis Primers,2018,4:18003.
[2] TANGALOS E G,PETERSEN R C. Mild cognitive impairment in geriatrics[J]. Clin Geriatr Med,2018,34(4):563-589.
[3] 中国医师协会神经内科分会认知障碍专业委员会,《中国血管性认知障碍诊治指南》编写组. 2019年中国血管性认知障碍诊治指南[J]. 中华医学杂志,2019,99(35):2737-2744.
[4] SACHDEV P,KALARIA R,OBRIEN J,et al. Diagnostic criteria for vascular cognitive disorders:a VASCOG statement[J]. Alzheimer Dis Assoc Disord,2014,28(3):206-218.
[5] SKROBOT O A,BLACK S E,CHEN C,et al. Progress toward standardized diagnosis of vascular cognitive impairment:guidelines from the vascular impairment of cognition classification consensus study[J]. Alzheimers Dement,2018,14(3):280-292.
[6] GRAFF-RADFORD J. Vascular cognitive impairment[J]. Continuum (Minneap Minn),2019,25(1):147-164.
[7] FRANTELLIZZI V,PANI A,RICCI M,et al. Neuroimaging in vascular cognitive impairment and dementia:a systematic review[J]. J Alzheimers Dis,2020,73(4):1279-1294.
[8] ASHBURNER J,FRISTON K J. Voxel-based morphometry--the methods[J]. Neuroimage,2000,11(6 Pt 1):805-821.
[9] 邹坤霞,杨骏,张庆萍,等. 基于体素的形态学分析技术在评价脑灰质体积改变对皮质下缺血性血管性痴呆患者执行功能影响中的应用[J]. 中国中西医结合影像学杂志,2021,19(1):37-42.
[10] FIRST M B. Diagnostic and statistical manual of mental disorders,5th edition,and clinical utility[J]. J Nerv Ment Dis,2013,201(9):727-729.
[11] NASREDDINE Z S,PHILLIPS N A,BEDIRIAN V,et al. The montreal cognitive assessment,MoCA:a brief screening tool for mild cognitive impairment[J]. J Am Geriatr Soc,2005,53(4):695-699.
[12] PINTO T,MACHADO L,BULGACOV T M,et al. Is the Montreal Cognitive Assessment (MoCA) screening superior to the Mini-Mental State Examination (MMSE) in the detection of mild cognitive impairment (MCI) and Alzheimers disease (AD) in the elderly?[J]. Int Psychogeriatr,2019,31(4):491-504.
[13] JIA X,WANG Z,HUANG F,et al. A comparison of the Mini-Mental State Examination (MMSE) with the Montreal Cognitive Assessment (MoCA) for mild cognitive impairment screening in Chinese middle-aged and older population:a cross-sectional study[J]. BMC Psychiatry,2021,21(1):485.
[14] CARSON N,LEACH L,MURPHY K J. A re-examination of Montreal Cognitive Assessment (MoCA) cutoff scores[J]. Int J Geriatr Psychiatry,2018,33(2):379-388.
[15] SHI D,CHEN X,LI Z. Diagnostic test accuracy of the Montreal Cognitive Assessment in the detection of post-stroke cognitive impairment under different stages and cutoffs:a systematic review and meta-analysis[J]. Neurol Sci,2018,39(4):705-716.
[16] 周曉亮,娄明武,吴武林,等. 基于fMRI的脑网络节点灵活度在血管性认知障碍患者中的研究[J]. 医学影像学杂志,2020,30(3):349-353.
[17] WANG Y,GUAN H,MA L,et al. Learning to read may help promote attention by increasing the volume of the left middle frontal gyrus and enhancing its connectivity to the ventral attention network[J]. Cereb Cortex,2023,33(5):2260-2272.
[18] SIERPOWSKA J,FERNANDEZ-COELLO A,GOMEZ-ANDRES A,et al. Involvement of the middle frontal gyrus in language switching as revealed by electrical stimulation mapping and functional magnetic resonance imaging in bilingual brain tumor patients[J]. Cortex,2018,99:78-92.
[19] LI A,YANG R,QU J,et al. Neural representation of phonological information during Chinese character reading[J]. Hum Brain Mapp,2022,43(13):4013-4029.
[20] GAO Z,GUO X,LIU C,et al. Right inferior frontal gyrus:an integrative hub in tonal bilinguals[J]. Hum Brain Mapp,2020,41(8):2152-2159.
[21] LIN Y,YOUNG I M,CONNER A K,et al. Anatomy and white matter connections of the inferior temporal gyrus[J]. World Neurosurgery,2020,143:e656-e666.
[22] ONITSUKA T,SHENTON M E,SALISBURY D F,et al. Middle and inferior temporal gyrus gray matter volume abnormalities in chronic schizophrenia:an MRI study[J]. Am J Psychiatry,2004,161(9):1603-1611.
[23] TAKAHASHI T,ZHOU S Y,NAKAMURA K,et al. A follow-up MRI study of the fusiform gyrus and middle and inferior temporal gyri in schizophrenia spectrum[J]. Prog Neuropsychopharmacol Biol Psychiatry,2011,35(8):1957-1964.
[24] SCHEFF S W,PRICE D A,SCHMITT F A,et al. Synaptic loss in the inferior temporal gyrus in mild cognitive impairment and Alzheimers disease[J]. J Alzheimers Dis,2011,24(3):547-557.
[25] YANG A C,VEST R T,KERN F,et al. A human brain vascular atlas reveals diverse mediators of Alzheimers risk[J]. Nature,2022,603(7903):885-892.
[26] JAROUDI W,GARAMI J,GARRIDO S,et al. Factors underlying cognitive decline in old age and Alzheimers disease:the role of the hippocampus[J]. Rev Neurosci,2017,28(7):705-714.
[27] CHOU Y H,SUNDMAN M,TON T V,et al. Cortical excitability and plasticity in Alzheimers disease and mild cognitive impairment:a systematic review and meta-analysis of transcranial magnetic stimulation studies[J]. Ageing Res Rev,2022,79:101660.
[28] BAI X,GUO T,CHEN J,et al. Microstructural but not macrostructural cortical degeneration occurs in Parkinsons disease with mild cognitive impairment[J]. NPJ Parkinsons Dis,2022,8(1):151.
[29] CHEN J,HUANG X,TANG Q,et al. Altered regional homogeneity in patients with diabetic erectile dysfunction:a resting-state fMRI study[J]. Front Endocrinol (Lausanne),2022,13:817523.
[30] ZHANG R,ZHANG L,WEI S,et al. Increased amyg- dala-paracentral lobule/precuneus functional connectivity associated with patients with mood disorder and suicidal behavior[J]. Front Hum Neurosci,2020,14:585664.
——以珠一坳陷惠州—陆丰地区古近系文昌组为例

