毕赤酵母外源蛋白分泌及折叠途径的改良进展
路泽群 刘宁 张红莲 王苑 黄火清

摘要:工业、农业和医药等领域常用的活性蛋白和工业酶大多数通过异源表达系统获得。毕赤酵母(Pichiapastoris)是优秀的外源蛋白表达宿主之一,以毕赤酵母为宿主的表达系统具有遗传稳定性好、翻译后修饰、蛋白表达和分泌水平高及生产成本低等优点,但在高效表达过程中外源蛋白过量聚集会导致目标蛋白不能正确折叠和有效分泌,从而影响蛋白表达水平。概述了通过信号肽优化、分子伴侣优化以及融合蛋白表达等分泌及折叠途径的改良,从而促进外源蛋白高效表达的研究进展。
关键词:毕赤酵母;分泌折叠途径;分泌信号肽;分子伴侣;融合表达
doi:10.13304/j.nykjdb.2023.0160
中图分类号:S182;TQ920.1 文献标志码:A 文章编号:10080864(2024)01001810
目前,在工业、农业和医学等领域所需要的活性蛋白大多通过外源蛋白表达系统获得。常用的外源蛋白表达系统包括微生物表达系统、植物细胞表达系统、昆虫细胞表达系统及哺乳动物细胞表达系统。微生物表达系统主要包括大肠杆菌表达系统、芽孢杆菌表达系统、酵母表达系统以及丝状真菌表达系统。相较于其他表达系统,微生物表达系统具有遗传操作便捷、生产周期短、培养基营养需求简单、蛋白表达水平高等优点[1]。其中,毕赤酵母(Pichia pastoris)表达系统还具有蛋白质分泌表达和蛋白翻译后修饰等优点[2],使其在外源蛋白的表达中备受青睐。
影响外源蛋白在毕赤酵母中高效表达的因素较多,常见的包括外源基因的转录水平、分泌信号肽(signal peptide,SP)的选择、外源蛋白的折叠和外源蛋白的稳定性。目前,针对外源基因转录水平的优化研究较多,可以通过优化外源基因密码子[3]、增加基因拷贝数和选择启动子来改善[4];而针对外源蛋白分泌及折叠途径的改良相对较少。毕赤酵母细胞外源蛋白分泌是被广泛报道的“内质网-高尔基体”蛋白分泌途径,此途径中新生肽链构象的维持和转运、蛋白的正确折叠和修饰是蛋白合成分泌的关键[56],可以优化改良表达载体及宿主来提高外源蛋白的表达。哺乳动物真核表达系统成本过高,原核表达系统没有翻译后修饰,近年来毕赤酵母表达系统因具有遗传稳定性好、翻译后修饰、蛋白表达和分泌水平高及生产成本低等优点,受到越来越多的关注。但该系统仍面临很多蛋白难以在其中高效表达的困境,其主要原因是在高效表达过程中外源蛋白过量聚集导致目标蛋白不能正确折叠和有效分泌,从而影响蛋白表达水平。研究者在改良蛋白质分泌和折叠途径方面已做了很多尝试,已经通过改良实现了大量难以表达的外源蛋白的高效表达。本文综述了近年来毕赤酵母外源蛋白分泌及折叠途径的改良进展,概述了包括分泌信号肽、分子伴侣以及融合表达在内的分泌和折叠途径优化以提高毕赤酵母外源蛋白表达的研究进展,为在毕赤酵母表达系统中实现更多外源蛋白的高效表达提供新的思路。
1 分泌信号肽优化
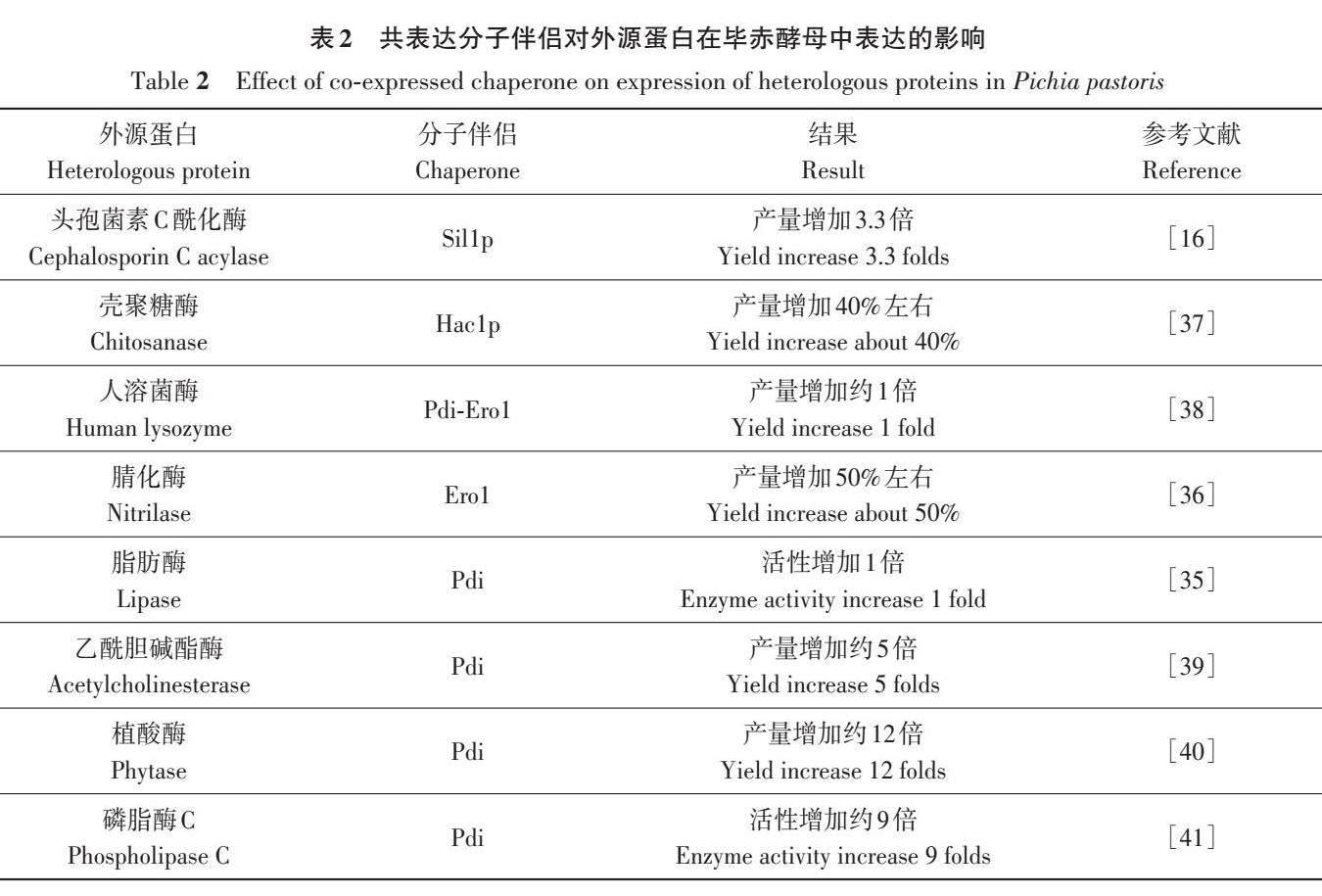
毕赤酵母自身分泌蛋白较少,外源蛋白分泌表达后易于纯化,其中分泌信号肽的选择和优化对于外源蛋白高效分泌到胞外至关重要(后续介绍的信号肽均为分泌信号肽)。在信号肽的选择中,首先需要关注外源蛋白的特性,部分蛋白可以在自身信号肽的引导下完成分泌表达,这些蛋白可以选择用自身的信号肽,而大部分蛋白需要外源分泌信号肽实现分泌表达。在毕赤酵母中表达时,外源蛋白可以利用信号肽分析软件分析其自身信号肽序列,大多数蛋白需要去除其自身分泌信号肽,使用毕赤酵母系统中常用的高效分泌信号肽[7-9]。毕赤酵母系统中使用的大多数信号肽是由18~30个氨基酸残基组成的肽段,一般将序列加在外源蛋白的N端。如果存在前导肽,会在其后带上毕赤酵母内源蛋白酶酶切位点,以便在外源蛋白成熟并被引导到囊泡的过程中被切除分离,而外源蛋白通过胞吐分泌至胞外[1011]。目前,毕赤酵母表达系统中常用的信号肽有酿酒酵母来源的α交配因子(α-mating factor,α-MF)信号肽、糖化酶信号肽STA1和蔗糖酶(sucrase 2,SUC2)信号肽,毕赤酵母本身的酸性磷酸酶(phosphatase1,PHO1;phosphatase5,PHO5)信号肽和絮凝因子(flocculation protein 10,FLO10)信号肽等[12]。近年来,越来越多的研究者尝试对现有信号肽进行改良和优化[13],或发掘新的信号肽[14]。Ito 等[15] 对α-MF信号肽的20个单氨基酸进行替换以探究其对外源蛋白分泌的影响,结果表明,α-MF信号肽中的8 个单氨基酸突变(V50A、V38A、G40D、L42S、L63S、L64S、F65S和I66T)与野生型α-MF信号肽相比,抗溶菌酶单链抗体的分泌水平显著增加(超过5倍)。Duan等[16]根据已报道的毕赤酵母的分泌组和基因组预测了4个毕赤酵母内源性信号肽(Dan4、Gas1、Msb2和Fre2),通过对3个蛋白的表达验证发现,4个内源信号肽序列的活性均高于酿酒酵母α-MF信号肽,其中Msb2信号肽提高了所有蛋白分泌表达水平(1.5~8.0倍),而Dan4对测试蛋白分泌表达水平的提升不如Msb2,但有效地增加了所有测试蛋白的总产量(胞内加胞外)。信号肽的选择和优化对外源蛋白在毕赤酵母中表达的影响见表1。
2 分子伴侣选择和优化
新生成的蛋白质肽链主要在内质网(endoplasmic reticulum,ER)进行加工和折叠,如果外源蛋白生成过快过多,远超过ER本身辅助折叠的能力,会导致大量蛋白错误折叠或未折叠,这些错误折叠或未折叠的蛋白大量聚集,会对细胞造成压力并触发未折叠蛋白反应(unfoldedprotein response,UPR)[23]。分子伴侣是一类能协助细胞内分子组装及蛋白质折叠的蛋白质,但其本身不成为最后功能结构中的组分。上调表达分子伴侣中的促折叠酶可以促进蛋白质正确折叠,降低ER中错误折叠蛋白质的水平,从而消除UPR 压力[24]。不能正确折叠的蛋白质最终会通过ER相关降解(endoplasmic reticulum-associated degradation,ERAD)途径降解。另外,当错误折叠或未折叠的蛋白质超过ER折叠能力时,也会出现反馈抑制促折叠蛋白的活性,增强ERAD途径,缓解系统的压力,过多蛋白质被ERAD途径降解会直接影响外源蛋白的表达水平[2526]。当外源基因在毕赤酵母内转录水平超过毕赤酵母本身的折叠能力时,过表达促折叠分子伴侣能很好地促进外源蛋白质的正确折叠,减少UPR压力,从而提高外源蛋白表达水平。Wang等[27]首先尝试增加基因拷贝数来提高壳聚糖酶的产量,发现在含4个壳聚糖酶基因时壳聚糖酶酶活性最高,继续增加基因拷贝数,酶活性反而降低,随后在含4个壳聚糖酶基因菌株中过表达组合分子伴侣Pdi/Ero1、Ssa4/Sse1 和Ydj1/Sso2,酶活性分别提高61%、31%、42%,最后构建了同时过表达6个分子伴侣的菌株,并在此基础上继续增加基因拷贝数来提高酶活性,使酶活性提高了约7倍。这就为优化外源基因在毕赤酵母中的高效表达提供了一种策略,通过过表达分子伴侣或其调节蛋白,提高外源蛋白质的折叠,降低ER的压力,从而促进外源蛋白的表达。
目前,在毕赤酵母系统中能促进外源蛋白表达水平的分子伴侣或调节蛋白主要有调节蛋白(Hac1)、二硫化物异构酶(protein disulfideisomerase,Pdi)、氧化还原酶1(endoplasmicreticulum oxidoreductin 1,Ero1)和重链结合蛋白(heavy-chain binding protein,Bip)等。其中,Hac1是能激活分子伴侣基因表达的转录因子,通过调节Hac1能间接增加伴侣蛋白表达,从而促进外源蛋白质的折叠和分泌[28]。Liu等[29]构建筛选获得了过表达Hac1 的菌株,发现利用该菌株作为宿主菌,能使人源溶菌酶的产量提高约20%,达到目前摇瓶发酵中的最高水平。Bip属于热休克蛋白70(heat shock proteins 70,HSP70)家族,主要功能是促进目的蛋白和其他分子伴侣结合[3031],Sallada等[32]通过在毕赤酵母中过表达Bip 使生物表面活性剂HFBI的表达量增加了大约20倍。Ero1能调节Pdi 的活性,而Pdi 主要催化二硫键形成[33]。Wang等[34]过表达Pdi,杜邦嗜热菌来源的脂肪酶表达量提高了1.46倍;Huang等[35]研究发现,过表达Pdi 使脂肪酶产量提高1 倍;Shen 等[36]通过过表达Ero1 提高了腈化酶的表达水平。研究表明,过表达与蛋白质折叠相关的分子伴侣可以提高重组蛋白在毕赤酵母中的表达水平或蛋白活性(表2),但分子伴侣的选择由目的蛋白的性质决定。
分子伴侣中最大的一类是热休克蛋白(heatshock proteins,HSP)家族,根据其分子量大小,大致将热休克蛋白分为HSP90、HSP70、HSP60、HSP40 和小分子热休克蛋白(small heat shockproteins,sHSP)。热休克蛋白发挥功能需要具有其他功能(结合目的蛋白、运输目的蛋白)的分子伴侣,各个家族之间共同协作蛋白质的折叠与运输[42]。毕赤酵母源的Ssa1和酿酒酵母源Sis1伴侣蛋白属于HSP40家族,能帮助新生肽链维持正确构象 [43]。Deng等[44]在毕赤酵母中过表达了Ssa1-Sis1 组合伴侣,显著提高了可溶性猪生长激素(pGH)蛋白的产量,达到70 mg·L-1。Ydi1p(HSP40家族)和Sec63(辅助分子伴侣)均是分泌蛋白在跨膜易位过程中的关键伴侣蛋白[4546]。
Zhang等[47]过表达了Ydj1p和Sec63的组合伴侣,使重组激素蛋白G-CSF的产量提高了7.6倍。上述研究表明,HSP家族的分子伴侣及其辅助分子伴侣能促进外源蛋白的表达。哺乳动物细胞作为高等真核细胞,其分子伴侣系统更加完善,可以用来表达医药领域所需要的活性蛋白,但其成本高、操作难度大,难以实现产业化。而这些活性蛋白结构复杂、稳定性差,使其在毕赤酵母表达系统中难以表达[48],因此可以借助高等真核细胞来源的分子伴侣帮助其在毕赤酵母中表达。此外,毕赤酵母中大部分的分子伴侣在哺乳动物中有功能同源物,如酵母源Sec63与人源SEC63有53% 的同源性[49],酵母源Sis1 和人源DNAJB6 是功能同源物[50]。Bankefa等[51]比较了毕赤酵母、酿酒酵母、里氏木霉和人源的Hac1p 同源物PpHac1p、ScHac1p、TrHac1p 和HsXbp1 对毕赤酵母外源蛋白表达的影响,发现过表达HsXbp1 使β-甘露聚糖酶产量提高48.6%,而过表达其余3种Hac1p 同源物对β-甘露聚糖酶产量无明显影响。因此,高等真核细胞来源的促折叠因子能促进外源蛋白在毕赤酵母中的表达,可以尝试将其导入毕赤酵母表达系统,帮助活性蛋白表达。
3 融合表达技术
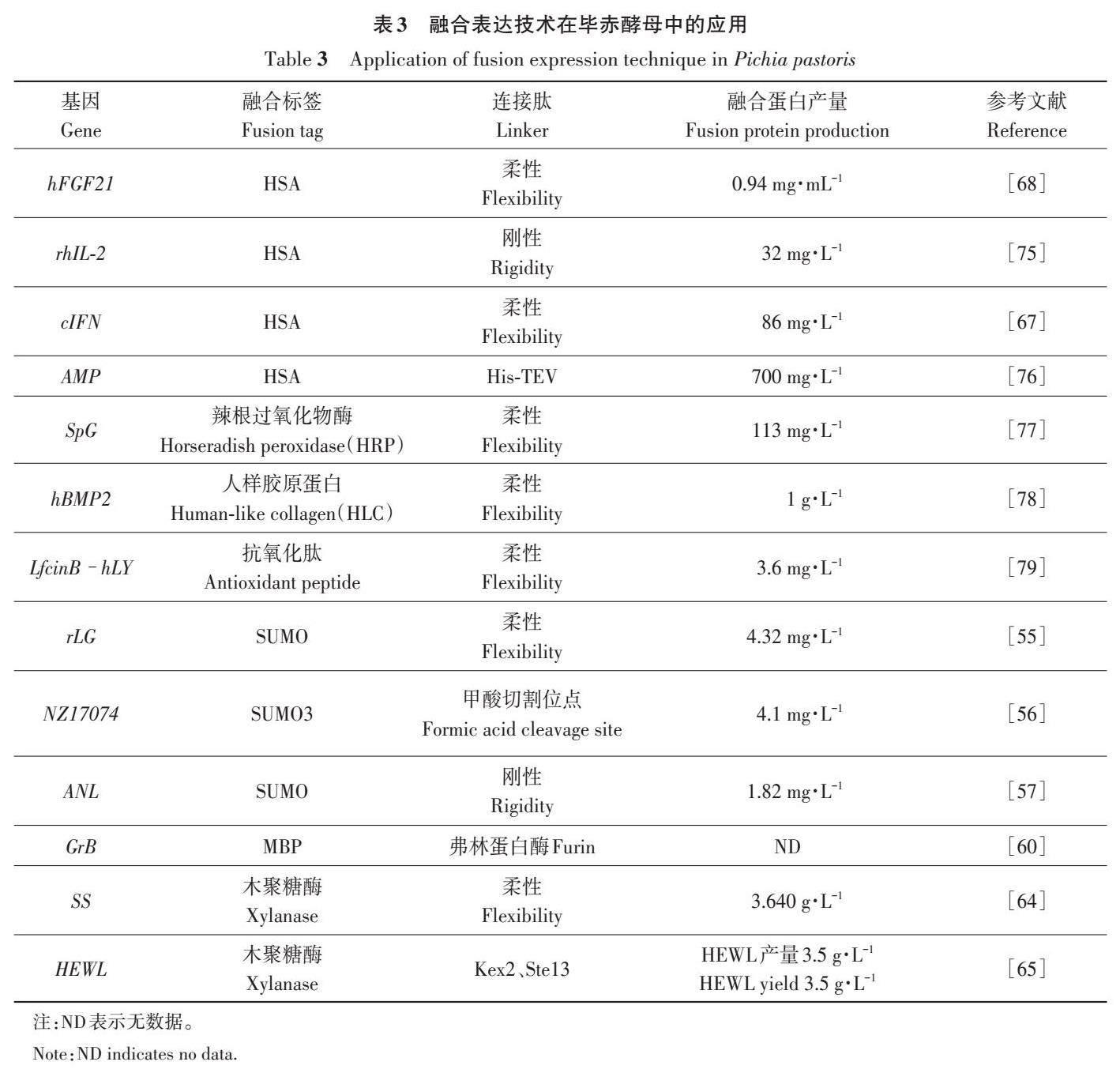
融合表达技术是大肠杆菌表达系统常用的一种促进蛋白可溶性表达的策略,融合蛋白能帮助目标蛋白正确折叠以降低外源蛋白对宿主细胞的压力,能促进外源蛋白的可溶表达,从而增加外源蛋白的表达量。目前在大肠杆菌中常用的融合标签包括麦芽糖结合蛋白(maltose binding protein,MBP)、谷胱甘肽-S-转移酶(glutathione S-transferase,GST)、小泛素相关修饰物(small ubiquitin-related modifier protein,SUMO)、硫氧还蛋白(thioredoxin,Trx)、肝片虫8 kD 抗原(fasciola hepatica 8kDantigen,Fh8)和N-Utilization substance A(NusA)等。但融合标签的存在可能会影响蛋白质本身的活性,所以在设计融合蛋白时需要根据外源蛋白的性质考虑后续融合标签切除的问题[52]。融合表达技术在毕赤酵母中的应用不如在大肠杆菌中广泛,但近几年受到的关注越来越多,下文对毕赤酵母系统中应用到的融合表达策略进行概述,部分融合表达技术在毕赤酵母中的应用见表3。
3.1 小泛素相关修饰物
SUMO(11.6 kD)是泛素相关蛋白家族的成员,具有调节蛋白的结构功能、提高融合蛋白的表达量、促进靶蛋白正确折叠、提高重组蛋白可溶性等作用[53]。融合表达后可以使用特定的SUMO蛋白酶将其从融合蛋白上切割分离,不影响目的蛋白的活性[54]。Zhan 等[55]对抗菌肽LL37 活性中心氨基酸进行了置换,并和6×His-SUMO 标签结合,成功表达了融合蛋白,标签切割后具有很强的抗菌活性。Wang 等[56]使用人源SUMO3 与抗菌肽NZ17074融合表达,并通过去除融合标签,首次在毕赤酵母中高水平发酵得到具有抑菌活性的抗菌肽NZ17074,产量达到4.1 mg·L-1。Zhang 等[57]将黑曲霉来源的酸性脂肪酶(acidic lipase fromAspergillus niger,ANL)与SUMO融合表达,成功获得其融合蛋白SANL,融合蛋白不需要切割就具有ANL活性,活性比母体ANL高1.85倍,且融合蛋白对胃蛋白酶具有抗性,在pH 3.0~6.0时对三油酸甘油酯具有高水解活性。上述研究表明,在毕赤酵母中采用SUMO 标签与外源蛋白融合策略,能促进目标蛋白的表达,甚至增强了某些蛋白的生物活性。
3.2 麦芽糖结合蛋白
麦芽糖结合蛋白(MBP,42 kD)是最常用的融合标签之一,可增强目标蛋白的可溶性,并具有类似分子伴侣的功能,同时它被认为可与未折叠蛋白中的疏水性氨基酸残基相互作用,以防止蛋白质聚集或水解[58]。已有研究表明,MBP可以增强毕赤酵母中外源蛋白的分泌,MBP在融合蛋白中的位置会调节毕赤酵母分泌途径[59]。D?lken等[60]将人源颗粒酶B(GrB)与MBP 融合表达,并在二者之间加入酵母内源性蛋白酶识别序列,结果在培养上清液中检测到单独的MBP和GrB,MBP的融合显著提高了分泌到培养上清液中的GrB 含量,且GrB具有正常活性。
3.3 木聚糖酶
木聚糖酶是水解酶家族的一员,能够降解植物细胞壁中的木聚糖,在食品、农业、纺织业和工业等生产中都有广泛应用[61],目前木聚糖酶能够在多个微生物表达系统中稳定高效表达[18,6263]。瘤胃真菌Neocallimastix patriciarum 来源的木聚糖酶富含酸性氨基酸,是优质的融合标签选择对象,且在毕赤酵母系统中的表达水平很高。Huang等[64]将木聚糖酶XynCDBFV作为融合标签与生长抑素融合表达,成功表达出了具有双功能的融合蛋白,既有生长抑素的活性,又具备木聚糖酶的活性。Cui等[65]将木聚糖酶XynCDBFV作为融合标签与鸡蛋清溶菌酶(hen egg white lysozyme,HEWL)融合表达,并在二者间加入包含内源性蛋白酶识别位点的序列,成功表达了HEWL,产量达到3.5 g·L-1,活性达到1.5×105 U·L-1,是目前重组表达的最高水平。上述研究表明,木聚糖酶作为融合标签的策略可以有效提高一些难表达蛋白的产量。
3.4 人血清白蛋白
人血清白蛋白(human serum albumin,HSA)半衰期长、免疫功能少,在不切割的情况下一般不影响目的蛋白的特性,是一种优秀的融合标签,通常与一些医药蛋白融合表达,可改善重组医药蛋白的生物活性[66]。Naseem 等[67]将HSA 和干扰素在毕赤酵母中融合表达,得到了具有生物活性的融合蛋白(86 mg·L-1),且延长了干扰素的半衰期;黄甜甜等[68]将HSA和人成纤维细胞生长因子在毕赤酵母中融合表达,得到了具有生物活性的融合蛋白(0.94 mg·mL-1),且使人成纤维细胞生长因子的半衰期延长了27.6 倍。上述研究表明,HSA作为融合标签能帮助蛋白的表达,更能延长部分医药蛋白的半衰期,是医药蛋白在毕赤酵母中表达的优质融合标签选择对象。关于HSA作为融合标签在毕赤酵母中融合表达的应用见表3。
3.5 连接肽
在融合表达技术的应用中,因目的蛋白和融合标签的不同特性,二者之间的连接肽(linker)可能对表达水平产生不同的影响,因此linker的选择也十分重要。Linker主要包括柔性linker和刚性linker。柔性linker 通常由甘氨酸与丝氨酸或苏氨酸组成,通过保持功能性蛋白质之间的距离来发挥作用;刚性linker 通常由谷氨酸、丙氨酸和赖氨酸组成,能准确分割功能域,方便增加伴侣蛋白之间的安全距离[69]。重组融合蛋白一般是以融合标签-目的蛋白结合在一起的形式表达,这种形式可能会因为融合标签的存在影响目的蛋白的活性,因此,可以在linker后加入一段特定序列,使融合标签能够和目的蛋白分离,这段序列通常选择能够被特定蛋白酶识别的位点[69]。毕赤酵母本身会分泌一些能识别特定位点的蛋白酶[70],因此可以选择毕赤酵母内源性蛋白酶,例如Kex2[71]和STE13[72],也可以选择一些外源特异性蛋白酶,例如肠激酶(enterokinase,EK)[73]和烟草蚀纹病毒(tobacco etch virus,TEV)蛋白酶[74]。
4 结 语
毕赤酵母表达系统经过几十年的发展逐渐成熟,已经实现了千余种外源蛋白的表达,但目前仍有很多蛋白未能在其中实现高效表达,因此仍有改良的空间。信号肽在毕赤酵母表达系统的外源蛋白分泌过程中扮演了重要角色,使用外源蛋白本身的信号肽往往不能达到很高的分泌表达水平,目前主要是利用毕赤酵母中常用的高效分泌信号肽来实现外源蛋白的高效分泌[80]。伴随毕赤酵母基因组测序完成,其自身越来越多的信号肽被发现,有些已经验证对外源蛋白分泌有良好的效果,后续根据目的蛋白的性质,可以有选择的利用信号肽,并对其进行改造优化以提高目的蛋白的产量。目的蛋白在合适信号肽引导下经过正确途径分泌表达,可能会由于转录水平较高,导致大量蛋白在内质网积压无法正确折叠,共表达分子伴侣是解决该问题的一个良好策略 [81]。目前,分子伴侣在外源蛋白折叠过程中的作用已被确证,但作用机制尚不清楚,主要是通过大量的尝试来验证各个分子伴侣对外源蛋白表达的影响,未来可以聚焦分子伴侣的协同作用机制,更有针对性地理性改造分子伴侣系统,最终实现更多外源蛋白的高效表达。部分蛋白在分泌表达后不稳定,会被降解,利用融合表达技术可以提高其稳定性,从而促进外源蛋白的高效表达[67],目前该技术在毕赤酵母表达系统中的应用还不广泛,但已经显现良好的效果,部分外源蛋白已经通过该技术达到了较高的产量,未来随着融合标签的丰富,可以有更多的选择来实现难表达的外源蛋白在毕赤酵母系统的高效表达。
参 考 文 献
[1] KARBALAEI M, REZAEE S A, FARSIANI H. Pichia pastoris:a highly successful expression system for optimal synthesis ofheterologous proteins [J]. J. Cell. Physiol., 2020, 235(9): 5867-5881.
[2] AHMAD M, HIRZ M, PICHLER H, et al .. Protein expressionin Pichia pastoris: recent achievements and perspectives forheterologous protein production [J]. Appl. Microbiol. Biotechnol.,2014, 98(12): 5301-5317.
[3] WANG Y, JIANG S, JIANG X, et al .. Cloning and codonoptimization of a novel feline interferon omega gene forproduction by Pichia pastoris and its antiviral efficacy inpolyethylene glycol-modified form [J]. Virulence, 2022, 13(1):297-309.
[4] CHE Z, CAO X, CHEN G, et al .. An effective combination ofcodon optimization, gene dosage, and process optimization forhigh-level production of fibrinolytic enzyme in Komagataellaphaffii (Pichia pastoris) [J/OL]. BMC Biotechnol., 2020, 20(1):63 [2023-02-06]. https://doi.org/10.1186/s12896-020-00654-7.
[5] LEE M C, MILLER E A, GOLDBERG J, et al .. Bi-directionalprotein transport between the ER and Golgi [J]. Annu. Rev.Cell Dev. Biol., 2004, 20: 87-123.
[6] 张伟,刘志敏,陈惠鹏.酵母蛋白分泌途径的研究进展[J].生物技术通讯, 2006,17(1): 81-83.
ZHANG W, LIU Z M, CHEN H P. Advance in secretorypathway of yeast [J]. Lett. Biotechnol., 2006,17(1): 81-83.
[7] ALMAGRO ARMENTEROS J J, TSIRIGOS K D, S?NDERBYC K, et al .. SignalP 5.0 improves signal peptide predictionsusing deep neural networks [J]. Nat. Biotechnol., 2019, 37(4):420-423.
[8] BAGOS P G, NIKOLAOU E P, LIAKOPOULOS T D, et al ..Combined prediction of Tat and Sec signal peptides withhidden Markov models [J]. Bioinformatics, 2010, 26(22): 2811-2817.
[9] KATO T, SHIONO Y, KOSEKI T. Identification andcharacterization of an acetyl xylan esterase from Aspergillusoryzae [J]. J. Biosci. Bioeng., 2021, 132(4): 337-342.
[10] OWJI H, NEZAFAT N, NEGAHDARIPOUR M, et al .. Acomprehensive review of signal peptides: structure, roles, andapplications [J]. Eur. J. Cell Biol., 2018, 97(6): 422-441.
[11] FREUDL R. Signal peptides for recombinant protein secretionin bacterial expression systems [J/OL]. Microb. Cell Fact.,2018, 17(1): 52 [2023-02-06]. https://doi.org/10.1186/s12934-018-0901-3.
[12] KANG Z, HUANG H, ZHANG Y, et al .. Recent advances ofmolecular toolbox construction expand Pichia pastoris insynthetic biology applications [J/OL]. World J. Microbiol.Biotechnol., 2016, 33(1): 19 [2023-02-06]. https://doi.org/10.1007/s11274-016-2185-2.
[13] 梁启星,石竟成,金学荣,等.肠激酶在毕赤酵母中的分泌表达优化[J].生物工程学报, 2020, 36(8): 1689-1698.
LIANG Q X, SHI J C, JIN X R, et al .. Optimization ofenterokinase secretion in Pichia pastoris [J]. Chin. J. Biotech.,2020, 36(8):1689-1698.
[14] SHEN Q, ZHOU X T, GUO Q, et al .. Potential of the signalpeptide derived from the PAS_chr3_0030 gene product forsecretory expression of valuable enzymes in Pichia pastoris [J/OL].Appl. Environ. Microbiol., 2022, 88(9): e0029622 [2023-02-06]. https://doi.org/10.1128/aem.00296-22.
[15] ITO Y, ISHIGAMI M, HASHIBA N, et al .. Avoiding entry intointracellular protein degradation pathways by signal mutationsincreases protein secretion in Pichia pastoris [J]. Microb.Biotechnol., 2022, 15(9): 2364-2378.
[16] DUAN G, DING L, WEI D, et al .. Screening endogenous signalpeptides and protein folding factors to promote the secretoryexpression of heterologous proteins in Pichia pastoris [J]. J.Biotechnol., 2019, 306: 193-202.
[17] LI D, WU J, CHEN J, et al .. Optimized expression of classicalswine fever virus E2 protein via combined strategy in Pichiapastoris [J/OL]. Protein Expr. Purif., 2020, 167: 105527 [2023-02-06]. https://doi.org/10.1016/j.pep.2019.105527.
[18] MIAO T, BASIT A, LIU J, et al .. Improved production ofxylanase in Pichia pastoris and its application in xylose productionfrom xylan [J/OL]. Front. Bioeng. Biotechnol., 2021, 9: 690702[2023-02-06]. https://doi.org/10.3389/fbioe.2021.690702.
[19] RIEDER L, EBNER K, GLIEDER A, et al .. Novel molecularbiological tools for the efficient expression of fungal lyticpolysaccharide monooxygenases in Pichia pastoris [J/OL].Biotechnol. Biofuels, 2021, 14(1): 122 [2023-02-06]. https://doi.org/10.1186/s13068-021-01971-5.
[20] BARRERO J J, CASLER J C, VALERO F, et al .. An improvedsecretion signal enhances the secretion of model proteins fromPichia pastoris [J/OL]. Microb. Cell Fact., 2018, 17(1): 161[2023-02-06]. https://doi.org/10.1186/s12934-018-1009-5.
[21] AGGARWAL S, MISHRA S. Differential role of segments ofα-mating factor secretion signal in Pichia pastoris towardsgranulocyte colony-stimulating factor emerging from a wildtype or codon optimized copy of the gene [J/OL]. Microb. CellFact., 2020, 19(1): 199 [2023-02-06]. https://doi.org/10.1186/s12934-020-01460-8.
[22] AGGARWAL S, MISHRA S. Modifications in the Kex2 P1'cleavage site in the α -MAT secretion signal lead to higherproduction of human granulocyte colony-stimulating factor inPichia pastoris [J/OL]. World J. Microbiol. Biotechnol., 2021,37(11): 197[2023-02-06]. https://doi.org/10.1007/s11274-021-03167-3.
[23] GRAF A, GASSER B, DRAGOSITS M, et al .. Novel insightsinto the unfolded protein response using Pichia pastorisspecific DNA microarrays [J/OL]. BMC Genomics, 2008, 9:390 [2023-02-06]. https://doi.org/10.1186/1471-2164-9-390.
[24] VOGL T, THALLINGER G G, ZELLNIG G, et al .. Towardsimproved membrane protein production in Pichia pastoris: generaland specific transcriptional response to membrane proteinoverexpression [J]. New Biotechnol., 2014, 31(6): 538-552.
[25] RASCHMANOV? H, WENINGER A, KNEJZL?K Z, et al ..Engineering of the unfolded protein response pathway inPichia pastoris: enhancing production of secreted recombinantproteins [J]. Appl. Microbiol. Biotechnol., 2021, 105(11): 4397-4414.
[26] MOILANEN A, RUDDOCK L W. Non-native proteins inhibitthe ER oxidoreductin 1 (Ero1) -protein disulfide-isomeraserelay when protein folding capacity is exceeded [J]. J. Biol.Chem., 2020, 295(26): 8647-8655.
[27] WANG Y, LUO X, ZHAO Y, et al .. Integrated strategies forenhancing the expression of the AqCoA chitosanase in Pichiapastoris by combined optimization of molecular chaperonescombinations and copy numbers via a novel plasmid pMC-GAP [J].Appl. Biochem. Biotechnol., 2021, 193(12): 4035-4051.
[28] BACK S H, SCHR?DER M, LEE K, et al .. ER stress signalingby regulated splicing: IRE1/HAC1/XBP1 [J]. Methods, 2005,35(4): 395-416.
[29] LIU J, HAN Q, CHENG Q, et al .. Efficient expression ofhuman lysozyme through the increased gene dosage and coexpressionof transcription factor Hac1p in Pichia pastoris [J].Curr. Microbiol., 2020, 77(5): 846-854.
[30] HUANG B, SUN M, HOXIE R, et al .. The endoplasmicreticulum chaperone BiP is a closure-accelerating cochaperoneof Grp94 [J/OL]. Proc. Natl. Acad. Sci. USA, 2022, 119(5):e2118793119 [2023-02-06]. https://doi.org/10.1073/pnas.2118793119.
[31] POBRE K F R, POET G J, HENDERSHOT L M. Theendoplasmic reticulum (ER) chaperone BiP is a masterregulator of ER functions: getting by with a little help fromERdj friends [J]. J. Biol. Chem., 2019, 294(6): 2098-2108.
[32] SALLADA N D, HARKINS L E, BERGER B W. Effect of genecopy number and chaperone coexpression on recombinanthydrophobin HFBI biosurfactant production in Pichia pastoris [J].Biotechnol. Bioeng., 2019, 116(8): 2029-2040.
[33] ZITO E. ERO1: a protein disulfide oxidase and H2O2 producer[J]. Free Radic Biol. Med., 2015, 83: 299-304.
[34] WANG J, WU Z, ZHANG T, et al .. High-level expression ofThermomyces dupontii thermophilic lipase in Pichia pastorisvia combined strategies [J/OL]. 3 Biotech., 2019, 9(2): 62[2023-02-06]. https://doi.org/10.1007/s13205-019-1597-8.
[35] HUANG J, ZHAO Q, CHEN L, et al .. Improved production ofrecombinant Rhizomucor miehei lipase by coexpressing proteinfolding chaperones in Pichia pastoris, which triggered ER stress [J].Bioengineered, 2020, 11(1): 375-385.
[36] SHEN Q, YU Z, LYU P J, et al .. Engineering a Pichia pastorisnitrilase whole cell catalyst through the increased nitrilasegene copy number and co-expressing of ER oxidoreductin 1 [J].Appl. Microbiol. Biotechnol., 2020, 104(6): 2489-2500.
[37] HAN M, WANG W, GONG X, et al .. Increased expression ofrecombinant chitosanase by co-expression of Hac1p in theyeast Pichia pastoris [J]. Protein Pept. Lett., 2021, 28(12):1434-1441.
[38] HE H, WU S, MEI M, et al.. A combinational strategy for effectiveheterologous production of functional human lysozyme in Pichiapastoris [J/OL]. Front. Bioeng. Biotechnol., 2020, 8: 118 [2023-02-06]. https://doi.org/10.3389/fbioe.2020.00118.
[39] LI J, CAI J, MA M, et al .. Preparation of a Bombyx moriacetylcholinesterase enzyme reagent through chaperone proteindisulfide isomerase co-expression strategy in Pichia pastoris fordetection of pesticides [J/OL]. Enzyme Microb. Technol., 2021,144: 109741 [2023-02-06]. https://doi.org/10.1016/j.enzmictec.2020.109741.
[40] NAVONE L, VOGL T, LUANGTHONGKAM P, et al ..Disulfide bond engineering of AppA phytase for increasedthermostability requires co-expression of protein disulfideisomerase in Pichia pastoris [J/OL]. Biotechnol. Biofuels, 2021,14(1): 80 [2023-02-06]. https://doi.org/10.1186/s13068-021-01936-8.
[41] WANG L, HU T, JIANG Z, et al .. Efficient production of anovel alkaline cold-active phospholipase C from Aspergillusoryzae by molecular chaperon co-expression for crude oildegumming [J/OL]. Food Chem., 2021, 350: 129212 [2023-02-06]. https://doi.org/10.1016/j.foodchem.2021.129212.
[42] FREILICH R, ARHAR T, ABRAMS J L, et al .. Protein-proteininteractions in the molecular chaperone network [J]. Acc.Chem. Res., 2018, 51(4): 940-949.
[43] ZININGA T, RAMATSUI L, SHONHAI A. Heat shock proteinsas immunomodulants [J/OL]. Molecules, 2018, 23(11): 2846[2023-02-06]. https://doi.org/10.3390/molecules23112846.
[44] DENG J, LI J, MA M, et al .. Co-expressing GroEL-GroES,Ssa1-Sis1 and Bip-PDI chaperones for enhanced intracellularproduction and partial-wall breaking improved stability ofporcine growth hormone [J/OL]. Microb. Cell Fact., 2020, 19(1): 35[2023-02-06]. https://doi.org/10.1186/s12934-020-01304-5.
[45] JUNG S J, KIM H. Emerging view on the molecular functions of Sec62 and Sec63 in protein translocation [J/OL]. Int. J. Mol.Sci., 2021, 22(23): 12757 [2023-02-06]. https://doi.org/10.3390/ijms222312757.
[46] CAPLAN A J, CYR D M, DOUGLAS M G. Ydj1p facilitatespolypeptide translocation across different intracellular membranesby a conserved mechanism [J]. Cell, 1992, 71(7): 1143-1155.
[47] ZHANG W, ZHAO H L, XUE C, et al .. Enhanced secretion ofheterologous proteins in Pichia pastoris following overexpression ofSaccharomyces cerevisiae chaperone proteins [J]. Biotechnol. Prog.,2006, 22(4): 1090-1095.
[48] KESIK-BRODACKA M. Progress in biopharmaceuticaldevelopment [J]. Biotechnol. Appl. Biochem., 2018, 65(3):306-322.
[49] SKOWRONEK M H, ROTTER M, HAAS I G. Molecularcharacterization of a novel mammalian DnaJ-like Sec63phomolog [J]. Biol. Chem., 1999, 380(9): 1133-1138.
[50] BHADRA A K, RAU M J, DAW J A, et al .. Disease-associatedmutations within the yeast DNAJB6 homolog Sis1 slowconformer-specific substrate processing and can be correctedby the modulation of nucleotide exchange factors [J/OL]. Nat.Commun., 2022, 13(1): 4570 [2023-02-06]. https://doi.org/10.1038/s41467-022-32318-9.
[51] BANKEFA O E, WANG M, ZHU T, et al .. Hac1p homologuesfrom higher eukaryotes can improve the secretion of heterologousproteins in the yeast Pichia pastoris [J]. Biotechnol. Lett., 2018, 40(7): 1149-1156.
[52] KI M R, PACK S P. Fusion tags to enhance heterologousprotein expression [J]. Appl. Microbiol. Biotechnol., 2020, 104(6): 2411-2425.
[53] PANAVAS T, SANDERS C, BUTT T R. SUMO fusiontechnology for enhanced protein production in prokaryotic andeukaryotic expression systems [J]. Methods Mol. Biol., 2009,497: 303-317.
[54] YAU T Y, SANDER W, EIDSON C, et al .. SUMO Interactingmotifs: structure and function [J/OL]. Cells, 2021, 10(11): 2825[2023-02-06]. https://doi.org/10.3390/cells10112825.
[55] ZHAN N, ZHANG L, YANG H, et al .. Design and heterologousexpression of a novel dimeric LL37 variant in Pichia pastoris [J/OL].Microb. Cell Fact., 2021, 20(1): 143 [2023-02-06]. https://doi.org/10.1186/s12934-021-01635-x.
[56] WANG X J, WANG X M, TENG D, et al .. Recombinantproduction of the antimicrobial peptide NZ17074 in Pichiapastoris using SUMO3 as a fusion partner [J]. Lett. Appl.Microbiol., 2014, 59(1): 71-78.
[57] ZHANG X F, AI Y H, XU Y, et al .. High-level expression ofAspergillus niger lipase in Pichia pastoris: characterization andgastric digestion in vitro [J]. Food Chem., 2019, 274: 305-313.
[58] LI Z, LEUNG W, YON A, et al .. Secretion and proteolysis ofheterologous proteins fused to the Escherichia coli maltosebinding protein in Pichia pastoris [J]. Protein Expr. Purif.,2010, 72(1): 113-124.
[59] MOUA P S, GONZALEZ A, OSHIRO K T, et al .. Differentialsecretion pathways of proteins fused to the Escherichia colimaltose binding protein (MBP) in Pichia pastoris [J/OL].Protein Expr. Purif., 2016, 124: 005 [2023-02-06]. https://doi.org/10.1016/j.pep.2016.04.005.
[60] D?LKEN B, JABULOWSKY R A, OBEROI P, et al .. Maltosebindingprotein enhances secretion of recombinant humangranzyme B accompanied by in vivo processing of a precursorMBP fusion protein [J/OL]. PLoS One, 2010, 5(12): e14404[2023-02-06]. https://doi.org/10.1371/journal.pone.0014404.
[61] SOHAIL M, BARZKAR N, MICHAUD P, et al .. Cellulolyticand xylanolytic enzymes from yeasts: properties and industrialapplications [J/OL]. Molecules, 2022, 27(12): 3783 [2023-02-06]. https://doi.org/10.3390/molecules27123783.
[62] LI Y, ZHANG X, LU C, et al .. Identification andcharacterization of a novel endo-β-1,4-xylanase from Streptomycessp. T7 and its application in xylo-oligosaccharide production[J/OL]. Molecules, 2022, 27(8): 2516 [2023-02-06]. https://doi.org/10.3390/molecules27082516.
[63] TALENS-PERALES D, NICOLAU-SANUS M, POLAINA J,et al .. Expression of an extremophilic xylanase in Nicotianabenthamiana and its use for the production of prebioticxylooligosaccharides [J/OL]. Sci. Rep., 2022, 12(1): 15743[2023-02-06]. https://doi.org/10.1038/s41598-022-19774-5.
[64] HUANG K, CHU Y, QIN X, et al .. Recombinant production oftwo xylanase-somatostatin fusion proteins retaining somatostatinimmunogenicity and xylanase activity in Pichia pastoris [J]. Appl.Microbiol. Biotechnol., 2021, 105(10): 4167-4175.
[65] CUI L, HUANG H, ZHANG H, et al .. Recombinant expressionof hen egg white lysozyme with the assistance of xylanasefusion partner in Pichia pastoris [J]. Bioengineered, 2022, 13(5):13860-13871.
[66] KRATZ F. Albumin as a drug carrier: design of prodrugs, drugconjugates and nanoparticles [J]. J. Control. Release, 2008, 132(3):171-183.
[67] NASEEM M U, AHMED N, KHAN M A, et al .. Production ofpotent long-lasting consensus interferon using albumin fusiontechnology in Pichia pastoris expression system [J/OL]. ProteinExpr. Purif., 2020, 166: 105509 [2023-02-06]. https://doi.org/10.1016/j.pep.2019.105509.
[68] 黄甜甜,齐剑英,杨刚刚,等.重组rHSA-hFGF21融合蛋白在毕赤酵母中的表达纯化及活性分析[J]. 生物工程学报,2022, 38(9): 3419-3432.
HUANG T T, QI J Y, YANG G G, et al .. Expression,purification and bioactivity analysis of a recombinant fusionprotein rHSA-hFGF21 in Pichia pastoris [J]. Chin. J. Biotech.,2022, 38(9): 3419-3432.
[69] PATEL D K, MENON D V, PATEL D H, et al .. Linkers: asynergistic way for the synthesis of chimeric proteins [J/OL].Protein Expr. Purif., 2022, 191: 106012 [2023-02-06]. https://doi.org/10.1016/j.pep.2021.106012.
[70] JONES E W. The synthesis and function of proteases inSaccharomyces: genetic approaches [J]. Annu. Rev. Genet.,1984, 18: 233-270.
[71] KIM M J, SUNG B H, KIM H J, et al .. Production of autolysisproofKex2 protease from Candida albicans in Saccharomycescerevisiae for in vitro processing of fusion proteins [J]. Appl.Microbiol. Biotechnol., 2022, 106(21): 7063-7072.
[72] LI X, FAN Y, LIN Q, et al .. Expression of chromogranin A- derived antifungal peptide CGA-N12 in Pichia pastoris [J].Bioengineered, 2020, 11(1): 318-327.
[73] KUBITZKI T, NOLL T, L?TZ S. Immobilisation of bovineenterokinase and application of the immobilised enzyme infusion protein cleavage [J]. Bioprocess Biosyst. Eng., 2008, 31(3):173-182.
[74] RARAN-KURUSSI S, CHERRY S, ZHANG D, et al .. Removalof affinity tags with TEV protease [J]. Methods Mol. Biol.,2017, 1586: 221-230.
[75] GUAN B, CHEN F, LEI J, et al .. Constitutive expression of arhIL-2-HSA fusion protein in Pichia pastoris using glucose ascarbon source [J]. Appl. Biochem. Biotechnol., 2013, 171(7):1792-1804.
[76] CAO J, DE LA FUENTE-NUNEZ C, OU R W, et al .. Yeastbasedsynthetic biology platform for antimicrobial peptideproduction [J]. ACS Synth. Biol., 2018, 7(3): 896-902.
[77] KRAINER F W, DARNHOFER B, BIRNER-GRUENBERGERR, et al.. Recombinant production of a peroxidase-protein Gfusion protein in Pichia pastoris [J]. J. Biotechnol., 2016, 219:24-27.
[78] CHEN Z, ZHANG Z, WANG Z, et al .. Fabricating a novelHLC-hBMP2 fusion protein for the treatment of bone defects [J]. J.Control. Release, 2021, 329: 270-285.
[79] SUN J, JIANG J, LIU L, et al .. Expression of the hybridantimicrobial peptide lactoferrin-lysozyme in Pichia pastoris [J].Biotechnol. Appl. Biochem., 2019, 66(2): 202-208.
[80] INGRAM Z, PATKAR A, OH D, et al .. Overcoming obstaclesin protein expression in the yeast Pichia pastoris: interviews ofleaders in the Pichia field [J/OL]. Pac. J. Health (Stockton,Calif.), 2021, 4(1): 2[2023-02-06]. https://doi.org/10.56031/2576-215x.1010.
[81] GARVEY M . Non-mammalian eukaryotic expression systemsyeast and fungi in the production of biologics [J/OL]. J. Fungi,2022, 8(11):1179 [2023-02-06]. https://doi.org/10.3390/jof8111179.
(责任编辑:胡立霞)

