柚子皮不溶性膳食纤维的提取工艺优化及特性分析
张文莉,罗 银,顾瑶佳,王 颖,刘星雨,蔡文博,刘恩岐
(徐州工程学院食品与生物工程学院,江苏徐州 221018)
柚子(Citrusgrandis),别名文旦、雷柚,属芸香科柑橘属植物,在我国主要产于长江以南等地,种植历史悠久,资源丰富。柚子富含维生素C 和其他营养素,具有养血润肺的功效[1-2],是深受大家的喜欢的水果之一。通常人们食用或加工柚子的果肉,柚子果皮或作为垃圾直接扔掉,或用作动物饲料,这造成了资源浪费和环境污染。研究发现,柚子皮占柚子果实总质量的15%,具有较厚的泡沫状多孔结构,富含丰富的纤维素、半纤维素、木质素和果胶等物质[3-4],是生产膳食纤维的天然来源之一。因此,对柚子皮中的膳食纤维进行提取利用具有重要意义。
膳食纤维(dietary fiber,DF)是人体所需要的第七大营养素[5]。根据溶解度的大小,可分为水溶性膳食纤维(water-soluble dietary fiber,SDF)和不溶性膳食纤维(insoluble dietary fiber,IDF)。IDF 主要是由纤维素、半纤维素和木质素等组成,其表面具有大量的活性基团,可吸附肠道内的脂质和糖类等有机物,同时还可以清除体内有毒物质,促进新陈代谢[6-9]。此外,IDF 可增加人体饱腹感,有助于人们控制饮食,保持身体健康。目前,提取膳食纤维的方法有多种,比较常用的有化学法[10-11]、酶法[12-13]、物理法[14]和生物发酵法等[14]。上述提取方法中,化学法的生产成本低,提取效果差。生物发酵法的提取得率较高,但对环境因素要求较高。酶法提取工艺简单,条件温和且易控制,提取纯度高[15]。此外,从柚子皮中提取膳食纤维也受到越来越多学者的关注。顾欣等[16]通过乳酸菌发酵法提取了梁平柚皮的IDF,提取率为58.65%,并测定了IDF 的理化性质。曾心悦等[17]仅采用α-淀粉酶制备了梅州金柚皮的IDF,分析了其结构、理化性质和功能。范道春等[18]使用淀粉酶和胰蛋白酶制备了柚子皮IDF,且对制备工艺进行了优化。但目前专注于复合酶法提取柚子皮IDF 的研究及特性测定仍然较少。
因此,本文采用复合酶法提取柚子皮IDF,探究料液比、酶的添加量、酶解时间等单因素对柚子皮IDF 得率的影响,并利用正交试验设计优化柚子皮IDF 的提取条件。最后对柚子皮IDF 的结构与特性进行表征分析,这为柚子皮的高值化利用和精深加工提供理论依据。
1 材料与方法
1.1 材料与仪器
柚子皮 市售新鲜沙田柚子剥皮制得;α-淀粉酶(≥50 U/mg)、糖化酶(≥100 U/mg)、木瓜蛋白酶(≥10 U/mg)、胆酸钠(BR)、胆固醇(纯度≥99%)上海源叶生物科技有限公司;葡萄糖、盐酸、氢氧化钠 分析纯,上海阿拉丁生化科技股份有限公司。
BGZ-76 电热鼓风干燥 上海博讯实业有限公司;L550 型离心机 湖南湘仪离心机仪器有限公司;FA2104N 型电子天平 上海精密仪器有限公司;723C 型可见分光光度计 上海欣茂仪器设备有限公司;HH-4 型数显恒温水浴锅 常州国华电器有限公司;pHS-3C 精密pH 计 上海雷磁仪器厂;立式真空冷冻干燥机 北京松源华兴科技发展有限公司;Bruker V70 红外光谱仪 德国Bruker 公司。
1.2 实验方法
1.2.1 原料的预处理 将新鲜的柚子直接剥皮得柚子皮,然后用纯水洗净,切成约2 cm×2 cm 的小块,放入石油醚(料液比1:4)中浸泡4 h 后取出,用蒸馏水反复清洗去除有机溶剂,放入烘箱,80 ℃干燥24 h。用高速粉碎机将干燥后的柚子皮粉碎,过100 目筛,得到脱脂柚子皮粉,备用。
1.2.2 柚子皮不溶性膳食纤维的提取方法 将柚子皮粉与水按一定比例混合均匀,用醋酸铵溶液调节溶液pH 至6,加入α-淀粉酶,60 ℃水浴酶解90 min,煮沸5 min 灭酶。冷却后用醋酸铵溶液调节溶液pH 至4.5,加入一定量的糖化酶,55 ℃水浴30 min,煮沸5 min 灭酶。冷却后用醋酸铵溶液调节溶液pH 至6,加入木瓜蛋白酶,50℃水浴30 min,煮沸5 min 灭酶。冷却后用离心机以4000 r/min 的转速离心10 min,倒去上清液,加入30%过氧化氢,60 ℃水浴2 h,用去离子水清洗,再用离心机以4000 r/min 的转速离心10 min 后收集沉淀,沉淀物冷冻干燥48 h,得柚子皮IDF。
1.2.3 柚子皮IDF 的提取工艺流程
1.2.4 柚子皮不溶性膳食纤维的含量计算 不溶性膳食纤维的得率计算公式如下:
式(1)中:m1为提取的不溶性膳食纤维的质量;m0为样品的质量。
1.2.5 单因素实验设计 准确称取1.0 g 脱脂柚子皮粉,控制淀粉酶的添加量为0.6%,淀粉酶的酶解时间90 min,木瓜蛋白酶的添加量0.25%,木瓜蛋白酶的酶解时间20 min,研究不同料液比(1:5、1:10、1:20、1:40、1:60 g/mL)对柚子皮IDF 得率的影响;控制料液比1:40 g/mL,淀粉酶的酶解时间90 min,木瓜蛋白酶的添加量0.25%,木瓜蛋白酶的酶解时间30 min,研究淀粉酶的不同添加量(0.2%、0.4%、0.6%、0.8%、1.0%)对柚子皮IDF 得率的影响;控制料液比1:40 g/mL,淀粉酶的添加量0.6%,木瓜蛋白酶的添加量0.25%,木瓜蛋白酶的酶解时间30 min,研究淀粉酶的不同酶解时间(30、60、90、120、180 min)对柚子皮IDF 得率的影响;控制料液比1:40 g/mL,淀粉酶的添加量0.6%,淀粉酶的酶解时间90 min,木瓜蛋白酶的酶解时间30 min,研究木瓜蛋白酶的不同添加量(0.10%、0.15%、0.20%、0.25%、0.30%)对柚子皮IDF 得率的影响;控制料液比1:40 g/mL,淀粉酶的添加量0.6%,淀粉酶的酶解时间90 min,木瓜蛋白酶的添加量0.25%,研究木瓜蛋白酶的不同酶解时间(10、20、30、40、50 min)对柚子皮IDF 得率的影响。
1.2.6 正交试验设计优化 在考察单因素实验结果的基础上,选取对柚子皮IDF 得率影响程度较大的四个因素:料液比、淀粉酶的添加量、淀粉酶的酶解时间和木瓜蛋白酶的添加量。设计4 因素3 水平的正交实验,以柚子皮IDF 得率为评价指标,研究上述因素对得率的影响,从而对提取工艺进行优化。正交因素水平设计如表1 所示。
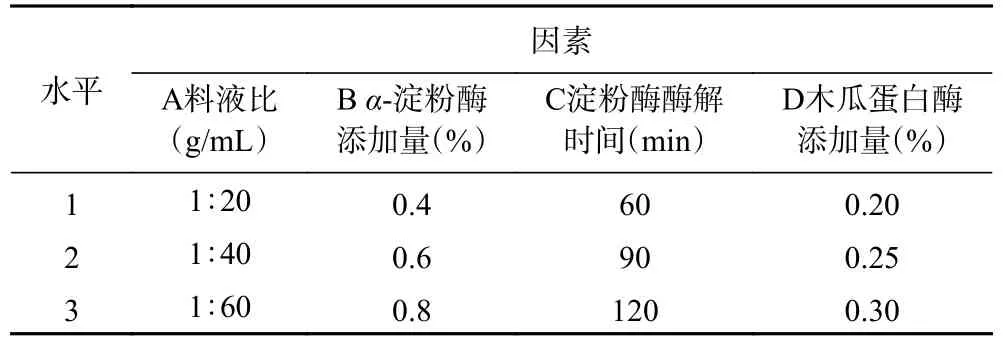
表1 正交试验因素水平设计Table 1 Factors and levels of orthogonal experiment
1.2.7 柚子皮中IDF 的理化性质的测定
1.2.7.1 膨胀力(WSC)的测定 准确称取干燥样品0.5 g 置于25 mL 量筒中,读取此时样品自然堆积的体积,并记录。然后向量筒中加入10 mL 蒸馏水,将量筒中的不溶性膳食纤维和蒸馏水轻轻混合均匀,室温静置24 h,读取并记录样品吸水膨胀后的体积,IDF 的膨胀力计算如下[19]:
式(2)中:V1,样品吸水膨胀后测定的体积,mL;V0,样品自然堆积的体积,mL;m,样品的质量,g。
1.2.7.2 持水力(WHC)的测定 准确称取0.5 g 干燥样品放入干燥的离心管中,称重。加入20 mL 水,充分混合均匀。在25 ℃恒温振荡器下振荡1 h 后,4000 r/min 离心10 min,取出,轻轻倒去上层清液,静置5 min 后称重,IDF 的持水力计算如下[19]:
式(3)中:m0,样品的质量,g;m1,离心管的重量,g;m2,离心管和含有水的样品的总重量,g。
1.2.7.3 持油力(OHC)的测定 准确称取0.5 g 干燥样品放入干燥的离心管中,称重。加入20 mL 大豆油,用旋涡混匀器混合均匀。在25 ℃恒温振荡器下振荡1 h 后,4000 r/min 离心10 min,取出,轻轻倒去上层油脂,用吸油纸吸去离心管壁上多余的油脂,静置5 min 后称重,IDF 的持油力计算如下[20-21]:
式(4)中:m0,样品的质量,g;m1,离心管的重量,g;m2,离心管和含有油的样品的总重量,g。
1.2.7.4 阳离子交换能力(CEC)的测定 准确称取0.5 g 干燥样品放入10 mL 0.1 mol/L 的盐酸溶液中,室温下搅拌24 h 后过滤,将残渣与100 mL 15%NaCl 溶液混合,并用0.1 mol/L 的NaOH 溶液进行滴定,以酚酞作指示剂,记录滴定终点消耗的氢氧化钠溶液的体积。同时,用纯水代替上述的盐酸溶液,记录空白实验消耗NaOH 溶液的体积。IDF 的阳离子交换能力计算如下[16]:
式(5)中:m,样品的质量,g;V1,NaOH 滴定盐酸溶液消耗的体积,mL;V0,NaOH 滴定空白实验消耗的体积,mL。
1.2.8 柚子皮中IDF 的体外吸附能力的测定
1.2.8.1 对葡糖糖吸附能力(GAC)的测定 取0.5 g干燥样品与50 mL 100 mmol/L 的葡萄糖溶液混合,置于37 ℃恒温振荡器中振荡6 h 后取出。以4000 r/min 的转速离心10 min。倒出上清液,用3,5-二硝基水杨酸比色法测定葡萄糖浓度。然后根据已绘制的标准曲线y=2.734x+0.3526,R2=0.9902,测定吸附前后葡萄糖的浓度。IDF 对葡萄糖的吸附量的计算如下[22-23]:
式(6)中:C0,吸附前溶液中的葡萄糖浓度,mmol/L;C1,离心后上清液中葡萄糖的浓度,mmol/L;m,样品的质量,g。
1.2.8.2 对胆酸钠吸附能力(SAC)的测定 取干燥的样品0.5 g 与100 mL 0.15 mol/L NaCl 溶液和0.2 g 胆酸钠混合均匀,放入37 ℃的水浴锅中静置3 h 后取出。以4000 r/min 的转速离心10 min 后,取1 mL 上清液滴加到10 mL 具塞比色管中,再加入6 mL 45% H2SO4和1 mL 0.3% 糠醛,然后放入65 ℃的水浴锅中静置30 min,等待显色。用分光光度计测定620 nm 处的吸光度,然后根据已绘制的标准曲线y=0.2648x-0.0545,R2=0.9981,计算出残留的胆酸钠的浓度,IDF 对胆酸钠的吸附量计算如下[24-25]:
式(7)中,m1,m2分别为吸附前后溶液中胆酸钠的量,mg;m0,样品的质量,g。
1.2.8.3 对胆固醇吸附能力(CAC)的测定 将10 mL蛋黄液与90 mL 蒸馏水混合,充分搅拌形成乳液。分别称取两份1.0 g 柚子皮IDF 于锥形瓶中,再各加入25 mL 上述乳液混合均匀,将混合液的pH 分别调节为2.0(模仿胃环境)和7.0(模仿小肠环境)。将盛有混合液的锥形瓶置于37 ℃的恒温振荡器上180 r/min 振荡2 h 后取出,再以4000 r/min 的转速离心20 min,取上清液,采用邻苯二甲醛法测定550 nm 处的OD 值,然后根据已绘制的标准曲线y=0.493x+0.0074,R2=0.9988,计算上清液中残留的胆固醇的量。IDF 对胆固醇的吸附量计算如下[24]:
式(8)中,m1,m2分别是吸附前后溶液中胆固醇的量,mg;m,样品的质量,g。
1.2.8.4 对NO2-吸附能力的测定 参照文献[26-27]的研究方法略作修改。绘制NO2-的标准曲线y=0.6385x+0.0265,R2=0.9987。准确称取柚子皮IDF 0.5 g,加入30 mL、10.0 mg/L 的亚硝酸钠溶液,调节溶液的pH 至2.0,在37 ℃的水浴振荡器上180 r/min恒温振荡,在10~90 min 时取样,并测定溶液中剩余NO2-的量,IDF 对NO2-的吸附量的计算如下:
式(9)中:C1,C2分别是吸附前后溶液中NO2-的浓度,mg/mL;V,溶液的体积,mL;m,样品的质量,g。
1.2.9 傅里叶红外光谱(FTIR)的测定 将待测样品置于红外灯下充分干燥,然后称取1 mg 的待测样品与100 mg 光谱纯溴化钾充分研磨至均匀的粉末,用压片机压片备用,以4000~400 cm-1扫描,设置扫描次数64 次,分辨率为4 cm-1。
1.3 数据处理
所有试验均重复三次,用软件Excel 2016、SPSS 19.0 和Origin 8.0 分析处理和作图。
2 结果与分析
2.1 柚子皮IDF 得率单因素实验结果
2.1.1 料液比的选择 柚子皮IDF 得率受料液比的影响如图1 所示。随着料液比的逐渐增大,IDF 得率呈现先增大后逐渐减小的趋势。当料液比为1:40 时,提取率最高为49.70%。这是由于料液比加大能够使样品与提取液充分接触,利于IDF 的溶出,从而增加其得率。然而料液比继续增大,柚子皮中的IDF 含量有限,当其达到扩散平衡时,可能会发生部分水解,得率下降[13]。因此,选择料液比的优化范围是1:20、1:40 和1:60 g/mL。
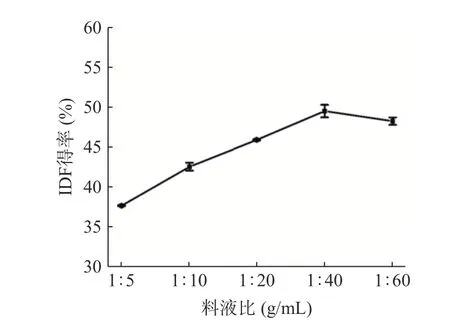
图1 料液比对柚子皮IDF 得率的影响Fig.1 Effect of material-liquid ratio on IDF yield of pomelo peel
2.1.2α-淀粉酶添加量的选择 柚子皮IDF 得率受α-淀粉酶添加量的影响如图2 所示。柚子皮IDF 得率随α-淀粉酶添加量的增大呈现先增大后减小的趋势。这是由于α-淀粉酶的添加加快了柚子皮中的淀粉的水解,利于IDF 的溶出,提高了其得率。当添加量为0.6%时,IDF 的得率最高为52.16%。当添加量继续增加时,IDF 得率稍微降低,这可能是由于α-淀粉酶与底物的结合位点达到饱和的状态,从而导致得率降低[11]。综合各方面成本和得率考虑,选择α-淀粉酶的添加量0.4%~0.8%作为最佳优化范围。
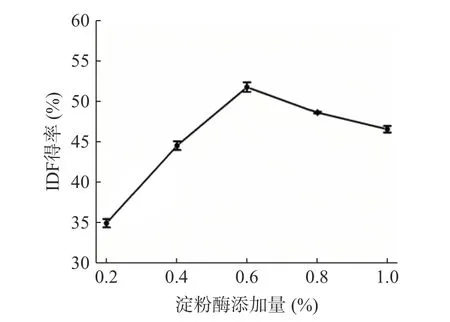
图2 淀粉酶添加量对柚子皮IDF 得率的影响Fig.2 Effect of amylase addition amounton IDF yield of pomelo peel
2.1.3α-淀粉酶酶解时间的选择 柚子皮IDF 得率受α-淀粉酶酶解时间的影响如图3 所示,呈现先升高后趋于平缓的趋势。这是由于随着酶解时间的增加,柚子皮中的淀粉被充分酶解,有助于IDF 的析出,得率达到最大值为51.23%。时间继续延长,IDF 中其他物质可能会发生分解,从而导致其得率降低[28]。因此,选择酶解时间的优化范围是60、90、120 min。
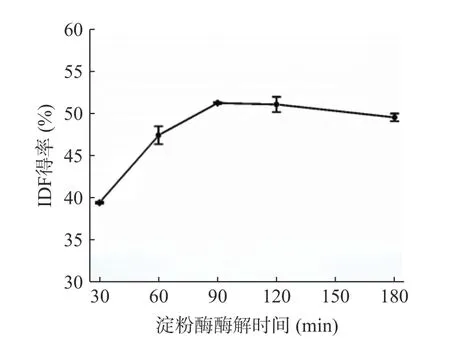
图3 淀粉酶酶解时间对柚子皮IDF 得率的影响Fig.3 Effect of amylase hydrolysis time on IDF yield of pomelo peel
2.1.4 木瓜蛋白酶添加量的选择 柚子皮IDF 得率受木瓜蛋白酶添加量的影响如图4 所示。木瓜蛋白酶的添加量从0.10%增加到0.25%时,柚子皮IDF 得率大幅度增加,最大值为49.27%,而后有所降低。这是由于木瓜蛋白酶添加量增加使得柚子皮中的蛋白质组分水解度增加,添加量过高会导致IDF 中的半纤维素等组分溶解,从而使得IDF 得率降低[29]。因此,木瓜蛋白酶的添加量优化范围是0.2%~0.3%。
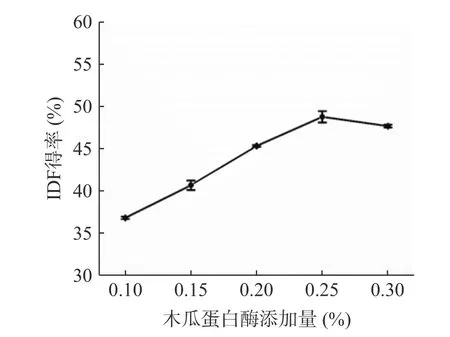
图4 木瓜蛋白酶添加量对柚子皮IDF 得率的影响Fig.4 Effect of papain addition amount on IDF yield of pomelo peel
2.1.5 木瓜蛋白酶酶解时间的选择 柚子皮IDF 得率受木瓜蛋白酶酶解时间的影响如图5 所示。随着蛋白酶酶解时间的延长,柚子皮IDF 得率呈先增大后减小的趋势,但总体变化差异不明显。当酶解时间为30 min 时,柚子皮IDF 得率最高为43.70%。因此木瓜蛋白酶的酶解时间选为30 min。
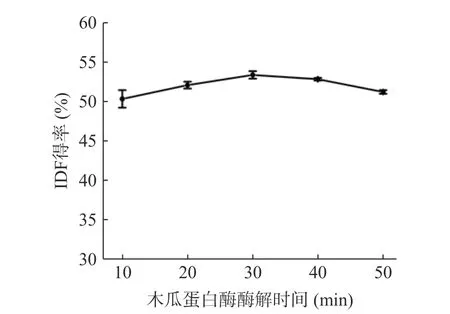
图5 木瓜蛋白酶酶解时间对柚子皮IDF 得率的影响Fig.5 Effect of papain hydrolysis time on IDF yield of pomelo peel
2.2 优化工艺的正交试验结果
由单因素实验结果可知,料液比、α-淀粉酶添加量、α-淀粉酶酶解时间和木瓜蛋白酶添加量这4 个因素对柚子皮IDF 得率变化的影响较大。由表2 可知,极差分析的结果RB>RD>RC>RA,即对柚子皮IDF得率影响的程度依次为:B(α-淀粉酶添加量)>D(木瓜蛋白酶添加量)>C(α-淀粉酶酶解时间)>A(料液比)。从k 值可以看出,提取柚子皮IDF 的最佳工艺组合为A2B2C2D2,即提取液的料液比为1:40,α-淀粉酶添加量为0.6%,α-淀粉酶酶解时间为90 min,木瓜蛋白酶添加量为0.25%。该试验条件并不包含在正交试验的9 组试验中,因此需要对该条件进行单独试验操作。
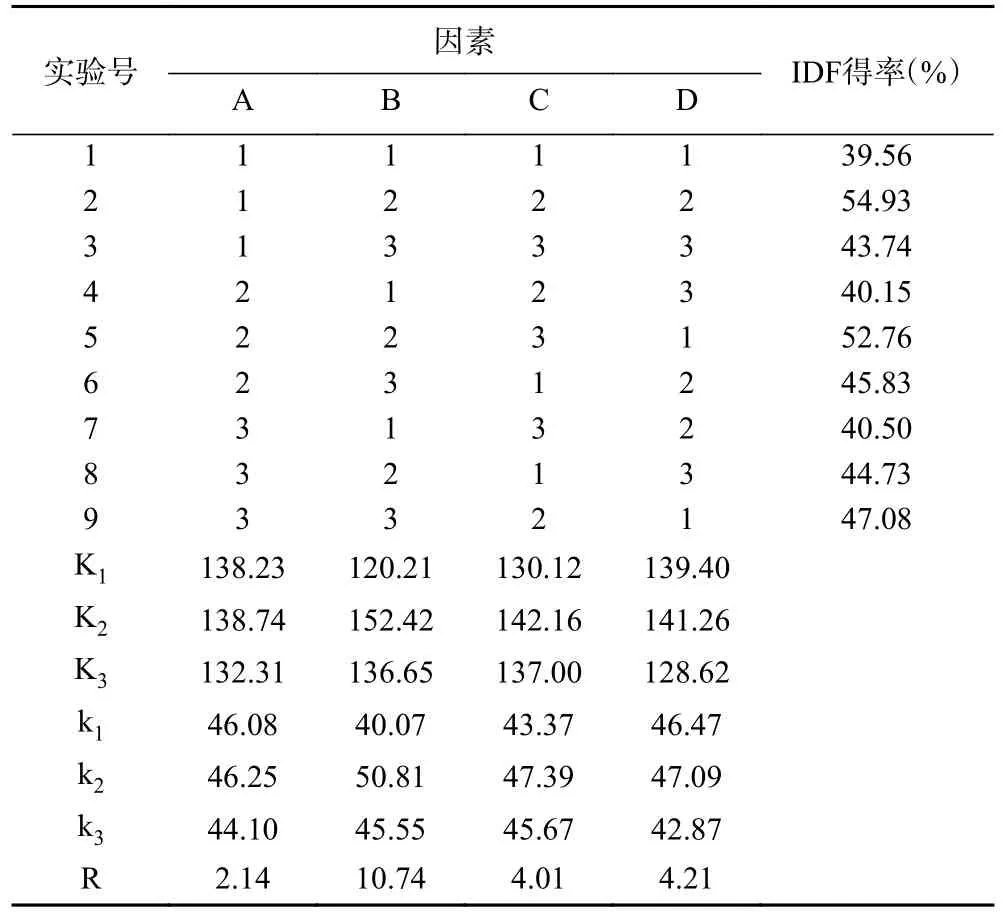
表2 柚子皮IDF 得率的正交试验结果Table 2 Results of orthogonal experiment on IDF yield of pomelo peel
2.3 验证试验结果
由正交试验结果可知,提取柚子皮IDF 的最佳工艺条件为:料液比1:40 g/mL,α-淀粉酶添加量为0.6%,α-淀粉酶酶解时间为90 min,木瓜蛋白酶添加量为0.25%,木瓜蛋白酶酶解时间为30 min。在此条件下进行试验,柚子皮IDF 得率可达55.07%±1.03%,产品呈白色。
2.4 柚子皮IDF 的理化性质
持水力和膨胀力反映出膳食纤维的水合能力。柚子皮IDF 结构中含有大量的羟基和羧基等亲水基团,所以其水合能力较高。由表3 可知,采用复合酶法提取的柚子皮IDF 的持水力为(12.54±0.11)g/g,高于黄皮果皮IDF 的持水力值(3.18±0.03)g/g[30]。高持水力和膨胀力有利于促进人体排泄的速度。持油力的大小反映了膳食纤维对油脂吸附能力的强弱,柚子皮IDF 的持油力为1.54±0.02 g/g,说明其对油脂具有一定的吸附能力。柚子皮IDF 的阳离子交换能力为0.36±0.04 mmol/g,这是由于膳食纤维的分子结构中含有羧基和氨基,可实现与阳离子可逆交换[31]。

表3 柚子皮IDF 的理化特性Table 3 Physicochemical properties of pomelo peel IDF
2.5 柚子皮IDF 的体外吸附特性结果分析
从表4 可知,柚子皮IDF 的网状结构具有吸附葡萄糖的能力,这有利于控制人的餐后血糖水平[23,31]。研究表明,过量摄入胆固醇可诱发心血管疾病。IDF 可通过调节脂质代谢的相关基因的表达,从而影响人们对胆固醇脂质的代谢[7]。通过实验发现,柚子皮IDF 对胆固醇具有一定的吸附能力,但吸附能力的大小受pH 的影响。在pH 为7 的条件下,对胆固醇的吸附能力达12.27±0.020 mg/g。亚硝酸盐可与仲胺、叔胺发生反应生成强致癌物亚硝胺,而不溶性膳食纤维中含有的酚酸基团可与亚硝酸盐生成不可逆反应从而阻断了N-硝基化合物的生成[26,32],因此达到清除体内亚硝酸盐的作用。由图6可知,柚子皮IDF 对NO2-的吸附量在90 min 后达到平衡,为157 μg/g。
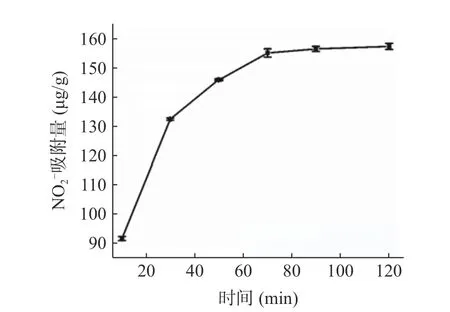
图6 柚子皮IDF 对亚硝酸盐吸附能力的影响Fig.6 Effect of pomelo peel IDF on nitrite adsorption capacity

表4 柚子皮IDF 对葡萄糖、胆固醇和胆酸钠的吸附结果Table 4 Results of IDF adsorption on glucose,cholesterol and sodium cholate of grapefruit peel
2.6 傅里叶红外光谱分析结果
柚子皮中IDF 的红外光谱分析如图7 所示。波数为3430 cm-1处宽的吸收峰归属为纤维素和半纤维素的O-H 的伸缩振动峰,2920 和2850 cm-1处的吸收峰归属为糖类甲基的C-H 的收缩振动,1740 和1620 cm-1处的吸收峰是C=C 和C=O 的伸缩振动[19],1290~1500 cm-1处的吸收峰为木质素芳香骨架中的CH3-和CH2-的伸缩振动。1062 cm-1处的吸收峰为纤维素和半纤维素中的C-O-C 骨架的对称伸缩[21,33],符合膳食纤维的结构。
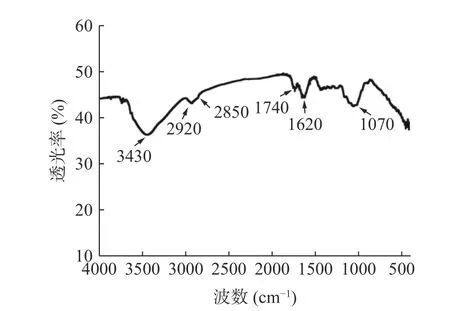
图7 柚子皮IDF 的红外光谱图Fig.7 Infrared spectrum of pomelo peel IDF
3 结论
本试验以柚子皮为原料,在单因素实验的基础上,采用复合酶法提取柚子皮IDF。通过正交试验确定提取的最佳工艺:料液比1:40 g/mL、淀粉酶的添加量0.6%、淀粉酶的酶解时间90 min、木瓜蛋白酶的添加量0.2%、木瓜蛋白酶的酶解时间30 min。在此工艺条件下做验证实验,柚子皮IDF 得率可达55.07%±1.03%。柚子皮IDF 的理化特性较为突出。柚子皮IDF 的膨胀力2.84±0.09 mL/g,持水力12.54±0.11 g/g,持油力1.54±0.02 g/g,阳离子交换能力0.36±0.04 mmol/g。由体外吸附实验可知,柚子皮IDF 可吸附葡萄糖0.13±0.003 mmol/g,胆固醇12.27±0.020 mg/g(pH7),胆酸钠53.25±0.100 mg/g和亚硝酸根离子157 μg/g。以上试验结果表明,采用复合酶提取的柚子皮IDF 具有良好的吸附特性,这为利用生物质废弃物柚子皮开发不溶性膳食纤维功能性产品提供了依据,有助于推动膳食纤维的高效化应用。
© The Author(s) 2024.This is an Open Access article distributed under the terms of the Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc-nd/4.0/).

