可选择性识别重金属离子的肟类化合物的合成
蔡 苗, 林怡婷, 黄 莉, 詹红菊, 王 勇
(荆楚理工学院 化工与药学院 荆门医药工业技术研究院,湖北 荆门 448000)
近年来,随着科学技术的飞速发展,以重金属为代表的环境问题受到日益重视。众所周知,有些金属离子作为人体必不可少的微量元素,直接参与大多数生物生命相关的代谢过程,在生命活动中起到重要作用[1-4]。铁作为人体含量最丰富的微量元素,参与血红蛋白、肌红蛋白和脑白蛋白等重要蛋白质以及核酸的合成,对氧代谢、细胞代谢和电子转移等生理活动也具有重要意义[5-6]。铁含量过多会严重损害肝脏和肾脏,过少则会引起缺铁性贫血。同样,铜作为人体所必需的微量元素,在各种生物的新陈代谢过程中也起着十分重要的作用,例如铜与酶和蛋白质结合形成的含铜酶和含铜蛋白质可有效清除体内自由基代谢废物,还可作为造血“助手”,维持细胞正常造血功能[7-8]。但是,铜过量同样会危害人体健康,导致肝硬化和肝腹水等,严重时还会引发神经系统疾病,如阿尔茨海默氏症和帕金森氏症等[9-10]。
肟类化合物含有—C=N—OH结构,=N—OH中的N和O都有很强的配位能力,同时由于2个原子间的距离十分相近,导致肟中的N和O不会形成单独的双齿螯合结构,而是倾向于和不同的金属离子配位形成多核的配合物。同时,肟类配体又存在多种多样的配位结构,使配位化合物有可能呈现多种多样的特殊结构[11-12]。芳香结构的肟类化合物的分子结构中有共轭π键体系,且当芳环上的取代基为给电子基团(—CH3、 —OCH3等)时,给电子基团上的电子云与芳环上的轨道基本平行,扩大了体系的共轭程度,从而使化合物荧光增强。给电子基团上的C、 N和O等杂原子还可以通过氢键来增强配体与金属离子的相互作用[13]。
肟类化合物与金属离子形成的配合物往往具有独特光、电、磁和生物活性,不仅可以广泛用于重金属离子检测,而且在催化剂、新材料、有机合成、医药和生物活性等领域具有潜在的应用[14-15]。基于此,本文以2-甲氧基-4-溴苯甲酸(1)为起始原料制得目标产物2-甲氧基-4-甲醛肟基苯甲酸乙酯(图1,4)。通过电子吸收光谱和荧光光谱方法,研究化合物4对多种重金属离子如Cu(II)、 Fe(III)、 Pb(II)、 Co(II)、 Cr(III)、 Ni(II)、 Fe(II)、 Mn(II)、 Zn(II)和Cd(II))的选择识别。
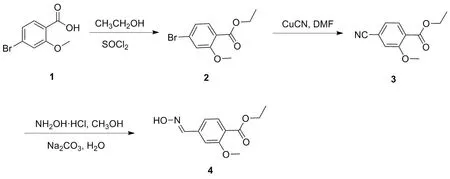
图1 化合物4的合成路线
1 实验部分
1.1 仪器与试剂
JACSO-V770型紫外-可见分光光度仪(日本JACSO公司); F-4600型日立荧光分光光度计(日本日立公司); Nicolet iS50型傅立叶红外光谱仪(美国Thermo公司); AVANCE III TMHD 400 MHz型核磁共振波谱仪(瑞士Bruker公司,CDCl3为溶剂,TMS为内标); Vario EL cube型有机元素分析仪(德国Elementar公司)。
无水氯化镍、乙酸铜一水合物、氯化铅(萨思化学技术有限公司);硝酸镉、乙酸钴四水合物、盐酸羟胺(上海思域化工科技有限公司);2-甲氧基-4-溴苯甲酸、氰化亚铜、四水乙酸锰、硫酸亚铁铵六水合物(上海泰坦科技股份有限公司);无水碳酸钠、氯化锌、硝酸铬、硝酸铁(III)九水合物(上海麦克林生化科技有限公司)。所用试剂均为分析纯。
1.2 合成
(1) 2-甲氧基-4-溴苯甲酸乙酯(2)的合成
将2-甲氧基-4-溴苯甲酸(1, 5.00 g, 21.64 mmol)溶解在无水乙醇(60 mL)中,添加二氯亚砜(2 mL, 27.54 mmol)。回流反应6 h后,将该溶液冷却至室温,添加饱和碳酸钠溶液(20 mL),随后使用乙酸乙酯(3×20 mL)进行萃取,将有机相合并后分别用水(2×10 mL)和饱和氯化钠溶液(2×10 mL)洗涤。将有机相使用无水硫酸镁进行干燥、过滤和减压浓缩,得到黄色油状液体2-甲氧基-4-溴苯甲酸乙酯(2), 4.70 g,产率83.8%;1H NMR(CDCl3, 400 MHz)δ:7.66~7.68(q, 1H, Ar—H), 7.10~7.13(m, 2H, Ar—H), 4.31~4.37(q, 2H, —OCH2CH3), 3.89(s, 3H, Ar—OCH3), 1.35~1.38(t, 3H, —OCH2CH3);13C NMR(CDCl3, 100 MHz)δ:165.35(—COO—), 159.68(Ar—C), 132.73(Ar—C), 127.48(Ar—C), 123.33(Ar—C), 119.25(Ar—C), 115.65(Ar—C), 60.97(—OCH2—CH3), 56.28(Ar—C—OCH3), 14.27(—OCH2CH3);元素分析(C10H11BrO3),实测值(计算值) %: C 46.36(46.45), H 4.28(4.21); IR(KBr)νcm-1:3098, 3075(芳香环上C—H伸缩振动),2980, 2940, 2905, 2854(甲氧基上C—H伸缩振动),1731(C=O), 1589, 1569, 1487, 1464(芳香环上碳骨架伸缩振动),1285, 1244, 1172(—C—O—C—), 1095, 1025, 862, 834, 772(芳香环上C—H面外弯曲振动),587(C—Br)。
(2) 4-氰基-2-甲氧基苯甲酸乙酯(3)的合成
将化合物2(4.70 g, 18.14 mmol)用DMF(80 mL)溶解,加入氰化亚铜(16.25 g, 181.44 mmol),回流反应48 h后,冷却至室温。加入饱和Na2CO3溶液(100 mL),产生黄色的固体沉淀物,抽滤,滤液用乙酸乙酯溶剂(3×30 mL)萃取,收集有机相。得到的有机层依次用水(2×15 mL)和饱和食盐水溶液(2×15 mL)洗涤,有机相用无水硫酸镁干燥,抽滤,得到无色滤液,减压浓缩得到白色粗产物。将白色粗产物在二氯甲烷和石油醚的混合溶剂中重结晶,得到白色固体化合物3, 1.46 g,产率为39.2%;1H NMR(CDCl3, 400 MHz)δ:7.81~7.83(d, 1H, Ar—H), 7.27~7.30(dd, 2H, Ar—H), 4.36~4.41(q, 2H, —OCH2CH3), 3.94(s, 3H, Ar—O—CH3), 1.37~1.40(t, 3H, —OCH2CH3);13C NMR(CDCl3, 100 MHz)δ:164.91(—COO—), 158.69(Ar—C), 131.91(Ar—C), 125.17(Ar—C), 123.88(Ar—C), 117.98(Ar—C), 116.27(Ar—C—CN), 115.23(Ar—C—CN), 61.60(—OCH2CH3), 56.38(Ar—O—CH3), 14.22(—OCH2CH3);元素分析(C11H11NO3),实测值(计算值) %: C 64.38(64.57), H 5.40(5.34), N 6.83(6.77); IR(KBr)νcm-1:3118, 3080, 3054(芳香环C—H伸缩振动),2977, 2952, 2899(甲氧基C—H伸缩振动),2235(氰基伸缩振动),1700(C=O), 1608, 1562, 1468, 1495, 1458(芳香环上碳骨架伸缩振动),1294, 1255, 1178(—C—O—C—), 1089, 1027, 1011, 934, 883, 777(芳香环C—H面外弯曲振动)。
(3) 2-甲氧基-4-甲醛肟基苯甲酸乙酯(4)的合成
将步骤(2)中得到的化合物3(1.46 g, 7.11 mmol)溶于乙醇溶液(20 mL)中,加入盐酸羟胺(0.54 g, 7.77 mmol)和无水碳酸钠(1.58 g, 14.91 mmol)的水溶液(20 mL),回流反应6 h,冷却至室温,将其减压浓缩除去乙醇后得白色沉淀物。白色沉淀物用乙酸乙酯和石油醚的混合溶剂重结晶,抽滤得到白色固体2-甲氧基-4-甲醛肟基苯甲酸乙酯(4), 0.62 g,产率39.0%;1H NMR(CDCl3, 400 MHZ)δ:7.79~7.81(d, 1H, Ar—H), 7.53(s, 1H, Ar—H), 7.27~7.30(t, 1H, Ar—H), 6.02~6.26(d, 2H, H—C=N+N—O—H), 4.35~4.40(q, 2H, —OCH2CH3), 3.95(s, 3H, Ar—O—CH3), 1.37~1.41(t, 3H, —OCH2CH3);13C NMR(CDCl3, 100 MHz)δ:168.25 (—COO—), 165.50 (—O—Ar—C), 161.81 (—C=N—), 133.15 (Ar—C), 130.93 (Ar—C), 125.08 (Ar—C), 120.10 (Ar—C), 111.91 (Ar—C), 61.29(—OCH2CH3), 56.38(Ar—O—CH3), 14.22(—OCH2CH3);元素分析(C11H13NO4),实测值(计算值) %: C 59.19(59.28), H 5.87(5.46), N 6.27(6.33); IR(KBr)νcm-1:3432(O—H), 3018(芳香环上C—H伸缩振动),2982, 2932, 2871, 2850(甲氧基C—H伸缩振动),1721(C=O), 1684(C=N), 1627, 1566, 1540, 1500(芳香环碳骨架伸缩振动),1279, 1238, 1170(—C—O—C—), 881, 808, 784(芳香环上C—H面外弯曲振动)。
2 结果与讨论
2.1 氢谱和碳谱分析
化合物2的核磁共振氢谱如图2(a)所示。δ7.66~7.68的四重峰是苯环2号碳上1个氢的化学位移,δ7.10~7.13的多重峰是苯环1号和5号碳上2个氢的化学位移,δ4.31~4.37的四重峰是—OCH2CH3的CH2中2个氢的化学位移,δ3.89的单峰是直接与苯环相连的—OCH3中3个氢的化学位移,δ1.35~1.38的三重峰是—OCH2CH3的CH3中3个氢的化学位移。δ7.29处的峰是溶剂CDCl3中氢的化学位移。

δ
化合物2的核磁共振碳谱如图2(b)所示。化学位移在δ165.35的峰是酯基—COO—中碳的化学位移,δ159.68的峰是苯环4号碳的化学位移,δ132.73的峰是苯环2号碳的化学位移,δ127.48的峰是苯环6号碳的化学位移,δ123.33的峰是苯环1号碳的化学位移,δ119.25的峰是苯环3号碳的化学位移,δ115.65的峰是苯环5号碳的化学位移,δ60.97的峰是—OCH2—CH3基团中—CH2—碳的化学位移,δ56.28的峰是—OCH3基团中碳的化学位移,δ14.27的峰是—OCH2—CH3基团中—CH3碳的化学位移,δ77.43~76.80的峰是溶剂CDCl3中碳的化学位移。
化合物3的核磁共振氢谱如图3(a)所示。δ7.81~7.83的双重峰是苯环2号碳上1个氢的化学位移,δ7.27~7.30的双重峰是苯环5号和6号碳上2个氢的化学位移,δ4.36~4.41的四重峰是—OCH2CH3上—CH2—的2个氢的化学位移,δ3.94的单峰是直接与苯环相连—OCH3基团上3个氢的化学位移,1.37~1.40的三重峰是—OCH2CH3和—CH3上3个氢的化学位移,δ1.57的峰是水中氢的化学位移,δ7.26的峰是溶剂CDCl3中氢的化学位移。

δ
化合物3的核磁共振碳谱如图3(b)所示。δ164.91的峰是酯基—COO—碳的化学位移,δ158.69的峰是苯环4号碳的化学位移,δ131.91的峰是苯环2号碳的化学位移,δ125.17的峰是苯环6号碳的化学位移,δ123.88的峰是苯环1号碳的化学位移,δ117.98的峰是苯氰基上碳的化学位移,δ116.27的峰是苯环3号碳的化学位移,δ115.65的峰是苯环5号碳的化学位移,δ61.60的峰是—OCH2—CH3基团上—CH2—碳的化学位移,δ56.38的峰是直接与苯环相连—OCH3基团上碳的化学位移,δ14.22的峰是—OCH2—CH3基团上—CH3碳的化学位移。δ77.36~76.73的峰是溶剂CDCl3中碳的化学位移。
化合物4的核磁共振氢谱如图4(a)所示。化学位移在δ7.79~7.81的双重峰是苯环2号碳上1个氢的化学位移,δ7.53的单重峰是苯环5号碳上1个氢的化学位移,δ7.27~7.30的三重峰是苯环1号碳上1个氢的化学位移,δ6.02~6.26的双重峰是H—C=N和N—O—H上2个氢的化学位移,δ4.35~4.40的四重峰是—OCH2CH3上—CH2—2个氢的化学位移,δ3.95的单峰是直接与苯环相连的—OCH3基团上3个氢的化学位移,δ1.37~1.41的三重峰是—OCH2CH3上—CH3的3个氢的化学位移。δ7.27的峰是溶剂CDCl3中氢的化学位移。

δ
化合物4的核磁共振碳谱中如图4(b)所示。δ168.25的峰是酯基—COO— 12号碳的化学位移,δ165.50的峰是苯环4号碳的化学位移,δ161.81的峰是7号碳的化学位移,δ133.15的峰是苯环2号碳的化学位移,δ130.93的峰是苯环6号碳的化学位移,δ125.08的峰是苯环1号碳的化学位移,δ120.10的峰是苯环3号碳的化学位移,δ111.91的峰是苯环5号碳的化学位移,δ61.60的峰是—OCH2—CH3基团上—CH2—碳的化学位移,δ56.38是直接与苯环相连—OCH3基团上碳的化学位移,δ14.22是—OCH2—CH3基团上—CH3碳的化学位移,δ77.40~76.76是溶剂CDCl3中碳的化学位移。
2.2 荧光光谱分析
在室温下,用荧光光度仪探究了化合物4对不同金属离子的荧光响应,具体操作如下:将化合物4配成乙腈溶液(1.0×10-5mol/L)。同时选取了10种常见金属试剂:无水氯化镍、乙酸铜一水合物、氯化铅、硝酸镉、乙酸钴四水合物、四水乙酸锰、硫酸亚铁铵六水合物、氯化锌、硝酸铬和硝酸铁(III)九水合物。分别将这些试剂配制成金属离子乙腈溶液(10-2mol/L)。测定方法如下:取3.0 mL浓度为1.0×10-5mol/L的化合物4溶液放入4 mL石英比色皿中,对其进行荧光光谱扫描;接着,将30 uL(1.0×10-2mol/L) Fe(NO3)3·9H2O的乙腈溶液加入其中,以保证化合物4与金属离子的物质的量之比为1 ∶1;保持化合物4的量不变,逐步加入Fe(III),对其进行荧光光谱扫描。其他金属离子(Ni(II)、 Cu(II)、 Pb(II)、 Cd(II)、 Co(II)、 Mn(II)、 Fe(II)、 Zn(II)和Cr(III))均采用类似Fe(III)离子的配制方法。
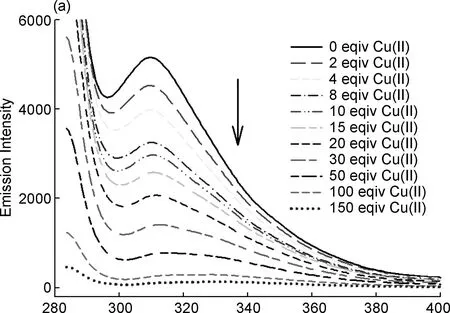
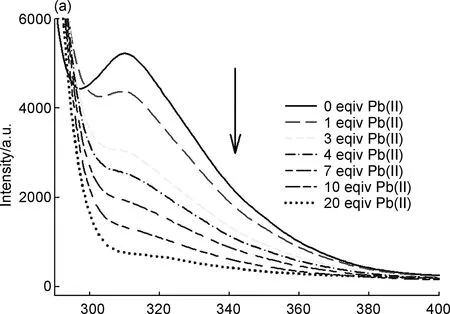
化合物4的荧光光谱采用荧光分光光度计测试,发射波长为311.0 nm,激发波长为279.0 nm,发射波长的测量范围为282~900 nm,扫描速率为2400 nm/min,发射缝隙的宽度为5.0 nm,激发缝隙的宽度为2.5 nm, PMT电压为700 V。在279.0 nm激发时,化合物4在发射波长为311.0 nm时出现最大发射波长,对应苯环上的π-π*跃迁。接着研究了各种常见的不同重金属离子,如Cu(II)、 Fe(III)、 Pb(II)、 Co(II)、 Cr(III)、 Ni(II)、 Fe(II)、 Mn(II)、 Zn(II)和Cd(II))对化合物4荧光发射光谱的影响。如图5~6所示,随着Cu(II)、 Fe(III)和Pb(II)离子的加入,化合物4的荧光强度逐渐减弱至最后基本完全消失;而随着Fe(II)离子的加入,化合物4表现为一定程度的荧光猝灭。此外,Co(II)离子加入后,与Fe(II)离子类似,也出现一定程度的荧光猝灭。而对于其他金属离子,如Mn(II)、 Cr(III)、 Cd(II)、 Zn(II)和Ni(II),金属离子的加入对化合物4的荧光强度影响甚微。化合物4对于Cu(II)离子的最低检测限为2.4×10-4mol·dm-3(F=-2×107c+4900.8),荧光猝灭效率为95.05%。对于Fe(III)离子的最低检测限为4.4×10-5mol ·dm-3(F=-2×108c+8884.4),荧光猝灭效率为97.64%。对于Pb(II)离子的最低检测限为8.1×10-5mol·dm-3(F=-6×107c+4896.4),荧光猝灭效率为87.70%,表明化合物4对Cu(II)、 Fe(III)和Pb(II)离子具有一定的选择识别,对其他金属离子几乎没有识别作用,检测灵敏度分别是Fe(III)>Cu(II)>Pb(II)。
λ/nm
λ/nm
2.3 电子吸收光谱分析
化合物4的电子吸收光谱测试方法与荧光光谱类似。将化合物4配成1.0×10-5mol/L乙腈溶液,将10种金属试剂配制成相应10-2mol/L乙腈溶液。取3.0 mL浓度为1.0×10-5mol/L的化合物4溶液放入4 mL比色皿中,对其进行电子吸收光谱扫描。接着,将30 uL(1.0×10-2mol/L) Fe(NO3)3·9H2O的乙腈溶液加入其中,以保证化合物4与金属离子的物质的量之比为1 ∶1。保持化合物4的量不变,逐步加入Fe(III),对其进行电子吸收光谱扫描。其他金属离子(Ni(II)、 Cu(II)、 Pb(II)、 Cd(II)、 Co(II)、 Mn(II)、 Fe(II)、 Zn(II)和Cr(III))均采用类似Fe(III)离子的配制方法。化合物4的电子吸收光谱采用紫外-可见分光光度仪完成,测量范围为190~900 nm,数据间隔0.5 nm收集,扫描速度为1000 nm/min,在350 nm处改变光源,分别以氘灯和钨灯作光源,以乙腈溶剂作空白背景。
从化合物4的电子吸收光谱可知,其在201 nm处显示强的电子吸收谱带,对应苯环上的π-π*跃迁。接着研究了各种常见的不同重金属离子(Cu(II)、 Fe(III)、 Pb(II)、 Co(II)、 Cr(III)、 Ni(II)、 Fe(II)、 Mn(II)、 Zn(II)和Cd(II))对化合物4电子吸收光谱的影响。随着Cu(II)、 Fe(III)、 Cr(III)和Cd(II)离子的加入(图7~8),化合物4显示其特征光谱,201 nm处吸收带强度略微增强。如图8(b)所示,随着Pb(II)离子的加入,化合物4在275 nm处出现新的吸收谱带。对于其他金属离子的加入,化合物4的电子吸收谱带几乎没有变化。

λ/nm

λ/nm
金属离子的加入引起化合物4荧光猝灭的可能机制有:(1)电子能量从荧光团化合物4转移到猝灭剂过渡金属离子;(2)由于荧光团化合物4和猝灭剂过渡金属离子之间形成复合物而导致静态猝灭;(3)碰撞淬灭剂对激发态荧光团的猝灭可能通过多种相互作用进行,如重原子效应、顺磁离子相互作用、由发射或非发射激基复合物的猝灭和由于电子转移引起的猝灭[16-17]。荧光光谱和电子吸收光谱研究表明:化合物4对Cu(II)、 Fe(III)和Pb(II)离子有良好的选择性,而对其他金属离子选择性较差,或者没有选择性。
2.4 可能的反应机理
本文以2-甲氧基-4-溴苯甲酸(1)为原料,在二氯亚砜的无水乙醇条件下,将2-甲氧基-4-溴苯甲酸与二氯亚砜反应生成2-甲氧基-4-溴苯甲酰,之后得到的酰氯与溶剂乙醇反应制得2-甲氧基-4-溴苯甲酸乙酯(2)。在制备化合物2这步反应中,乙醇既是原料也是溶剂,可以减少副反应的发生,还可提高产率。将化合物2与氰化亚铜在DMF溶剂中回流反应,以氰化亚铜中的氰基取代4-溴苯环甲酸乙酯中的溴,得到2-甲氧基-4-氰基苯甲酸乙酸(3)。最后在碳酸钠溶液碱性条件下,将化合物3与盐酸羟胺反应。该步反应主要是利用氰基与盐酸羟胺在碱性条件下一步制得目标化合物2-甲氧基-4-甲醛肟基苯甲酸乙酯(4)。反应中碳酸钠主要起到2个作用:(1)中和盐酸羟胺中的盐酸;(2)与化合物3中的氰基反应。化合物3到4可能的机理见图9。

图9 化合物3到4可能的反应机理
本文以2-甲氧基-4-溴苯甲酸(1)为原料,经酰化和酯化合成2-甲氧基-4-溴苯甲酸乙酯(2),然后将化合物2与氰化亚铜合成2-甲氧基-4-氰基苯甲酸乙酯(3),最后将化合物3与盐酸羟胺在碱性条件下合成2-甲氧基-4-甲醛肟基苯甲酸乙酯(4)。并对化合物2~4进行1H NMR、13C NMR、元素分析和红外光谱结构表征。电子吸收光谱和荧光光谱研究表明:化合物4存在π-π*跃迁,且对Cu(II)、 Fe(III)和Pb(II)金属离子具有较好的选择性。

