苦参碱类衍生物的合成及其活性研究进展
席 宇, 申光焕,3*, 崔琳琳, 王艺儒, 邢志华, 张雪琪
(1. 哈尔滨商业大学 药学院,黑龙江 哈尔滨 150076; 2. 黑龙江省预防与治疗老年病药物研究重点实验室,黑龙江 哈尔滨 150076; 3. 哈尔滨商业大学药物研究所博士后科研工作站,黑龙江 哈尔滨 150076)
苦参碱衍生物主要包括苦参碱、氧化苦参碱、槐果碱和槐定碱等生物碱,其化学结构归属于喹诺嗪类生物碱,如图1所示。苦参碱分子式为C15H24N2O,具有独特的双喹啉四环结构,其由2个不对称的喹啉片段组成,包括(A/B)喹啉和(C/D)喹啉环体系[1]。苦参碱有4个立体碳中心,拥有16个立体异构体,于1889年首次从苦参的根中分离出来,并确认了其结构[2]。研究表明,苦参碱具有多种药理活性,例如抗肿瘤[3-8]、抗心律失常[9]、抗糖尿病[10]、抗炎[11]、免疫抑制[12]、抗病毒[13-14]、抗菌[15]、抗寄生虫[16]、抗纤维化[17]和神经保护[18]等。其中,抗肿瘤活性最为突出,以苦参碱为主研发的复方苦参注射液(Compound Kushen Injection, CKI)已经成为我国临床广泛使用的药物[19],对癌症治疗有很好的疗效,但其存在长时间使用会造成肝肾损伤的缺陷。随着科技的不断发展,个体化治疗比传统的化疗效果好,并且靶向治疗技术日益成熟。因此,寻找高效低毒且价格低廉的新型靶向药物是研究者们追求的目标。苦参碱类衍生物因其成药潜力而被认为是进一步修饰的理想先导化合物,这类衍生物有独特的支架结构、简单的分子结构以及高溶解性等多种类药性质,使其在药物研究领域备受关注。近几年,药物专家通过对苦参碱结构修饰,改善了苦参碱脂水分配系数,提高了苦参碱的活性,并在过去几年取得了长足的进步。本文以苦参碱类衍生物在13-位,14-位,15-位及D环开环4个方面的结构修饰为切入点对近几年的成果进行综述,为研发具有高效低毒的新型苦参碱类药物提供参考。

图1 苦参碱类衍生物的结构
1 13-位结构修饰
研究发现,苦参碱水溶性强,脂溶性差。为了提高苦参碱脂溶性,通常在13-位进行结构修饰。2021年,WUANG等[20]以苦参碱为原料合成了22种苦参碱衍生物(图2,1a~1v),初步筛选了22种新合成的化合物在3种人肝癌细胞(Hep3B、 HCC-LM3和Bel-7404细胞系)中的细胞活性,并以苦参碱和槐果碱为阳性对照。结果表明,22种苦参碱衍生物都显示出较高的抗肿瘤效果,IC50值比苦参碱低17~262倍。其中化合物1v有明显的抗肿瘤效果,IC50值为2.80~3.10 μmol/L,比苦参碱低269~382倍。研究表明,化合物1v通过诱导G1细胞周期阻滞和抑制LM3细胞迁移发挥其抗肿瘤活性。二硫代氨基甲酰基(NH2CS2H)的引入显著增强了抗增殖活性,氨基含有双取代基时的抗细胞增殖活性弱于含单取代基。较为明显地是,环上有氮原子时,化合物活性明显增强。当氨基二硫代甲酸酯(NH2C(S)SCH3)直接连接到1v杂环结构上时,化合物的抗肿瘤活性显著提高。

图2 化合物1a~1v苦参碱的13-位结构修饰路线
2020年,刘超[21]发现硫代苦参碱衍生物13-氨甲基-18-硫代苦参碱(C16H27N3S)具有体内外抗骨质疏松活性,因此利用分子对接技术,与抗骨质疏松靶点核糖体蛋白RPS5进行了分子模拟对接,对接结果显示,13-二硫代氨甲基甲酸苄酯-18-硫代苦参碱(C24H33N3S3)最优。接着,以槐果碱为原料,合成了13-二硫代氨甲基甲酸苄酯-18-硫代苦参碱化合物2(图3)。结果显示,化合物2对2种细胞均有明显的破骨细胞分化抑制活性,化合物2在破骨细胞BMMC和RAW264.7的IC50分别为2.94 μmol/L和2.07 μmol/L。当化合物2浓度在4.00 μmol/L时,化合物2对破骨细胞功能显示出明显的抑制作用。

图3 化合物2苦参碱13-位结构修饰路线
2019年,戴航等[22]以槐果碱为原料合成10种13-位含有羟乙胺基(C2H7NO)的苦参碱衍生物(图4),分别为13-(N-磺酰基)羟乙胺苦参碱(3a~3d)和13-(N-苄基)羟乙胺苦参碱(3e~3j)。同时筛选了这10种新化合物在肝癌细胞HepG2和宫颈癌细胞Hela中的细胞活性,并以苦参碱和槐果碱作为阳性对照。实验结果显示,化合物3f在肝癌细胞HepG2和宫颈癌细胞Hela中均显示出了很好的活性,其IC50值分别78.70 μmol/L和78.00 μmol/L,活性优于阳性对照槐果碱和苦参碱。通过对肝癌细胞HepG2的数据分析,化合物(3e~3j)强于阳性药苦参碱和槐果碱的体外抗肿瘤活性。对宫颈癌细胞Hela的数据分析,化合物(3a,3e~3j)均强于阳性药苦参碱和槐果碱的体外抗肿瘤活性,其中化合物3f对于2种肿瘤细胞均有较好的活性。研究表明,苦参碱13-位引入苄基增加了与拓扑异构酶I的亲和力,使苦参碱具有较好的生物活性。

图4 化合物3a~3j苦参碱13-位结构修饰路线
2017年,付奔等[23]以槐果碱为原料合成了9个13-酰胺基取代苦参碱衍生物(图5,4a~4i)。采用人肝癌细胞株,小鼠黑色素瘤细胞株做活性实验,用苦参碱和氧化苦参碱作阳性对照。结果显示,新合成的9种苦参碱衍生物对这2种肿瘤细胞都具有很强的抑制活性,化合物4b和4e对人肝癌细胞抑制率分别为73.2%、 58.7%,抑制活性较强。化合物4b和4e抗增殖活性增强,优于阳性对照药苦参碱和氧化苦参碱。研究发现,苯的邻位或间位引入氯原子或溴原子弱吸电子基团,能使新合成的化合物的抗肿瘤活性显著增强。

图5 化合物4a~4i苦参碱13-位结构修饰路线
2021年,姜文泰等[24]以苦参碱为原料合成了12个新型的嘧啶并苦生碱衍生物(图6,5,6a~6k),筛选了这12种新合成化合物在人子宫颈癌HeLa和人乳腺癌MCF-7中的细胞活性,并用顺铂作为阳性对照。研究发现,大部分化合物表现出比阳性对照药更强的抑制人宫颈癌HeLa和人乳腺癌MCF-7细胞的增殖活性,且优于苦参碱。化合物6h对人乳腺癌MCF-7的抑制活性最好,其IC50值为3.65 μmol/L,与顺铂3.51 μmol/L效果相似。化合物5对人子宫颈癌HeLa能产生较强的抑制活性,其IC50值为4.57 μmol/L,弱于顺铂3.65 μmol/L。研究结果表明,间三氟甲基苯甲酰基引入后,6h可以抑制MCF-7细胞的增殖活性。
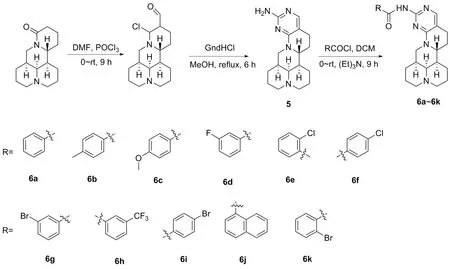
图6 化合物5和化合物6a~6k苦参碱14-位结构修饰路线
2018年,LI等[25]用槐定碱为先导化合物,设计合成了23个吲哚类苦参碱衍生物。用肝癌细胞HepG2细胞系做体外细胞活性实验,喜树碱做阳性对照药。结果表明,在23种化合物中都显示出对肝癌细胞HepG2有效的抗增殖活性,其IC50值均小于10 μmol/L。化合物7w对HepG2细胞的IC50值为0.92 μmol/L,在所有新合成化合物中活性最优,优于IC50值为1.36 μmol/L的喜树碱。
接着,用7w对5种癌细胞系SMMC-7721、 Hela、 CNE1、 CNE2和MCF-7做进一步研究。结果发现,化合物7w的IC50值在1.32 μmol/L~1.89 μmol/L范围内,远低于槐定碱。实验结果表明,化合物7w对5种癌细胞均有抑制作用。在14-位上引入N-苄基吲哚基团后,槐定碱有明显的抗肿瘤活性(图7)。
2018年,HUANG等[26]研究发现苦参碱具有抗病毒作用,用苦参碱半合成了12种苦参碱衍生物(图8),分别为14-甲酰基-15-芳氧基/甲氧基苦参碱(8a~8j)和14-芳氧甲基苦参碱(8k,8l)。用AZT为阳性对照,和对照相比,所有苦参碱衍生物均表现出抑制性能,化合物8c,8e~8g和8j具有较强的抗HIV-1活性,EC50(50%有效浓度)分别为15.41 μg/mL、 10.52 μg/mL、 2.75 μg/mL、 5.40 μg/mL和1.79 μg/mL,治疗指数(TI)值分别为13.0、 19.0、 33.7、 14.5和98.2。化合物8j具有较好的抗HIV-1活性,EC50(50%有效浓度)为1.79 μg/mL,治疗指数(TI)为98.2,抗HIV活性最好。研究发现,苯环上的甲基和萘环上的14-甲酰基苦参碱-15-氧的位置对其活性有重要影响。

图8 化合物8a~8l苦参碱14-位结构修饰路线
2021年,WEI等[27]用苦参碱为原料设计并合成了8个含噻吩基团的苦参碱衍生物(图9,9a~9h)。检测8种化合物对鼻咽癌(NPC)细胞系(CNE2、 HONE1和HK-1)和顺铂耐药鼻咽癌细胞CNE2/CDDP的细胞活性。结果表明,化合物9f在NPC和NPC/CDDP耐药细胞中表现出最显著的增殖抑制效果,其IC50值在30 μmol/L到100 μmol/L之间,说明化合物9f比母体化合物苦参碱拥有更好的抗增殖作用。为了进一步研究,以BCL-W为靶点进行分子对接实验,对接结果表明,化合物9f对BCL-W亲和力最强,由此可见,化合物9f可能通过抑制抗凋亡蛋白BCL-W发挥作用。
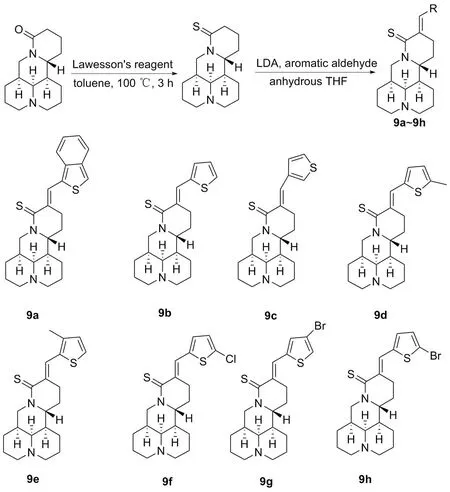
图9 化合物9a~9h苦参碱15位结构修饰路线
2019年,敬德旺等[28]用苦参碱为原料药合成了9种新型的15-N-取代苦参碱亚胺衍生物(图10,10a~10i),筛选了9种新化合物在人肝癌细胞HepG2和人宫颈癌细胞HeLa中的细胞活性,并以喜树碱为阳性对照药。结果显示,化合物10d对人肝癌细胞HepG2和人宫颈癌细胞HeLa的IC50值为11 μmol/L和23 μmol/L,化合物10e对人肝癌细胞HepG2和人宫颈癌细胞HeLa的IC50值小于50 μmol/L。研究发现,在苦参碱15位引入N-4-联苯基团的化合物10d和N-4-苯氧基苯基团10e对HepG2和HeLa的抑制活性有显著提高,具有进一步研究价值。
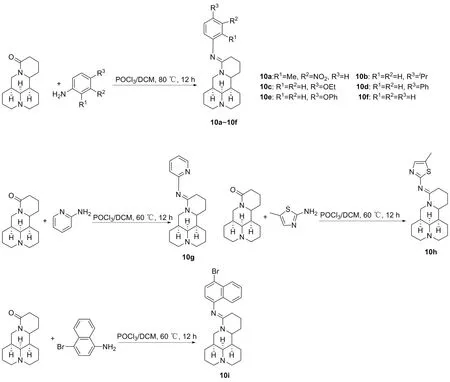
图10 化合物10a~10i苦参碱15-位结构修饰路线
2021年,张晓雯等[29]以苦参碱为原料,经水解开环合成了9个1,2,3-三氮唑类苦参碱衍生物(图11,13a~13i)。选用人宫颈癌细胞HeLa、人乳腺癌细胞MCF-7和人肝癌细胞HepG2做体外抗肿瘤活性实验,并用苦参碱和依托泊苷做阳性对品。研究结果表明,化合物13h对MCF-7肿瘤细胞表现出良好的活性,抑制率为18.2%,且活性优于对照品化合物苦参碱。化合物13g对人肝癌细胞HepG2有较好的抗肿瘤活性,抑制率为65.6%,优于阳性对照化合物。

图11 化合物13a~13i苦参碱D环开环结构修饰路线
2016年,WU等[30]分别以苦参碱为原料合成了17种带有苯并-α-吡喃酮结构苦参碱衍生物(图12,14a~14q)。同时,选用A549(肺癌细胞)、MCF-7(乳腺癌细胞)、SGC-7901(胃癌细胞)和Bel-7402(肝细胞癌细胞)4种细胞系进行活性测试。实验结果表明,大部分衍生物对肿瘤细胞的抑制作用增强,其IC50值是苦参碱的15~484倍。其中化合物14i活性最优,对4种细胞系的IC50值分别为8.10μmol/L、 7.30 μmol/L、 9.40 μmol/L和7.60 μmol/L。研究人员选用化合物14i对肺癌进行深入研究,实验结果发现,化合物14i可通过上调P27,下调CDK4和cyclinD1,减弱PI3K/AKT/mTOR通路,诱导肺癌细胞G1周期阻滞和自噬,以有效抑制肺癌细胞增殖。

图12 化合物14a~14q苦参碱D环开环结构修饰路线
本文综述了167种苦参碱衍生物及药理活性,多数围绕抗肿瘤方向展开。并找到抗肿瘤活性优良的硫代苦参碱,13-羟乙胺苦参碱,13-酰胺基取代苦参碱,含噻吩基团的苦参碱,苯并-α-吡喃酮结构的苦参碱衍生物。另外,研究发现:苦参碱衍生物也具有生物杀虫活性。目前,虽然合成了大量的苦参碱衍生物,但其活性仍然停留在体外活性实验阶段,其水溶性强而脂溶性差的特性亟待解决。苦参碱衍生物通常需要经过多步的合成反应,合成成本相对较高且制备工艺复杂。一些苦参碱衍生物容易被氧化或降解,药物的稳定性较差,毒副作用明显。苦参碱类衍生物因其众多的药理活性以及成药潜力引起了广大学者的关注。为了改善苦参碱衍生物的药理活性和稳定性,通过拼合原理对苦参碱13位,14位和15位D环进行结构修饰,增加脂溶性基团,改善脂溶性,提高生物利用度。苦参碱类衍生物具有多种作用机制,有巨大的挖掘潜力。近几年,人工智能在生物医药行业快速发展,解决了传统药物开发过程中存在的高成本和低效率问题。通过计算机辅助药物设计[31]筛选具有高效低毒特异性靶标,作用时间久的新型苦参碱类药物,可提高药物的安全性和有效性。

