免疫检查点靶向小分子PET探针的制备及表征
梁蓓蓓, 李惠蓉, 徐 梁, 方 晶, 林建国, 邱 玲*
(1. 温州医科大学 基础医学院,浙江 温州 325035; 2. 江苏省原子医学研究所 国家卫生健康委员会核医学重点实验室 江苏省分子核医学重点实验室,江苏 无锡 214063)
近年来,肿瘤免疫治疗取得了重大突破,已有多种靶向程序性细胞死亡蛋白-1(Programmed cell death 1, PD-1)及其配体-1(Programmed cell death ligand 1, PD-L1)的抗体药物在国内外批准上市并取得显著的疗效,如Nivolumab、 Pembrolizumab、 Cemiplimab、 Durvalumab和Atezolizumab等[1-3]。然而,PD-1/PD-L1抑制剂在临床应用中存在一定的局限性,未经筛选的患者中仅有10%~30%可以从中获益,但在PD-L1阳性患者中的响应率明显高于阴性患者[4-6]。因此,准确筛选能够从PD-1/PD-L1免疫检查点阻断治疗中获益的肿瘤患者具有重要的临床意义。
目前临床上主要通过免疫组织化学(Immunohistochemistry, IHC)方法检测肿瘤PD-L1的表达水平。但免疫组化存在显著的局限性,只能通过活检取样进行检测。由于肿瘤内和肿瘤间存在异质性,检测结果也只能反映取样部位PD-L1的表达水平,无法反映患者整体PD-L1的表达情况[7]。此外,在肿瘤进展过程中,PD-L1的表达情况是动态变化的,免疫组化难以动态监测免疫治疗过程中PD-L1表达水平的变化情况[8]。正电子发射断层扫描(Positron emission tomography, PET)作为一种新型成像技术,具有高灵敏度、高特异性、高安全性、高均匀度和全身显像等优势,可以无创、动态、全身地检测PD-L1在肿瘤细胞及肿瘤微环境中的表达水平[9]。 2015年,百时美施贵宝公司公布了一类联苯类的小分子PD-1/PD-L1抑制剂,MIAO等[10]在此结构基础上设计了小分子探针[18F]LN, PET显像结果发现,[18F]LN可以区分不同PD-L1表达的肿瘤,但在肝脏等正常器官中的摄取较高,导致其显像效果不佳。LV等[11]在此基础上设计了新的PD-L1靶向的小分子探针[18F]LG-1,保留了与PD-L1结合的母核结构,引入[18F]FDG糖基化基团,提高了探针的亲水性。PET显像结果与[18F]LN相比,[18F]LG-1在非靶器官的摄取降低,获得了较高对比度的图像。
考虑到小分子探针具有肿瘤穿透性好、组织摄取快和显像快等优点,而金属离子螯合剂NOTA具有良好的水溶性,且仅需一步反应就可完成放射性标记,具有耗时短、操作简单方便且不需要半制备纯化等优势。因此,本研究以联苯甲基芳基醚核心结构为靶向基团,在分子结构的溶剂作用区引入NOTA基团,利用正电子核素68Ga和18F进行放射性标记,成功获得2个PET分子探针[68Ga]NOTA-LP和[18F]AlF-NOTA-LP,并对其生物学性质进行初步研究。
1 实验部分
1.1 仪器与试剂
Quintix35-1CN型十万分之一分析电子天平; DF-101Z型油浴锅; 1525泵型高效液相色谱仪; 2545泵型半制备高效液相色谱仪; Freezone6L型真空冷冻干燥机; H7型回旋加速器; IGG-100型68Ga/68Ge发生器; 2470Wizard型γ计数器。
N,N-二甲基甲酰胺(DMF)和N,N-二异丙基乙胺(DIPEA)购自安耐吉化学(上海)有限公司。2,2′-(7-(2-((2,5-二氧吡咯烷-1-基)氧基)-2-氧乙基)-1,4,7-三氮烷-1,4-二基)二乙酸(NOTA NHS)购自西安齐岳生物科技有限公司。醋酸钠(分析纯)、醋酸(分析纯)、氯化铝(AlCl3,分析纯)、碳酸氢钠(分析纯)、正辛醇(分析纯)和乙腈(HPLC级)购自国药集团化学试剂有限公司。
1.2 前体NOTA-LP的合成
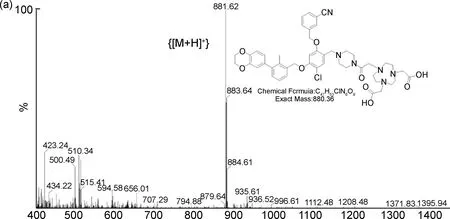
根据之前报道的方法合成化合物4(LP1)[10-12],称取化合物LP1(10.00 mg, 0.17 mmol)与NOTA NHS(16.00 mg, 0.04 mmol),溶于2 mL DMF中,加入DIPEA调节pH至8~9,室温下反应3 h。反应结束后,使用半制备高效液相进行分离纯化,得到白色固体NOTA-LP(图1, 7.00 mg,产率47.28%);1H NMR(500 MHz, DMSO-d6)δ:8.02(s, 1H), 7.88(d,J=7.9 Hz, 1H), 7.85(d,J=7.7 Hz, 1H), 7.64(t,J=7.8 Hz, 1H), 7.56(s, 1H), 7.45(d,J=7.3 Hz, 1H), 7.26(t,J=7.5 Hz, 1H), 7.20(d,J=5.4 Hz, 1H), 7.19(s, 1H), 6.93(d,J=8.2 Hz, 1H), 6.78(d,J=1.7 Hz, 1H), 6.75(dd,J=8.2 Hz, 1.8 Hz, 1H), 5.35(s, 2H), 5.28(s, 2H), 4.29(s, 4H), 4.08(s, 2H), 3.62(s, 4H), 3.39(s, 6H, overlapped), 2.54(s, 8H, overlapped), 2.50(s, 8H), 2.25(s, 3H);13C NMR(126 MHz, DMSO-d6)δ:171.73, 165.85, 156.77, 156.74, 142.99, 142.56, 141.73, 138.18, 134.76, 134.33, 134.17, 132.62, 131.92, 131.28, 129.95, 129.87, 129.66, 127.74, 125.56, 122.13, 118.72, 118.42, 117.72, 116.85, 116.04, 111.60, 100.39, 69.76, 69.23, 64.14, 64.12, 54.57, 54.50, 50.44, 49.04, 47.84, 42.12, 15.93; ESI-MSm/z:calcd for C47H53ClN6O9{[M+H]+}881.36, found 881.62。
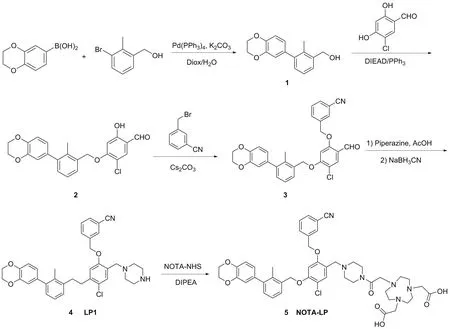
图1 前体NOTA-LP的合成路线
1.3 探针[68Ga]NOTA-LP和[18F]AlF-NOTA-LP的放射性标记
探针[68Ga]NOTA-LP的合成:68GaCl3由68Ge/68Ga发生器获得,取1.4 mL68GaCl3溶液(129.5 MBq),加入醋酸钠溶液(0.25 M)调节pH至4.0,加入20 μL前体NOTA-LP(2 μg/μL),振荡混匀,37 ℃孵育15 min。用Sep-Pak light C18固相萃取柱吸附[68Ga]NOTA-LP,用纯水洗涤以去除游离的68Ga3+,用1 mL盐酸乙醇溶液(10 mM)将探针[68Ga]NOTA-LP从Sep-Pak light C18固相萃取柱上洗脱至装有20 μL饱和碳酸氢钠的西林瓶中,即可得到高放射化学纯度的[68Ga]NOTA-LP。
探针[18F]AlF-NOTA-LP的合成:[18F]HF是以[18O]H2O为靶材料,通过18O(p,n)18F反应获得。取6 μL AlCl3溶液(2 mM)、 10 μL醋酸和544 μL乙腈,加入100 μL [18F]靶水(736.3 MBq)和10 μL前体NOTA-LP(2 μg/μL),振荡混匀,100 ℃反应15 min。用Sep-Pak light C18固相萃取柱富集探针[18F]AlF-NOTA-LP,用纯水洗去18F离子,用1 mL盐酸乙醇溶液(10 mM)将产物[18F]AlF-NOTA-LP洗脱至西林瓶中,即可得到高放射化学纯度的[18F]AlF-NOTA-LP。
1.4 体外稳定性的测定
将40 μL探针[68Ga]NOTA-LP和[18F]AlF-NOTA-LP与360 μL磷酸盐缓冲溶液(PBS)或小鼠血清(Serum)混合,在37 ℃下分别孵育1 h、 2 h和4 h,每个时间点孵育结束后取样,使用Radio-HPLC对其放射化学纯度进行检测。
1.5 脂水分配系数的测定
取1μL探针[68Ga]NOTA-LP和[18F]AlF-NOTA-LP,分别加入1 mL正辛醇和1 mL去离子水,充分震荡混匀,高速离心使两相分离,从两相各取0.5 mL溶液,使用γ计数器检测其放射活度。第1次测试结束后,补加正辛醇和去离子水各0.5 mL,再次震荡混匀,重复上述操作2次。LogP=Log(Co/Cw),其中Co表示探针在正辛醇相的放射活度值,Cw表示探针在水相中的放射活度值。
1.6 细胞摄取研究
人恶性黑色素瘤细胞系(A375)和人PD-L1基因转染的高表达恶性黑色素瘤细胞系(A375-hPD-L1)均由苏州智核生物科技有限公司提供,小鼠黑色素瘤细胞系(B16-F10)和小鼠结肠癌细胞系(MC38)均购自中国科学院细胞库。取对数生长期状态良好的肿瘤细胞进行细胞摄取实验。前期研究中已有免疫印迹实验证实A375-hPD-L1细胞PD-L1的表达水平明显高于A375细胞[13], B16-F10细胞和MC38细胞均为鼠源高表达PD-L1的细胞系[14]。细胞摄取实验分为A375-hPD-L1阳性组、A375-hPD-L1阻断组、A375阴性组、B16-F10阳性组和阻断组以及MC38阳性组和阻断组,每组设置3个平行组。将细胞置于放免管中(每管1×106个),阻断组加入50 μM前体NOTA-LP,其他组加入等体积的培养基,震荡混匀后在37 ℃下孵育30 min。孵育结束后每管加入0.037 MBq探针,震荡混匀,37 ℃下分别孵育30 min、 60 min和120 min。孵育结束后,加入500 μL冷PBS缓冲液(pH=7.4, 10 mM)终止摄取,高速离心5 min,吸弃上清液,重复1次,用γ计数器检测样品的放射活度值,细胞摄取结果以细胞内的放射活度与总剂量的放射活度的比值表示(%AD)。
2 结果与讨论
2.1 前体NOTA-LP的表征
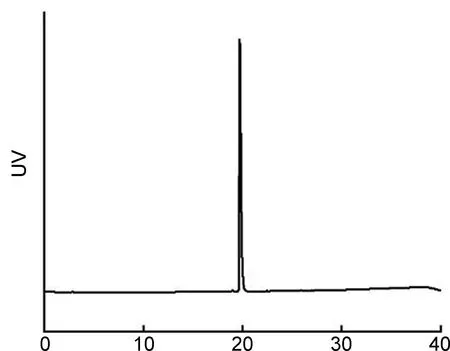
利用高效液相色谱对前体NOTA-LP的纯度进行表征,结果如图2所示,其纯度在95%以上,保留时间为19.7 min。ESI-MS结果如图3(a)所示,前体NOTA-LP的精确相对分子质量为880.36,质荷比为881.62的离子峰为前体NOTA-LP的准分子离子峰{[M+H]+}。通过1H NMR和13C NMR进一步验证了前体NOTA-LP结构的正确性,结果如图3(b~c)所示。
Time/min
m/z
2.2 探针[68Ga]NOTA-LP和[18F]AlF-NOTA-LP的放射性标记及体外稳定性
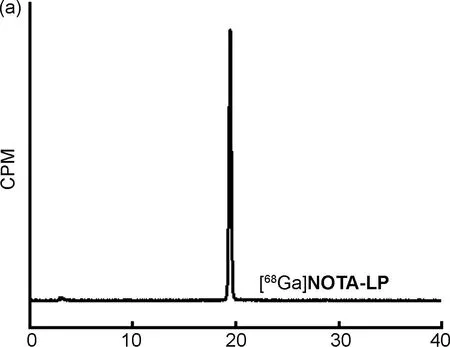
螯合剂NOTA可以与金属离子发生络合,仅需一步反应就可完成放射性标记,具有耗时短、操作简单方便和不需要半制备纯化等优势。利用正电子核素68Ga和18F分别对前体NOTA-LP进行放射性标记,结果如图4~5所示,仅需30 min即可完成实验操作,获得分子探针[68Ga]NOTA-LP和[18F]AlF-NOTA-LP,摩尔活度分别为3.60 GBq/μmol和15.8 GBq/μmol,放射化学产率分别为39.3±4.8%和21.9±8.6%,二者的放射化学纯度均高于95%。

图4 探针[68Ga]NOTA-LP和[18F]AlF-NOTA-LP的放射性合成路线
Time/min
考虑到探针的稳定性可能会对其生物活性造成影响,本研究将探针[68Ga]NOTA-LP和[18F]AlF-NOTA-LP分别与PBS和小鼠血清孵育1 h、 2 h和4 h,然后利用Radio-HPLC对其放射化学纯度进行分析,结果如图6~7所示,在PBS和小鼠血清中孵育4 h后,2个探针的放射化学纯度仍大于95%,表明2个探针的稳定性良好,可用于后续的生物学性质研究。

Time/min

Time/min
2.3 脂水分配系数的测定
探针的脂水分配系数通常会对其在体内的药代动力学行为产生影响。本文在联苯类PD-L1小分子抑制剂的结构基础上引入NOTA基团,以期增强其亲水性,降低探针在肝脏等非靶器官的摄取。实验测得[68Ga]NOTA-LP的LogP为1.53±0.04, [18F]AlF-NOTA-LP的LogP为2.04±0.13。虽然与联苯类的母核结构相比,亲脂性得到降低,但与其他应用于临床研究的PD-L1靶向PET探针相比,如68Ga-NOTA-WL12和18F-NOTA-NF12[15-16],仍具有较强亲脂性,可能在一定程度影响探针PET显像的肿瘤背景比。
2.4 细胞摄取研究
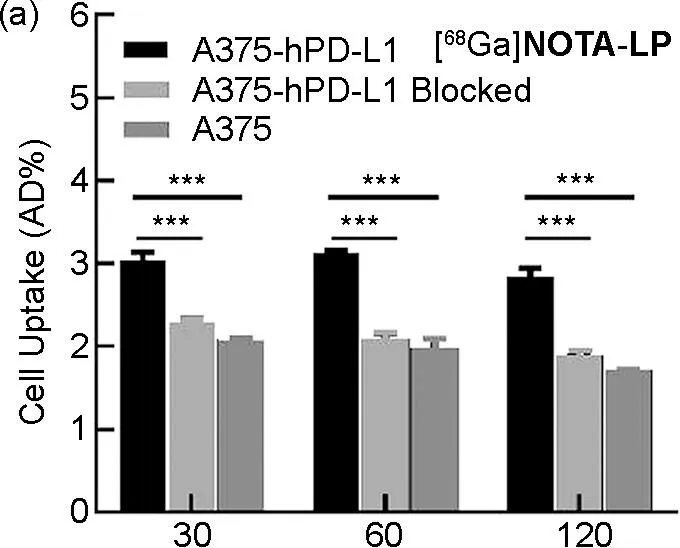
细胞摄取结果如图8所示,PD-L1转染高表达的人源恶性黑色素瘤细胞A375-hPD-L1对探针[68Ga]NOTA-LP和[18F]AlF-NOTA-LP的摄取值在孵育60 min后达到最大值(3.12±0.02%AD和3.04±0.11 %AD),高于PD-L1低表达的A375细胞(1.98±0.11 %AD和1.74±0.04 %AD),高于A375-hPD-L1细胞经前体NOTA-LP阻断的摄取(2.01±0.08 %AD和1.93±0.02 %AD),表明探针可区分不同PD-L1表达水平的细胞。PD-L1高表达的鼠源黑色素瘤细胞系B16-F10细胞与探针[68Ga]NOTA-LP和[18F]AlF-NOTA-LP孵育60 min后,摄取值(3.01±0.12 %AD和2.80±0.12 %AD)明显高于前体NOTA-LP阻断组(1.90±0.06 %AD和1.55±0.07 %AD)。在孵育60 min后,PD-L1高表达的鼠源结肠癌细胞系MC38细胞对探针[68Ga]NOTA-LP和[18F]AlF-NOTA-LP的摄取值(2.90±0.10 %AD和3.05±0.17 %AD)也明显高于前体NOTA-LP阻断组(2.00±0.08 %AD和1.80±0.04 %AD),表明探针对PD-L1具有较好的靶向特异性。
Time/min
本文设计合成了对PD-L1具有高亲和力的化合物NOTA-LP,利用68Ga和18F进行放射性标记,可在短时间内方便快速获得2个PET分子探针[68Ga]NOTA-LP和[18F]AlF-NOTA-LP。 2个探针都具有较高的放射化学纯度,且在PBS和小鼠血清中表现出良好的稳定性,可以在细胞水平上对PD-L1的表达水平进行检测。该类放射性探针标记方法简便、理化性质良好,为进一步深入其研究生物学性质提供了坚实的基础。

