松果菊苷对动脉粥样硬化血管钙化小鼠Wnt/β-连环蛋白信号通路的影响
袁媛 贾哲睿 王晨皓 刘涛 赵军 何丽娟 陶宁 由淑萍
动脉粥样硬化(atherosclerosis,AS)作为心血管病变的重要临床病理变化之一,严重危害人类健康。血管钙化在AS 中普遍存在,目前认为钙化是一个由细胞控制且可主动调节的过程[1],类似骨发育和骨质疏松的过程,其出现和发展与炎症、脂质堆积、氧化应激等因素有关[2]。在多种信号通路中,Wnt/βcatenin 信号通路在AS 的发生发展中起到了重要的作用。活化的内皮和血管成纤维细胞是AS 进程中骨形态发生蛋白2(bone morphogenetic protein-2,BMP-2)等分子产生的主要来源,高表达的BMP-2 引起血管钙化的发生[3]。其中,BMP-2 通过上调成骨转录因子Msx2,促进多种Wnt 配体(如Wnt3a)的产生,减少了内源性抑制剂DKK1 的生成,导致Wnt 信号通路增强[4]。松果菊苷(echinacoside,ECH)是管花肉苁蓉的主要活性成分[5],具有广泛的药理作用,包含抗氧化应激、抗细胞凋亡及抗炎等[6-8]。近来研究者发现ECH 具有心血管保护活性[9],本课题组前期研究亦发现此作用[10]。因此,本研究拟探究松果菊苷对AS 血管钙化小鼠Wnt/β-连环蛋白(β-catenin)信号通路的影响,现将结果报道如下。
1 对象和方法
1.1 实验动物 选择7 周龄健康ApoE-/-雄性小鼠48只,体质量20~22 g,购于江苏集萃药康公司,合格证号:SCXK(新)2018-0003。均于新疆医科大学动物实验中心SPF级条件下饲养。本研究经新疆医科大学动物实验医学伦理委员会审查通过(批准文号:IACUC-20210617-01)。
1.2 药物、试剂与仪器 ECH(纯度≥98%,批号:N25GB168967)购于上海源叶生物科技有限公司;辛伐他汀片(simvastatin tablets,Sta,规格:20 mg/片,国药准字:J20180007)购于美国Merck Sharp 公司;高脂饲料(批号:210709)购于江苏美迪森生物医药有限公司;TC(批号:A111-1-1)、TG(批号:A110-1-1)、HDL-C(批号:A112-1-1)、LDL-C(批号:A112-1-1)测定试剂盒购于南京建成科技有限公司;总RNA 提取试剂盒(total RNA extractor,Trizol,批号:267309)购于美国Invitrogen 公司;PCR 引物合成于上海生工生物工程有限公司;荧光定量(批号:AL51019A)、反转录试剂盒(批号:AL50948A)购于日本Takara 公司;抗鼠/兔通用型免疫组化试剂盒(批号:20030278)、Wnt3a(批号:26744-1-AP)、β-catenin(批号:17565-1-AP)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)(批号:10494-1-AP)兔单克隆抗体、辣根过氧化物酶标记的山羊抗兔IgG 抗体(批号:20000373)购于武汉三鹰生物技术有限公司;LRP5(批号:85c5505)兔单克隆抗体购于美国Affinity 公司;BMP-2(批号:R01213885)购于沈阳万类生物科技有限公司;RIPA 裂解液(批号:2020928)、蛋白酶抑制剂(批号:20210927)、二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒(批号:20210901)购于北京索莱宝科技有限公司;ECL 显色液(批号:22346507)购于Biosharp 公司;Eclipse Ni-U 显微镜购于日本Nikon 公司;移液器、低温离心机(型号:5424R)购于德国Eppendorf 公司;全波长功能酶标仪(型号:Multiskan GO)、荧光定量PCR 仪(型号:ABI QuantStudio 6Flex)购于购于美国Thermo Fisher 公司;全自动紫外线分光光度计(型号:ND2000)购于北京基因有限公司;电泳和转膜装置(型号:Cavoy PowerPac HC+Mini-PR)购于上海臻诺生物科技有限公司;凝胶成像仪(型号:Cel-DocXR)购于美国Bio-rad 公司。
1.3 实验方法
1.3.1 动物分组与处理 根据参考文献[11]通过基因打靶技术制备小鼠AS 模型。将小鼠经过1 周的适应性喂养后采用随机数字表法分为6组,每组8只:分别为模型组、ECH 12.5、25、50 mg/kg 组、Sta 组和对照组。ECH 12.5、25、50 mg/kg 组和Sta 组给予高脂饲料造模(含19.97%的无水乳脂,0.15%的胆固醇),对照组给予基础饲料。从高脂饮食喂养的第1天开始,模型组、对照组每日灌胃相同体积的0.5%羧甲基纤维素钠(carboxymethylcellulose sodium,CMC-Na)溶液,ECH 各剂量组及Sta组每日按设定剂量灌胃给予ECH或Sta,连续给药16周后处死小鼠,进行血清收集及主动脉取材。
1.3.2 检测标本采集 造模末日小鼠禁食不禁水12 h后摘除眼球取血,置于EP 管内。然后断颈处死并打开腹腔,取出主动脉放入装有4%多聚甲醛液的离心管中固定48 h。
1.3.3 小鼠主动脉组织病理检查 将固定的小鼠主动脉脱水透明后用石蜡包埋,蜡块切成厚度为5 μm的组织切片并迅速固定在载玻片上,常规的HE 染色后在显微镜下观察并比较6 组小鼠主动脉的形态学变化。
1.3.4 小鼠血清生化检测 将EP 管内的血液以3 000 r/min,4 ℃离心30 min,吸出上清液分装新的EP管内,采用磷酸甘油氧化酶法测定TG 水平,采用胆固醇氧化酶法测定小鼠血清TC 水平,酶标仪直接法测定LDL-C 和HDL-C 水平。
1.3.5 小鼠主动脉β-catenin mRNA 的表达测定 采用实时荧光定量PCR 法,用含Trizol 的溶液提取小鼠主动脉的总RNA 后纯化(达到A260/A280=1.8~2.0)。采用反转录试剂盒合成cDNA,取1 μL 产物进行扩增,10 μL 反应体系,扩增条件为:95 ℃、30 s;95 ℃、5 s,60 ℃、34 s,40 个循环,重复3 次。PCR 运行结束后读取CT 值,以2-ΔΔCt法分析β-catenin mRNA 的相对表达水平。引物序列:GAPDH:F(5'-GGTTGTCTCCTGCGACTT-CA-3'),GAPDH:R(5'-TGGTCCAGGGTTTCTTACTCC-3'),β-catenin:F(5'-GCTGCTGTCCTATTCCGAATG- TCTG-3'),β-catenin:R(5'-GGCACCAATGTCCAGTCCAAGATC-3')。
1.3.6 小鼠主动脉相关蛋白表达测定 采用Western blot 法检测β-catenin、Wnt3a、LDL 受体相关蛋白5(LDL receptor protein,LRP5)及BMP-2 蛋白表达水平。从-80 ℃冰箱中取冻存的小鼠主动脉组织放入预冷的研磨管内,根据称取的量加入一定比例裂解液,使用全自动样品快速研磨仪进行组织研磨,冰浴裂解30 min,4 ℃,12 000 r/min,离心15 min取上清液。根据BCA 法检测总蛋白浓度;加入5 倍的上样缓冲液混匀后,100 ℃水浴加热变性10 min;于10%的十二烷基硫酸钠-聚丙烯酰胺凝胶上进行电泳(电压120 V,60 min),将蛋白转印至聚偏二氟乙烯膜上,300 mA 恒流电转70 min。5%脱脂奶粉于室温下封闭聚偏二氟乙烯膜2 h,进行一抗(β-catenin,1∶4 000、Wnt3a,1∶1 000、LRP5,1∶1 000、BMP-2,1∶1 000、GAPDH,1∶10 000)4 ℃下孵育过夜,清洗3 次后室温下孵育二抗1 h。凝胶成像仪拍照显色,分析条带灰度值。βcatenin、Wnt3a、LRP5 及BMP-2 蛋白表达水平=目的条带灰度值/内参条带灰度值×100%。
1.3.7 小鼠主动脉LRP5 蛋白表达测定 采用免疫组化法,组织包埋切片后,70 ℃烤片2 h,二甲苯和梯度乙醇进行脱蜡至水后放入pH=9.0 的抗原修复液微波修复15 min,自然冷却至室温,以3%H2O2阻断过氧化物酶,FBS 孵育,加入一抗,浓度为1∶50,4 ℃孵育过夜,加入二抗,37 ℃孵育30 min,滴加二氨基联苯胺显色,苏木素复染后采用盐酸乙醇分化,PBS 返蓝,自然晾干后用树胶封片,显微镜下观察切片并拍照保存。采用Image-pro-plus6.0 进行图像分析,以平均光密度值分析LRP5 蛋白表达水平。
1.4 统计学处理 采用SPSS 26.0统计软件。计量资料以表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 6 组小鼠主动脉组织形态学变化比较 模型组和ECH 12.5 mg/kg 组小鼠主动脉管腔壁厚度不均,内膜增厚明显,局部发生严重钙化,斑块明显突向管腔,组织弹力纤维排列紊乱,并伴有炎性细胞浸润。ECH 25、50 mg/kg 组及Sta 组中膜较模型组明显变薄,弹力纤维排列整齐,斑块明显缩小,对照组小鼠血管结构排列正常,主动脉内壁未发现明显的平滑肌细胞增生,管腔未见胆固醇结晶形成,见图1。
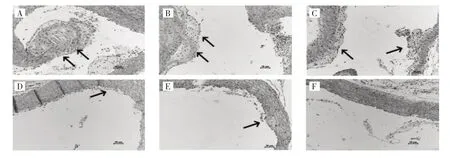
图1 6 组小鼠主动脉组织形态学变化的比较(A:模型组;B:ECH 12.5 mg/kg 组;C:ECH 25 mg/kg 组;D:ECH 50 mg/kg 组;E:Sta 组;F:对照组)
2.2 6 组小鼠血生化指标的比较 6 组小鼠的血生化指标比较,差异均有统计学意义(均P<0.01),其中模型组小鼠的TG、TC 及LDL-C 水平均高于对照组,HDLC 水平低于对照组,差异均有统计学意义(均P<0.01),ECH 25、50 mg/kg 组和Sta 组TG 水平均低于模型组,差异均有统计学意义(均P<0.01);ECH 12.5、25、50 mg/kg 组和Sta 组TC 水平均低于模型组,差异均有统计学意义(均P<0.01);ECH 12.5、25、50 mg/kg 组和Sta 组LDL-C 水平均低于模型组,差异均有统计学意义(均P<0.01);ECH 12.5、25、50 mg/kg 组和Sta 组HDLC 水平均高于模型组,差异均有统计学意义(均P<0.001),见表1。
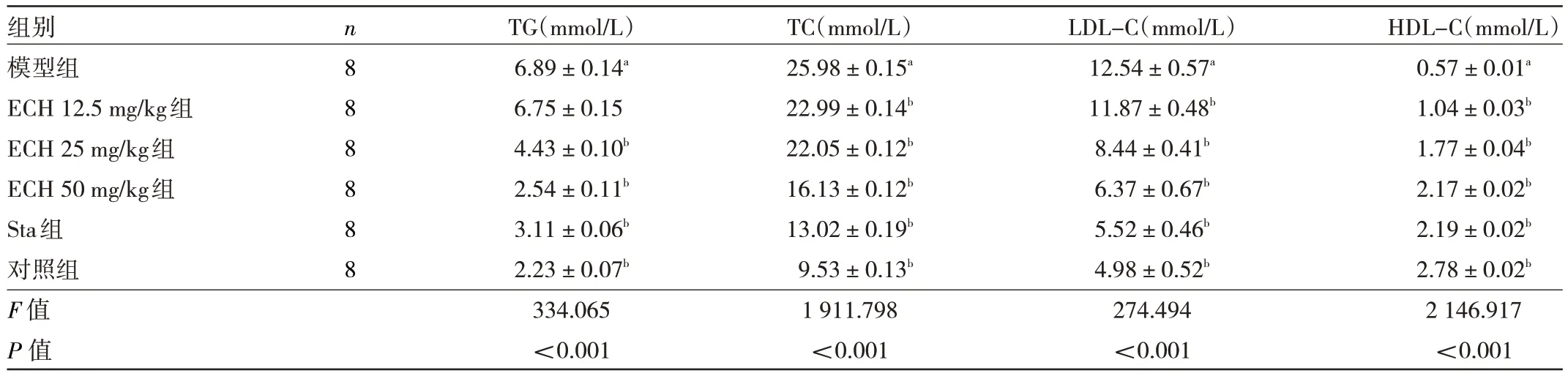
表1 6 组小鼠血生化指标的比较
2.3 6 组小鼠主动脉β-catenin mRNA 的比较 6 组小鼠主动脉β-catenin mRNA 表达水平分别为2.01±0.11、1.68±0.05、1.35±0.07、1.01±0.06、0.86±0.05、0.82±0.03,差异有统计学意义(F=188.925,P<0.001)。其中模型组高于对照组,差异有统计学意义(P<0.05)。ECH 12.5、25、50 mg/kg 组及Sta 组均低于模型组,差异均有统计学意义(均P<0.05)。
2.4 6 组小鼠主动脉相关蛋白表达水平的比较 6 组小鼠主动脉相关蛋白表达水平差异均有统计学意义(均P<0.05),其中模型组小鼠主动脉β-catenin、Wnt3a、LRP5 及BMP-2 蛋白表达水平高于对照组,差异均有统计学意义(均P<0.01),ECH 25、50 mg/kg 组小鼠主动脉β-catenin、Wnt3a、LRP5 及BMP-2 蛋白表达水平均低于模型组,差异均有统计学意义(均P<0.05);Sta 组小鼠主动脉β-catenin、Wnt3a、LRP5 及BMP-2 蛋白表达水平亦低于模型组,差异均有统计学意义(t=24.334、12.108、17.506、22.536,均P<0.05),见表2 和图2。

表2 6 组小鼠主动脉相关蛋白表达水平的比较

图2 6 组小鼠主动脉相关蛋白表达的电泳图
2.5 6 组小鼠主动脉LRP5 蛋白表达水平的比较 6 组小鼠主动脉LRP5 蛋白表达水平分别为0.35±0.01、0.25±0.03、0.17±0.03、0.15±0.02、0.16±0.03、0.07±0.01,差异有统计学意义(F=96.536,P<0.001)。其中模型组小鼠高于对照组,差异有统计学意义(P<0.05)。ECH 12.5、25、50 mg/kg 组及Sta 组均低于模型组,差异均有统计学意义(均P<0.001),免疫组化检测结果见图3。
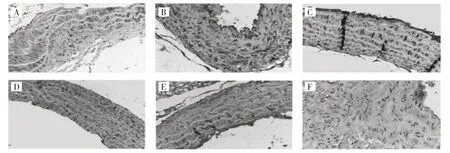
图3 6 组小鼠主动脉LRP5 蛋白表达免疫组化检测所见(A:模型组;B:ECH 12.5 mg/kg 组;C:ECH 25 mg/kg 组;D:ECH 50 mg/kg组;E:Sta 组;F:对照组)
3 讨论
血管钙化被认为是AS 的自然进展过程,在临床上是AS 的标志。而目前对血管钙化的防治效果不尽人意,因此探索新的血管钙化防治药物尤为重要。ECH在心血管等方面的药理作用得到了广泛关注,如具有清除自由基损伤、抗炎及免疫调节等生物活性。
脂质代谢紊乱对AS 的发生与发展起决定性作用,血清中氧化型LDL(oxidized low density lipoprotein,OXLDL)的升高,HDL-C 降低,易于沉积在血管壁上,逐步演化为斑块,最终导致AS 发生,因此对血脂水平的有效调控是预防AS 的重点工作,但是AS 发生后并不止步于此,血管平滑肌细胞中BMP-2 的大量表达激活了Wnt 信号通路并驱动成骨程序,加速了AS 血管钙化的进一步发展。
本研究所采用的小鼠因其血脂代谢功能存在异常,可诱发多余的脂质在血管内堆积,从而自发形成动AS 斑块,通过高脂饲养可加快其血管内斑块的形成。HE 结果显示,模型组和ECH 12.5 mg/kg 组小鼠主动脉管腔壁厚度不均,内膜增厚明显,局部发生严重钙化,斑块明显突向管腔,组织弹力纤维排列紊乱,并伴有炎性细胞。ECH 25、50 mg/kg 组及Sta 组中膜较模型组明显变薄,弹力纤维排列整齐,斑块明显缩小,对照组小鼠血管结构排列正常,主动脉内壁未发现明显的平滑肌细胞增生,管腔未见胆固醇结晶形成,表明中、高剂量的ECH 对小鼠主动脉有一定的保护作用。经过ECH 干预之后,血清中TG、TC、LDL-C 表达水平低于模型组,HDL-C 表达水平高于模型组,提示ECH干预后能显著逆转AS 的脂质异常。以上结果显示,随给药物浓度的增加,ECH 的作用效果增加,且呈现出剂量依赖的关系,其中ECH 25、50 mg/kg 组对AS 小鼠有明显的保护作用。
Wnt 信号通路在血管钙化中的作用及其调控机制受到人们的广泛关注,参与细胞增殖、分化、迁徙和侵袭[12-14],Wnt3a、LRP5 和β-catenin 在已经发生钙化的主动脉瓣中有较高的表达[15],因此抑制该信号通路能够达到阻碍成骨细胞增殖和分化,降低成骨细胞矿化活性。本研究中,模型组小鼠主动脉β-catenin mRNA 表达水平高于对照组;ECH 12.5、25、50 mg/kg 组及Sta 组β-catenin 的mRNA 表达低于模型组,提示ECH 可以通过下调β-catenin 的表达来缓解AS 化造成的斑块沉积。在蛋白表达测定中模型组小鼠主动脉β-catenin、Wnt3a、LRP5 及BMP-2 蛋白的表达水平高于对照组,ECH 25、50 mg/kg 组小鼠主动脉β-catenin、Wnt3a、LRP5 及BMP-2 蛋白的表达水平低于模型组,随着剂量的增加,小鼠主动脉Wnt3a、β-catenin 及LRP5 蛋白相对表达量呈逐步降低趋势,提示ECH 可以通过下调β-catenin、Wnt3a、LRP5 及BMP-2 的表达来缓解血管钙化的发生发展。有研究表明Wnt 信号细胞膜外的Wnt相关配体(如Wnt3a)与低密度脂蛋白受体蛋白5/6、跨膜受体卷曲蛋白相结合,经过细胞质内的蓬乱蛋白与酪蛋白激酶1-α 进行信号传递,激活了由轴蛋白/结肠腺瘤性蛋白/糖原合成酶激酶3β 结合物,从而促使细胞质内聚集了大量β-catenin 且与T 细胞转录因子/淋巴增强因子结合后形成复合体,进一步激活了下游靶基因,从而促进转录和成骨细胞凋亡,减缓血管钙化的产物[16-17]。由此推测ECH 可能通过抑制Wnt 信号通路中的β-catenin、Wnt3a 与LRP5 从而对小鼠AS血管钙化有一定改善作用。
综上所述,本研究证明ECH 对小鼠AS 硬化血管钙化具有一定的保护作用,可能与其抑制Wnt3a信号通路胞外Wnt3a与LRP5相关蛋白形成的受体复合物的结合有关,从而为AS血管钙化的防控提供新的治疗药物。

