宫颈癌组织PCNA、Derlin-1表达与术前分期及术后复发转移的关系
王 冲 朱攀科 王雪玲 周口永善医院病理科,河南省周口市 461300
宫颈癌为女性第三大常见恶性肿瘤,在我国宫颈癌发病率仅次于乳腺癌,且发病群体逐渐年轻化,虽然增强宫颈癌筛查有利于诊断早期宫颈癌并及时给予治疗,但部分患者术后仍发生肿瘤复发转移,导致患者死亡。宫颈癌进展中肿瘤细胞增殖侵袭情况对患者治疗、预后、生存时间等均造成直接影响,临床治疗通常使用手术结合放化疗等方案,但术后存在肿瘤复发、淋巴结转移风险,因此需在术前进行评估,提前采取预防治疗措施,降低肿瘤复发转移风险,提高患者生存率[1-2]。在恶性肿瘤细胞侵袭转移过程中,部分细胞调节因子、生物活性介质参与其中,增殖细胞核抗原(PCNA)为脱氧核糖核酸(DNA)合成调控中重要核蛋白之一,参与多种恶性肿瘤的生长发展[3]。有研究发现,通过蛋白反应选择会影响肿瘤浸润、侵袭程度,内质网相关降解蛋白(Derlin-1)为内质网膜上跨膜蛋白之一,参与内质网应激反应引起的内质网相关性降解信号通路,为肺癌、乳腺癌等多种恶性肿瘤的靶向治疗研究要点[4]。为研究宫颈癌靶向治疗方案,本文分析宫颈癌组织PCNA、Derlin-1表达情况与术前分期及术后复发转移的关系,现将结果汇报如下。
1 资料与方法
1.1 一般资料 纳入2019年10月—2021年10月我院收治的82例宫颈癌患者的临床资料,随访1年,进行回顾性分析。纳入标准:确诊为宫颈癌[5];经术前活检、子宫切除手术等方式获取患者宫颈癌组织;均实施肿瘤切除手术治疗;病理标本及临床资料齐全。排除标准:术前进行放化疗等治疗;合并原发性、继发性其他恶性肿瘤;复发性宫颈癌。患者年龄31~64岁,平均年龄(47.13±7.89)岁;腺癌18例,鳞癌64例;分化程度:低分化34例,中高分化48例。本次研究为回顾性分析,已免去伦理审批。
1.2 方法 使用免疫组化法检测宫颈癌组织PCNA、Derlin-1表达情况:经活检、手术等收集82例宫颈癌患者宫颈癌组织制作组织标本,以10mmol/L柠檬酸盐缓冲液以高压加热将切片进行抗原修复,并消除内源性过氧化物酶活性,以10%山羊血清封闭1h后,分别滴加一抗,以4℃放置过夜,使用磷酸缓冲盐溶液(PBS)冲洗3次,与二抗反应后,再次以PBS冲洗3次,使用显色剂显色,使用蒸馏水冲洗,并复染细胞核,再次以蒸馏水冲洗,分别使用75%、85%、100%浓度酒精进行脱水封片,并使用显微镜观察染色情况。以染色细胞百分比>50%为阳性。
1.3 观察指标 比较术前不同分期、术后肿瘤复发与未复发、术后淋巴结转移与未转移患者的宫颈癌组织PCNA、Derlin-1表达阳性率;比较宫颈癌组织中PCNA阳性及阴性患者、宫颈癌组织中Derlin-1阳性及阴性患者1年内生存期。
1.4 统计学方法 应用SPSS22.0软件分析数据,计数资料以n(%)表示,采用χ2检验,生存期以Kaplan-Meier曲线描述,组间生存期比较采取Log Rank检验,以P<0.05为差异有统计学意义。
2 结果
2.1 术前不同分期宫颈癌组织PCNA、Derlin-1表达阳性率比较 Ⅱ期宫颈癌患者宫颈癌组织PCNA、Derlin-1表达阳性率显著高于Ⅰ期患者(P<0.05),见表1。
2.2 术后肿瘤复发与未复发宫颈癌组织PCNA、Derlin-1表达阳性率比较 术后肿瘤复发患者宫颈癌组织PCNA、Derlin-1表达阳性率显著高于未复发患者(P<0.05),见表2。
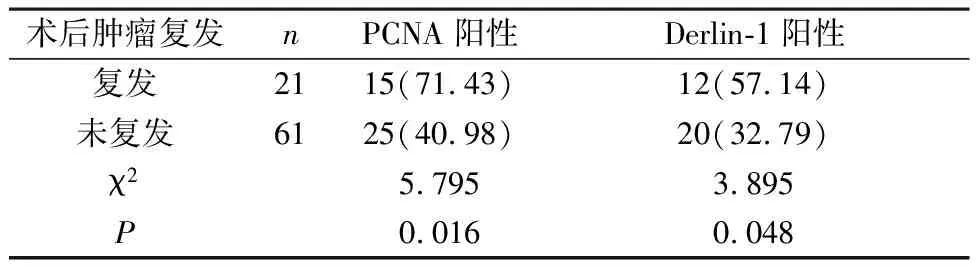
表2 术后肿瘤复发与未复发宫颈癌组织PCNA、Derlin-1表达阳性率比较[n(%)]
2.3 术后淋巴结转移与未转移宫颈癌组织PCNA、Derlin-1表达阳性率比较 术后淋巴结转移患者宫颈癌组织PCNA、Derlin-1表达阳性率显著高于未转移患者(P<0.05),见表3。
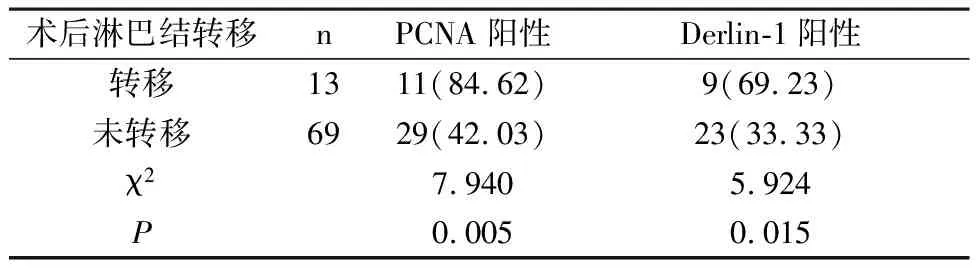
表3 术后淋巴结转移与未转移宫颈癌组织PCNA、Derlin-1表达阳性率比较[n(%)]
2.4 宫颈癌组织中PCNA阳性患者与阴性患者生存期比较 宫颈癌组织中PCNA阳性患者平均生存期为11.725个月(95%CI=11.485~11.965),阴性患者平均生存期为11.976个月(95%CI=11.930~12.022),比较差异无统计学意义(Log Rank χ2=3.134,P=0.077),见图1。
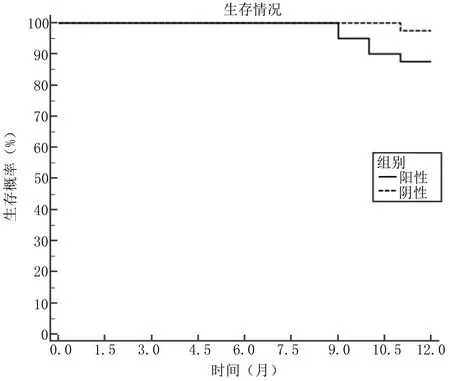
图1 宫颈癌组织中PCNA阳性患者与阴性患者生存期
2.5 宫颈癌组织中Derlin-1阳性患者与阴性患者生存期比较 宫颈癌组织中Derlin-1阳性患者平均生存期为11.750个月(95%CI=11.476~12.024),阴性患者平均生存期为11.920个月(95%CI=11.827~12.013),比较差异无统计学意义(Log Rank χ2=0.378,P=0.539),见图2。
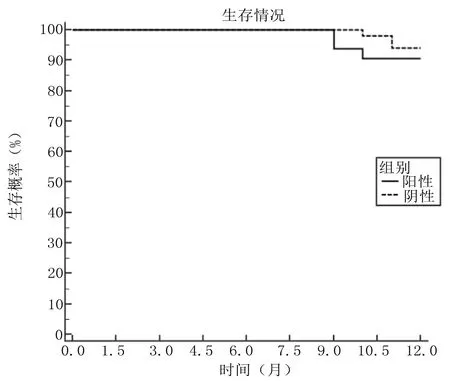
图2 宫颈癌组织中Derlin-1阳性患者与阴性患者生存期
3 讨论
宫颈癌发病率较高,随着宫颈癌筛查制度完善,宫颈癌及癌前病变可尽早发现并尽早治疗,有利于提高治愈率,延长患者生存时间,但在发展中国家,宫颈癌死亡率仍处于较高水平,且发病人群年龄逐渐降低,虽然很多宫颈癌患者在癌症早期得以发现,但术后宫颈癌易发生复发、淋巴结转移,为导致患者死亡的主要原因,因此临床需研究靶向治疗方向,以便于降低患者术后复发转移风险[6-7]。
宫颈癌发病过程较漫长,通常需经历长时间慢性炎症、细胞增生等多种阶段继而形成原位癌,而癌症发生与细胞增殖分化密切相关,因此与DNA合成等密切相关[8]。PCNA为一种在细胞核内部合成的蛋白质,参与S期DNA合成,其水平变化与DNA合成及细胞增殖过程抑制,而细胞无限增殖为恶性肿瘤发生机制之一,因此PCNA可用于评估肿瘤恶性程度及增殖能力[9]。有大量研究证实,PCNA参与乳腺癌、肝癌、子宫内膜癌等多种癌症的发生发展,且恶性肿瘤细胞增殖活性与肿瘤浸润程度、复发转移密切相关,因此影响患者预后情况[10]。本文中,Ⅱ期宫颈癌患者宫颈癌组织PCNA表达阳性率显著高于Ⅰ期患者;术后肿瘤复发患者宫颈癌组织PCNA表达阳性率显著高于未复发患者;术后淋巴结转移患者宫颈癌组织PCNA表达阳性率显著高于未转移患者,提示宫颈癌组织中PCNA阳性表达与宫颈癌术前分期、术后复发转移密切相关。究其原因,PCNA为细胞核内酸性蛋白质,包含261个氨基酸,PCNA在增殖细胞中,尤其在S期增殖细胞核内大量表达,细胞增殖过程中,PCNA表达先上升后下降,G1后期PCNA表达开始上升,并在S期时达到高峰表达,在G2~M期开始下降,可协调转换细胞周期阻滞、修复DNA,反映细胞增殖活跃程度,而恶性肿瘤细胞与正常组织细胞重要区别之一为恶性肿瘤细胞高度增殖,因此宫颈癌组织中PCNA均呈高表达,阳性率较高,随着宫颈癌恶化程度越高,分期越高,其肿瘤细胞增殖能力越强,PCNA阳性表达率越高,术后复发转移风险越高[11-12]。
内质网为真核细胞内重要细胞器之一,为蛋白质加工合成的重要场所,当内质网环境稳定被破坏时,蛋白质无法正常合成加工,错误蛋白质堆积在内质网中,引发内质网应激[13]。内质网应激为细胞防御反应的重要表现,也为细胞损伤、凋亡的重要机制。Derlin-1可将内质网内部错误蛋白质转运降解,与肿瘤发生发展密切相关。本文结果显示,Ⅱ期宫颈癌患者宫颈癌组织Derlin-1表达阳性率显著高于Ⅰ期患者;术后肿瘤复发患者宫颈癌组织Derlin-1表达阳性率显著高于未复发患者;术后淋巴结转移患者宫颈癌组织Derlin-1表达阳性率显著高于未转移患者,说明宫颈癌组织中Derlin-1阳性表达与宫颈癌术前分期、术后复发转移密切相关。原因在于,Derlin-1参与蛋白质逆向转运,而实体肿瘤在缺氧条件下,会引发内质网应激反应,达到保护肿瘤细胞、避免其凋亡的作用。有研究发现,Derlin-1在正常乳腺组织中几乎不表达,而在乳腺癌组织中高度表达,且与肿瘤分级、淋巴结转移密切相关。长时间人乳头瘤病毒(HPV)感染为引发宫颈癌的主要危险因素之一,病毒感染激发信号通路,引发内质网应激反应,内质网Derlin-1为候选癌基因,可能为泛素—蛋白质、自噬—溶酶体通路之间的分子,这两条蛋白质降解通路在内质网应激过程中具有协同作用,维持细胞正常增殖及稳定,而病毒感染会产生大量癌蛋白,在内质网聚集导致内质网应激,因此当Derlin-1高度表达时,说明存在大量癌蛋白,可辅助诊断宫颈癌,肿瘤恶化程度越高,侵袭能力、浸润程度越高,癌蛋白含量越高,因此宫颈癌组织中Derlin-1阳性表达[14-15]。
宫颈癌肿瘤分期、术后转移复发情况直接影响其生存率及生存时间。本文中,宫颈癌组织中PCNA阳性患者平均生存期为11.725个月(95%CI=11.485~11.965),阴性患者平均生存期为11.976个月(95%CI=11.930~12.022),比较差异无统计学意义(Log Rank χ2=3.134,P=0.077);宫颈癌组织中Derlin-1阳性患者平均生存期为11.750个月(95%CI=11.476~12.024),阴性患者平均生存期为11.920个月(95%CI=11.827~12.013),生存期比较差异无统计学意义(Log Rank χ2=0.378,P=0.539)。由于早期宫颈癌治愈率及5年生存率较高,而本次研究纳入病例数较少,且随访时间较短,因此宫颈癌组织中PCNA阳性与阴性患者、宫颈癌组织中Derlin-1阳性与阴性患者生存期比较无明显差异,临床可进一步扩大研究范围及随访时间,深入研究宫颈癌组织中PCNA、Derlin-1表达促进宫颈癌发展及术后复发转移的机制,为临床靶向治疗方案制定提供参考。
综上所述,不同术前分期、术后复发及未复发、术后淋巴结转移与未转移患者之间宫颈癌组织PCNA、Derlin-1阳性表达率存在明显差异,为临床诊治宫颈癌、预防术后复发转移提供病理学依据。

