基于生物信息学和实验探讨PDXK在肝脏肝细胞癌的表达及临床价值*
龙芳敏 陈祥凤 易三桂 李根亮
右江民族医学院 1 基础医学院 2 医学检验学院 3 生物医药与大健康现代产业学院,广西百色市 533000
肝脏肝细胞癌(Liver hepatocellular carcinoma,LIHC)是消化系统最常见的恶性肿瘤之一,发病率和病死率极高,病因复杂,发病机制尚不明晰[1]。目前对LIHC的治疗主要为药物疗法、手术切除和肝移植、化疗、放疗、免疫治疗法、经动脉放射栓塞疗法和射频消融等,尽管在诊断和治疗方面取得了进展,但总体预后不佳,复发率仍然很高,超过50%的患者出现复发和转移,3~6年内死亡;近年免疫检查点抑制剂对晚期肝癌表现出潜在的治疗效果,但受肝脏功能、免疫耐受性、肿瘤微环境、肝癌干细胞性等多方面影响,给肝癌治疗带来了挑战[2]。我国作为烟酒消费大国,国人的肝癌发病率长期居高不下,挖掘与肝癌诊疗及预后相关的关键基因对提高肝癌早期诊疗和预后评估仍具有重要临床价值。
吡哆醛激酶(Pyridoxal kinase,PDXK)是一种产生维生素B6生物活性形式的酶,目前发现PDXK在卵巢癌、非小细胞肺癌、肾上腺嗜铬细胞瘤中起着重要作用[3-5]。目前涉及PDXK在LIHC中的研究鲜有报道,且PDXK在LIHC中的表达、功能、作用机制仍未知。因此,本研究应用生物信息学方法和实验初步探讨PDXK在LIHC中的表达及临床价值。
1 材料与方法
1.1 材料 生物信息学分析数据集来源于Timer2.0数据库(http://timer.cistrome.org/)、UALCAN数据库(http://ualcan.path.uab.edu/)、HPA数据库(https://www.proteinatlas.org/)、STRING数据库(https://string-db.org/)、DAVID(http://david.ncifcrf.gov/home.jsp)。人肝癌细胞Bel7404由右江民族医学院肝癌重点实验室提供。PDXK小干扰RNA序列(small interfering RNA of PDXK,siPDXK) siRNA-PDXK-748、阴性对照序列(siRNA negative control,siNC)均由苏州吉玛基因股份有限公司合成;Lipo fectamin 2000 转染试剂购自Invitrogen公司;PDXK和GAPDH引物由上海生工生物工程有限公司合成。细胞RNA提取试剂盒购于Omega Bio-Tek公司(R6834-01),逆转录试剂盒购于碧云天生物科技有限公司(D7168M),实时荧光定量PCR试剂盒购于Tolobio公司(22204-2)。CCK-8细胞增殖检测试剂盒(C6005M)购于UElandy公司。
1.2 方法
1.2.1 肝癌数据集筛选、提取及分析。利用Timer2.0数据库进行分析PDXK在肿瘤组织(n=371)和正常组织(n=50)中的表达情况、预后情况和免疫细胞浸润的相关性。UALCAN数据库分析PDXK在不同患者年龄、性别、瘤症分级、淋巴转移情况、瘤症分期、T53突变状态和组织学亚型的LIHC组织与正常肝组织中的差异表达情况。HPA数据库分析PDXK免疫组化蛋白在LIHC组织和正常组织中的差异表达。利用STRING数据库绘制蛋白质相互作用网络图(置信度为0.04),利用数据库DAVID进行功能富集分析,以FDR.P.val<0.05为入选标准。
1.2.2 采用小干扰RNA技术敲低肝癌细胞Bel7404中PDXK。选对数生长期的Bel7404细胞(5×105个/mL)加入6孔板,培养过夜后,换无血清DMEM培养液培养1h,Lipofectamine 2000转染试剂转染siRNA-PDXK-748序列: 正向引物序列为GGGCAGCAACUACCUGAUUTT,反向引物序列为AAUCAGGUAGUUGCUGCCCTT),转染阴性对照序列: 正向引物序列为UUCUCCGAACGUGUCACGUTT,反向引物序列为ACGUGACACGUUCGGAGAATT,转染6h后,换成含血清的DMEM培养基培养24h后检测敲低效率。
1.2.3 观察PDXK敲低后细胞形态变化。采用倒置显微镜观察PDXK敲低组和阴性对照组的Bel7404细胞形态变化,10×目镜视野下随机采集4个视野的Bel7404细胞形态图。
1.2.4 CCK8法检测PDXK敲低后细胞存活率。取对数生长期的Bel7404细胞,以5×103个/孔接种96孔板,铺板过夜后,换成无血清培养基,用Lipofectamine 2000转染试剂转染 siRNA-PDXK-748处理6h,去上清液,再加含10% CCK-8的培养液放于37℃培养1.5h,移至酶标仪450nm波长读取吸光度(OD) 值,以CCK-8工作液为空白组,Bel7404细胞存活率= (OD实验-OD空白) /(OD对照-OD空白)×100%。
1.3 统计学方法 实验至少重复3次,采用GraphPad Prism 5.0软件统计分析,组间比较采用单因素方差分析,两两比较采用Bonferroni检验分析,P<0.05为差异有统计学意义。
2 结果
2.1 生物信息学分析PDXK在泛癌、LIHC组织和非肝癌组织中的mRNA表达 Timer2.0和UALCAN数据库分析PDXK在泛癌、肝瘤组织和正常组织中的表达情况,结果如下图1a所示PDXK在多种癌组织中高表达,肝癌组织(n=371)比正常癌旁组织(n=50)表现出较高的PDXK水平,见图1b(P<0.001)。
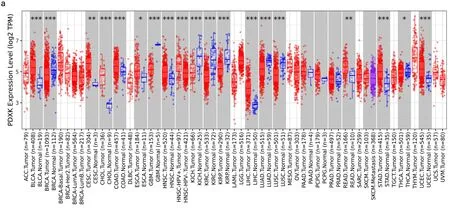
图1 PDXK在泛癌、LIHC组织与正常组织中的mRNA表达
2.2 生物信息学分析PDXK在LIHC组织和非肝癌组织中的蛋白表达 从HPA数据库获得的免疫组织化学(IHC)染色数据显示PDXK蛋白在LIHC组织中明显比人正常肝组织表达高,与前述的mRNA表达结果一致,见图2。
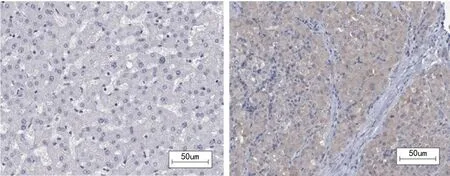
正常肝组织 肝癌组织
2.3 PDXK表达水平与LIHC患者临床病理学特征的关系 整合UALCAN数据库中TCGA-LIHC和正常对照组样本的多个临床信息进行分析,选择年龄、性别、体重、T53突变状态、癌症分级、癌症分期、淋巴转移及组织学亚型等方面进行相关性分析,比较不同组别LIHC患者PDXK的表达情况,结果显示 PDXK在多个不同临床病理特征及癌症分期、分级中存在差异表达,LIHC患者的PDXK转录本表达水平明显高于正常组织,与体重、TP53变异、癌症分级、癌症分期、淋巴转移呈一定程度正相关(P<0.05),与年龄、性别、病理学分型相关性不大(P>0.05),见图3。
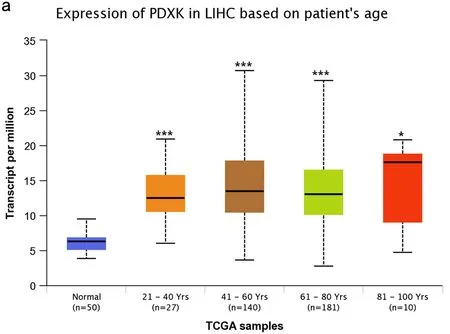
图3 PDXK在LIHC不同临床病理特征及癌症分级、分期中的表达与关系
2.4 生物信息学分析PDXK与甲基化的相关性 基于UALCAN数据库分析发现LIHC中PDXK启动子甲基化水平比正常对照组低,与不同癌症分级(G2~G4)的启动子甲基化水平呈一定程度的负相关,差异具有统计学意义(P<0.001或P<0.01),见图4。

图4 PDXK表达与甲基化关系VS正常对照组 **P<0.01 ,***P<0.001
2.5 生物信息学分析PDXK与肿瘤微环境中免疫细胞浸润的相关性 通过TIMER数据库分析发现,PDXK基因与肿瘤微环境中各类免疫细胞浸润的相关性是高度一致的,即LIHC中PDXK表达水平与B淋巴细胞、CD4+T淋巴细胞、巨噬细胞、中性粒细胞和树突细胞的浸润水平均呈显著正相关(P<0.05),与肿瘤细胞的纯度和CD8+T细胞无相关性(P>0.05),见图5。

图5 PDXK与肿瘤微环境中免疫浸润细胞的相关性
2.6 生物信息学分析PDXK与LIHC患者生存预后的相关性 在Timer2.0数据库收集分析371例肝癌患者中PDXK表达与总体生存期的关系,结果如图6所示PDXK的高表达和低表达的总体生存期存在显著性差异, PDXK高表达与LIHC患者较差的总体生存期密切相关(P<0.05)。
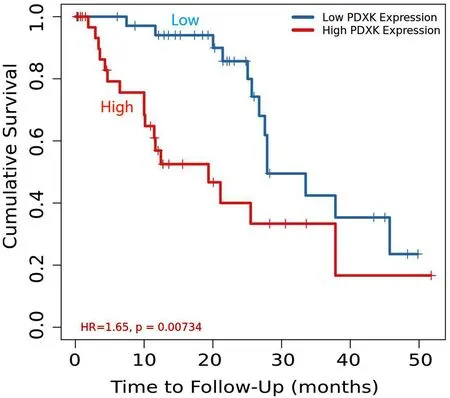
图6 PDXK表达与 LIHC 患者生存率的相关性
2.7 敲低 PDXK引起细胞形态损伤和细胞存活率降低 在Bel7404细胞中敲低PDXK后,明显抑制Bel7404细胞的生长增殖、Bel7404细胞形态改变、出现皱缩现象(见图7a)。且敲低PDXK后明显降低Bel7404细胞存活率(P<0.01,见图7b)。
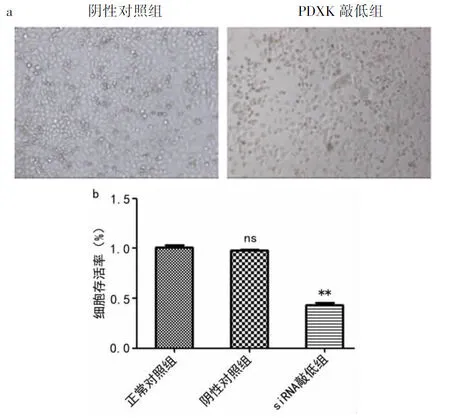
图7 敲低PDXK引起细胞形态破坏和细胞存活率降低
2.8 蛋白互作网络与功能富集分析结果 结果显示,PDXK与多个蛋白存在紧密互作的联系(见图8),与PDXK作用关联紧密的Top10基因有PNPO、PDXP、AOX1、PHOSPHO2、PLPBP、TEF、FDX1、FDX 2、TP53RK、PCNAPDXK。PDXK的互作蛋白被用于GO和KEGG功能富集分析(见图9)。GO富集分析主要包括1个生物学过程、4个细胞组分和4 个分子功能,其中细胞组分包括胞质(GO:0005829)、核质(GO:0005654)、外泌体(GO:0070062)、胞核(GO:0005634);分子功能包括磷酸吡啶酯结合(GO:0030170)、 ATP结合(GO:0005524)、蛋白质均聚活性(GO:0042803)、镁离子结合 (GO:0000287);生物学过程包括参与磷酸化作用(GO:0016310);KEGG富集的通路主要包括辅因子的生物合成(hsa01240)、维生素B6代谢(hsa00750)、代谢途径(hsa01100)等信号通路中。
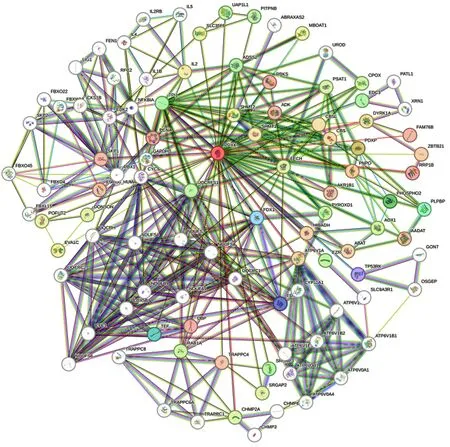
图8 与PDXK存在紧密联系的蛋白互作图
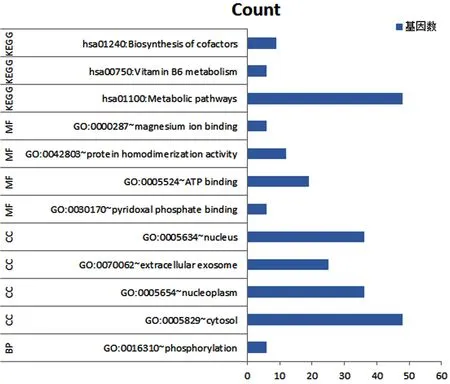
图9 PDXK基因及相关基因的功能富集
3 讨论
吡哆醛激酶 (PDXK)是一种由PDXK基因编码的维生素B6依赖性转移酶,对维生素B6生物合成补救途径至关重要,癌细胞依靠改变新陈代谢来支持其本身的异常增殖,PDXK对白血病细胞增殖至关重要,其活性的破坏会导致新陈代谢的改变以及核苷酸和多胺水平的降低[6]。研究表明PDXK缺乏可促进肿瘤细胞的铜细胞凋亡,减少了肿瘤细胞的增殖、迁移和侵袭[7]。PDXK表达与树突状细胞溶酶体相关膜糖蛋白呈正相关,影响局部免疫监视[8]。最近报道通过对1 816例卵巢癌患者的转录组数据分析,发现PDXK参与铂和紫杉烷的耐药相关性较高[3-4]。非小细胞肺癌中PDXK高表达与生存预后呈正相关,且提高对顺铂的敏感性[4]。敲低大鼠肾上腺嗜铬细胞瘤PC12细胞中的PDXK可显著抑制细胞增殖及生长[5]。在胃癌中,通过调控锌指蛋白促进膜联蛋白A2和肌成束蛋白的表达,同时抑制PDXK的表达,影响胃癌的化疗敏感性[9]。PDXK在多种癌症中过表达,可能是抗癌药物设计和分子治疗的潜在靶标,然而,目前PDXK在肝癌中的表达及对肝癌发生发展中的作用尚不清楚。
本研究中,通过生物信息学分析发现PDXK在肝癌组织中的转录水平和蛋白水平均较正常肝组织高表达,PDXK在不同临床病理特征和不同癌症分期、分级中存在差异表达,且其表达水平与肝癌分期、分级均呈正相关,提示PDXK可能是诱发肝癌的关键风险因子。PDXK高表达与肝癌患者的生存预后呈负相关,说明PDXK可能是肝癌潜在的预后分子靶标;肿瘤的发生发展和临床预后与肿瘤微环境中免疫细胞浸润水平密切相关,癌变中免疫耐受和逃逸作用下会使肿瘤微环境中免疫细胞的表达受抑制,无法进行抗癌,反而利于肿瘤进展和转移[10-11]。肝癌中PDXK的高表达与B细胞、CD4+T细胞、巨噬细胞、中性粒细胞和树突细胞的浸润水平均呈显著正相关,说明PDXK的异常高表达可能与肿瘤微环境免疫活性的调节有关,从而影响肝癌患者免疫治疗的效果,因此,PDXK可能是肝癌微环境免疫状态的潜在标志物。DNA甲基化在恶性肿瘤发病机制中调节染色质重塑和基因转录功能,最终在细胞水平影响癌症的特征和行为;异常甲基化,包括启动子高甲基化和低甲基化,参与多种癌症的肿瘤发生,在复制后期异常的整体甲基化丢失与免疫逃逸特征相关[12-14]。PDXK高表达与肝癌甲基化呈一定程度的负相关,说明PDXK高表达可能引起异常低甲基化,促进肝癌的免疫逃逸。
为研究PDXK的细胞组成、分子功能和生物学特性,对PDXK进行基因功能富集分析,其中与PDXK作用关联紧密的基因有PNPO、PDXP、AOX1、PHOSPHO2等,这些基因均参与了癌症的发展。例如:PNPO过度表达与患者的总体生存率呈负相关,敲低PNPO会导致乳腺癌细胞增殖、迁移、侵袭和集落形成减少,使细胞周期停滞在G2/M期并诱导细胞凋亡[15]。PDXP的遗传和表观遗传学改变会导致计时蛋白表达的改变,从而可调节神经胶质瘤细胞增殖与侵袭之间的相互作用[16]。研究发现与具有AOX1甲基化的个体相比,没有AOX1甲基化的个体患乳腺癌的风险高1.37倍(95%CI:1.02~1.84),AOX1和IRF4的非甲基化是乳腺癌的危险因素[17]。AOX1的高表达通过活性氧 (ROS) 的产生促进结直肠癌增殖和侵袭并抑制细胞凋亡[18]。与非肿瘤组织相比,肿瘤组织中PHOSPHO2显著升高,PHOSPHO2的高表达与肝癌患者较差的总生存期相关,PHOSPHO2的敲低降低了OR-6和 Huh 7.5.1 肝癌细胞中用索非布韦治疗增加的细胞增殖和迁移[19]。以上结果均与本研究的结果相符合,说明PDXK高表达可能是促进肝癌细胞发展的关键风险因子。GO富集分析发现,PDXK基因及相关基因参与的细胞组分包括外泌体(GO:0070062)。外泌体是含有microRNA、RNA、DNA片段和蛋白质的小膜囊泡,可从供体细胞转移到受体细胞,肿瘤细胞释放外泌体来重新编程与肿瘤微环境相关的因子,从而导致肿瘤转移和免疫逃逸;新的证据表明,癌细胞来源的外泌体携带免疫抑制分子程序死亡配体1,它与受体程序死亡蛋白1结合,并通过逃避免疫反应来促进肿瘤进展[20]。由此推测,PDXK可能通过外泌体介导调控肝瘤转移和免疫逃逸。KEGG富集的通路集中在辅因子的生物合成(hsa01240)、维生素B6代谢(hsa00750)、代谢途径(hsa01100)等信号通路中。葡萄糖代谢紊乱是肿瘤代谢的十大特征之一,研究发现PDXK的下调影响葡萄糖代谢的稳态和DNA完整性,PDXK基因的突变可导致染色体畸变,使葡萄糖含量增加,暗示PDXK可能通过调控葡萄糖代谢来促进肝瘤发展[21-22]。研究发现维生素B6代谢参与DNA损伤和癌症发展,维生素B6缺乏与多种肿瘤的明显增加有关,特别是影响胃肠道和肺部[6],这提示PDXK可能通过调控维生素B6代谢来影响肝癌的发生发展。肝脏是人体最重要的新陈代谢器官,PDXK的异常表达可能通过改变多个代谢相关信号通路调节参与肝癌的发生、发展。
为进一步确认PDXK对肝癌细胞的形态和生物学功能的影响,运用siRNA技术对Bel7404细胞中的PDXK进行敲低,利用倒置显微镜观察Bel7404细胞的生长形态,结果显示PDXK敲低后引起Bel7404细胞形态改变、损伤,出现皱缩现象,显著抑制Bel7404细胞的生长增殖,进一步运用CCK-8法检测Bel7404细胞的存活率,发现PDXK敲低后可显著降低Bel7404细胞的存活率。该结果与先前研究中敲低PDXK显著抑制肾上腺嗜铬细胞瘤细胞增殖的研究结果一致[5]。
综上所述,本文通过生物信息学方法和实验验证揭示了PDXK在肝癌中的价值, PDXK高表达可能是导致LIHC患者预后不良的独立危险因素,PDXK有望成为肝癌的抗癌药物设计、分子治疗的有效分子靶点和预后评估的生物标志物,但仍需更多实验来进一步研究。

