结直肠癌组织中CK7、CDX2、P53表达及与临床病理特征的关系
苏瑜娇 沈艳玲 叶承祖 中国人民解放军陆军第七十三集团军医院,福建省厦门市 361003
结直肠癌(CRC)是中老年人群常见的消化系统恶性肿瘤,其病死率与发病率仅次于胃癌、食管癌、原发性肝癌,随着社会不断发展,人们工作方式与饮食习惯改变,其发病率逐渐增高,而发病年龄趋于年轻化[1-2]。早期CRC症状不明显,不易受到患者重视,当患者发生肠梗阻、便血、腹痛等症状时,病情相对严重,常错过最佳医治时期,预后较差。故早期寻找特异性指标评估患者病情及预后至关重要。尾型同源盒转录因子-2(CDX2)、细胞角蛋白7(CK7)、P53是调控细胞分化与凋亡的关键信号分子,其表达与多种恶性肿瘤的侵袭、转移密切相关[3-4]。但对CRC组织中CK7、P53、CDX2表达情况临床研究较少。本文分析结直肠癌组织中CDX2、CK7、P53表达及与临床病理特征的关系,为临床诊治提供新的思路。报道如下。
1 资料与方法
1.1 一般资料 选择2020年1月—2023年2月在本院行手术治疗的82例CRC患者为观察对象,术中会阴部采集癌组织和癌旁组织(距离肿瘤边缘>3cm的正常组织)。纳入标准:符合《中国结直肠癌诊疗规范(2017年版)》[5]内CRC诊断标准,经病理组织学检查证实;临床资料完整;肿瘤病灶明确,病理资料齐全;患者或家属签署知情同意书。排除标准:重要脏器功能衰竭;凝血功能障碍;术前接受放化疗等辅助治疗;存在自身免疫功能缺陷病;合并其他恶性肿瘤。82例患者中男49例,女33例;年龄41~70岁,平均年龄(56.96±5.12)岁;肿瘤分化程度:高分化18例,中分化49例,低分化15例;病理类型:浆膜浸润型18例,非浆膜浸润型64例;存在淋巴结转移48例;Dukes分期:A期16例,B期40例,C期18例,D期8例。
1.2 方法 CK7、P53、CDX2单克隆抗体试剂盒均购自福州迈新生物技术开发有限公司。对术中采集的癌组织和癌旁组织行免疫组化检测:石蜡包埋切片(切片厚度为3μm)后将组织黏附于防脱载玻片上,65℃烤片40min。二甲苯溶液脱蜡(3缸二甲苯,每缸浸泡5min),无水乙醇洗去二甲苯,然后使用由高到低梯度酒精进行水化。通过DAKO Autostainer Link48免疫组化仪实施抗原修复及免疫组化染色,结束后手工苏木素复染,1%盐酸乙醇分化,稀氨水返蓝,无水乙醇脱水,吹干,盖玻片封片后于显微镜下观察。由2名经验丰富的病理科医师采用双盲法独立阅片,意见不一致时协商达成一致。阳性细胞比例评分:无表达为0分,阳性细胞比例1%~24%为1分,阳性细胞比例为25%~50%为2分,阳性细胞比例>50%为3分。染色强度评分:无色为0分,淡黄色为1分,棕黄色为2分、棕褐色为3分。以阳性细胞比例评分×染色强度评分进行评价,其中≥2分为阳性,0、1分为阴性。
1.3 观察指标 分析癌组织和癌旁组织内CK7、P53、CDX2阳性表达情况,对比癌组织内各指标阳性表达与CRC患者临床病理特征的关系。
2 结果
2.1 癌组织和癌旁组织内CK7、P53、CDX2阳性表达对比 癌组织内CK7、CDX2阳性表达率低于癌旁组织,P53阳性表达率高于癌旁组织,有统计学差异(P<0.05)。见表1。
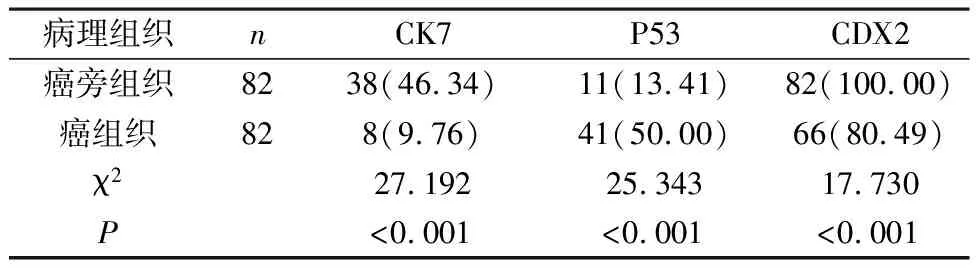
表1 癌组织和癌旁组织内CK7、P53、CDX2阳性表达对比[n(%)]
2.2 不同临床病理特征者癌组织内CK7、P53、CDX2阳性表达对比 浆膜浸润型、低分化、有淋巴结转移、C+D期CRC癌组织内P53阳性表达率高于非浆膜浸润型、中及高分化、无淋巴结转移、A+B期,CDX2阳性表达率低于非浆膜浸润型、中及高分化、无淋巴结转移、A+B期,且有淋巴结转移CRC癌组织内CK7阳性表达率低于无淋巴转移者,有统计学差异(P<0.05);不同肿瘤分化程度、病理类型、Dukes分期癌组织内CK7阳性率表达比较,无统计学差异(P>0.05)。见表2。
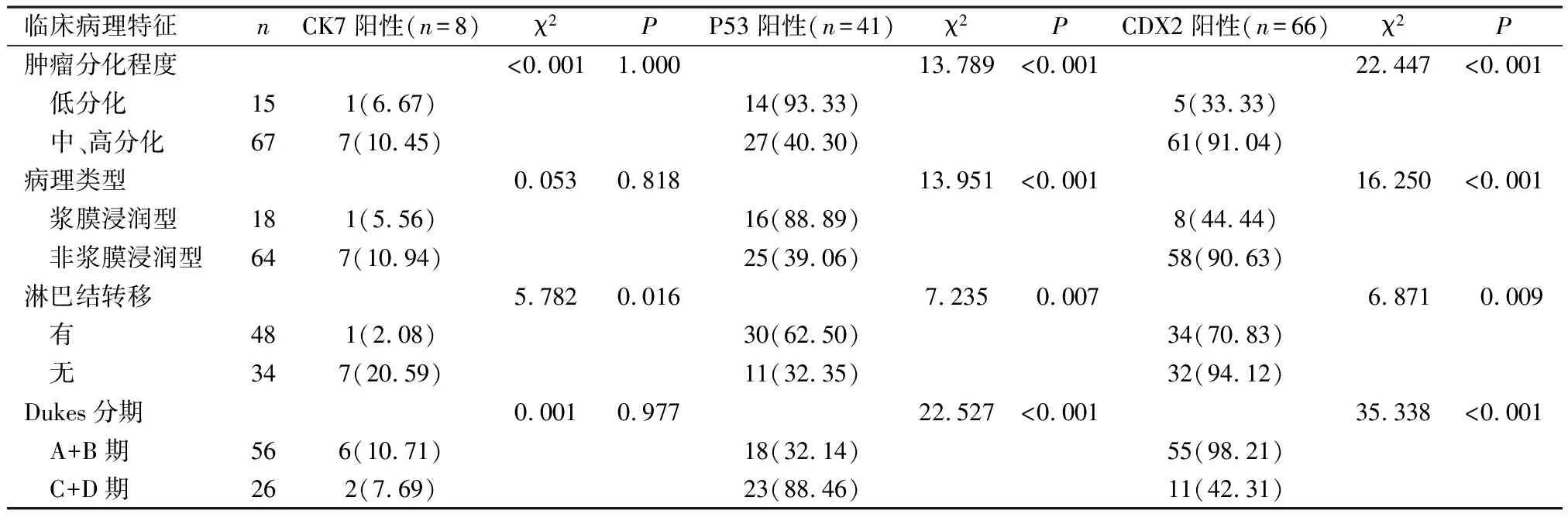
表2 不同临床病理特征者癌组织内CK7、P53、CDX2阳性表达对比[n(%)]
2.3 CK7、P53、CDX2阳性表达与CRC患者临床病理特征的相关性分析 CK7、CDX2阳性表达率与CRC患者淋巴结转移呈负相关(P<0.05),CDX2阳性表达率与CRC患者肿瘤分化程度、病理类型呈负相关(P<0.05),与Dukes分期呈正相关(P<0.05)。P53阳性表达率与CRC患者肿瘤分化程度、病理类型、淋巴结转移呈正相关(P<0.05),与Dukes分期呈负相关(P<0.05)。见表3。
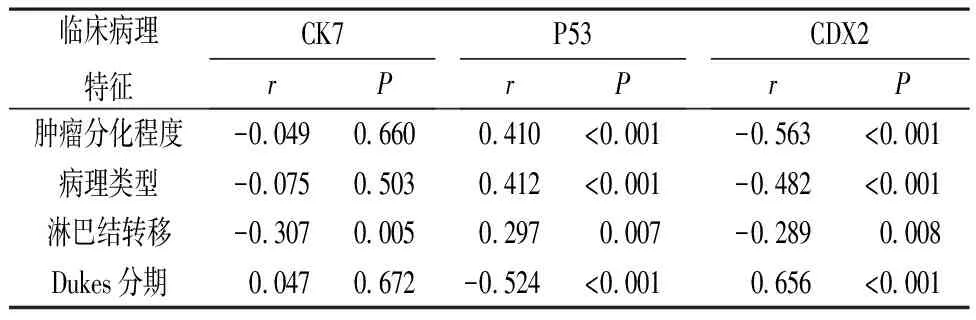
表3 CK7、P53、CDX2阳性表达与CRC患者临床病理特征的相关性分析
3 讨论
CRC发生与吸烟、遗传因素、高脂肪低纤维素饮食、环境因素等有关,因早期发现难度较大,多数患者就诊时已发展为中晚期,可经血液循环、淋巴等途径蔓延,扩散至邻近器官与组织内,预后较差,生存期短[6]。在CRC发生、进展中存在多种癌基因的失活、突变与激活,癌基因表达调控异常或基因突变一定程度上会增加癌细胞过度扩增风险,造成癌细胞促凋亡或正常分化过程失常[7]。故早期筛查高敏感的标志物,对肿瘤诊断和发生、转移评估有重要意义。
CK7是一种主要标记于腺上皮和移行上皮的碱性角蛋白,在乳腺上皮、子宫内膜、卵巢、肺和间皮细胞可呈阳性表达,但在源自胃肠道腺瘤中一般为阴性表达[8]。P53是重要的肿瘤基因编码蛋白,可影响细胞的低分化,增加组织学分级的恶化,参与细胞错配修复机制的形成,还可经激活akt或notch信号通路,促使肠道上皮细胞分裂象异常,增加癌细胞对肠道基底膜层的突破作用,已被认为与多种恶性肿瘤的发生发展密切相关[9-10]。CDX2属于酸性蛋白,多存在于肠上皮细胞的细胞核内,具有严格的上皮组织特异性,可维持肠上皮细胞的表型和调节肠上皮细胞的分化、增殖,且对消化道上皮细胞发育也起到重要作用[11-12]。本文结果显示,癌组织内CK7、CDX2阳性表达率低于癌旁组织,P53阳性表达率高于癌旁组织,提示CRC组织中CK7、CDX2、P53均异常表达。进一步分析显示,CK7、CDX2阳性表达率与CRC患者淋巴结转移呈负相关,CDX2阳性表达率与CRC患者肿瘤分化程度、病理类型呈负相关,与Dukes分期呈正相关;P53阳性表达率与CRC患者肿瘤分化程度、病理类型、淋巴结转移呈正相关,与Dukes分期呈负相关,提示CK7、CDX2、P53表达可能参与CRC疾病进展,可作为CRC诊断和病情进展评估指标。正常情况下,P53处于低表达状态,而在细胞应激时间会被激活而大量表达,能够与目标DNA序列相结合,抑制或激活大量靶基因的表达,触发一系列生物反应,影响细胞代谢、衰老、增殖、死亡及细胞DNA修复,抑制恶性肿瘤细胞的异常增殖与扩张,在降低恶性肿瘤患病风险及维持细胞遗传稳定性中发挥重要作用。P53能够通过亚细胞易位或激活具有促进细胞凋亡作用的Bcl-2家族中的BH3蛋白,促进细胞凋亡。肿瘤细胞中TP53突变多为错义突变,使得野生型P53蛋白质的DNA结合区域内单一的残基被替换,形成突变的P53蛋白,丧失对肿瘤细胞的调控作用,致使癌细胞增殖失控,且突变的P53蛋白可经转录调节因子、细胞内的酶、细胞蛋白等生物活性物质建立新的相互关系和调节通路,对野生型P53蛋白的活性起到抑制作用,促进癌细胞的侵袭、增殖、转移与化疗耐药,进而促进疾病进展。另外,肿瘤细胞中P53突变与丢失可经抑制MHC-Ⅰ类分子的抗原提呈作用和加强抑制性髓系免疫细胞和调节性T细胞的招募与活性,对肿瘤细胞免疫识别能力调节,帮助肿瘤细胞逃逸免疫系统的监视,促进癌症进展。
综上所述,CRC组织中CK7、CDX2、P53均异常表达,与CRC发生、进展存在一定相关性,可作为CRC诊断和病情进展评估指标。

