食管癌外周血相关指标和系统免疫炎症指数与临床病理特征的相关性研究
张若仪 陶一勤
安徽医科大学附属巢湖医院心胸外科,安徽省巢湖市 238000
食管癌是一种世界范围内较为常见的恶性肿瘤,据统计,2020年我国食管癌新发病例有32.4万人,其中死亡病例有30.1万人,分别占全球食管癌发病与死亡的53.70%和55.35%[1]。早期的食管癌并无特异性临床表现,大多数患者就诊时已达肿瘤的中晚期,所以发病率及致死率均较高[2],发现后即使行手术切除,术后也往往需辅助放化疗、靶向或免疫治疗,且复发率仍较高[3]。有研究表示早期食管癌患者在接受治疗后5年生存率可达95%[4]。
目前,食管癌的诊断依赖于内窥镜活检,组织学检查必须按照WHO标准进行,一旦确定了组织学诊断,就必须确定临床分期以确定预后和治疗策略[5]。虽然内窥镜是食管癌疾病诊断的金标准,但由于其费用高、不易操作,并且为侵入性检查,不适合作为食管癌早期筛查进行推广[6]。众所周知,炎症与肿瘤的发生发展密不可分,参与肿瘤微环境构建、肿瘤起始及演变[7]。系统免疫炎性指数(SII)作为新型的炎症反应指标,可反映机体系统性炎症的高低,有助于肿瘤疾病的诊断、疗效监测和预后判断。本文主要通过回顾性分析我院食管癌患者的临床资料,探讨食管癌患者外周血中红细胞分布宽度(RDW)、中性粒细胞计数/淋巴细胞计数(NLR)、淋巴细胞计数/单核细胞计数(LMR)及SII与其临床病理特征之间的相关性,对肿瘤的临床病理特点作出预测,为食管癌的诊断和防治提供参考。
1 对象与方法
1.1 研究对象 (1)健康对照组:选取2022年1—12月于我院进行健康体检的临床资料完整的健康人群,共110例。(2)食管癌病例组:选取同时期我院收治的食管鳞癌患者154例。排除标准:有输血史的患者,有其他恶性肿瘤病史的患者,无法明确肿瘤原始病发灶的患者,有其他肿瘤转移至食管的患者,可疑、误诊及术后复诊的患者,行手术治疗但术后病理资料缺失的患者以及临床上考虑食管癌但无病理资料的患者。以上所有患者均为未经采用任何抗肿瘤治疗之前的原始标本,均以食管癌为原发癌。
1.2 研究方法 收集健康人群及食管癌患者的相关临床资料,其中血样资料包括:所有患者术前空腹抽取肘部静脉血,利用血球流水线xn+G8血液分析仪进行血常规检测,检测得到红细胞分布宽度(RDW)、中性粒细胞计数、淋巴细胞计数、单核细胞计数、血小板计数,并通过计算获得中性粒细胞计数/淋巴细胞计数(NLR),淋巴细胞计数/单核细胞计数(LMR),系统免疫炎症指数(SII)=血小板计数×中性粒细胞计数/淋巴细胞计数。健康对照组收集并计算同等指标。各检测指标的实验室参考范围为:RDW: 11%~16%;中性粒细胞计数:(2~ 7)×109/L;淋巴细胞计数:(0.8~4)×109/L;单核细胞计数:(0.12~1.2)×109/L;血小板计数:(100~300)×109/L,大于上述正常范围为阳性诊断标准。病理资料包括:患者肿瘤部位、病理类型的分化程度、病理的分期,标准依据《AJCC癌症分期手册(第8版)》,本研究中食管癌病理组织学类型均为鳞状细胞癌。分别探讨食管癌患者外周血中RDW、NLR、LMR、SII与其临床病理特征之间的相关性。
1.3 统计学方法 本次数据的统计工具为Excel,分析工具为SPSS25.0。计量资料经正态性检验后不符合正态分布,以M(P25,P75)表示,两两之间比较采用Mann-WhitneyU检验。用ROC曲线分析各炎症指标的临界值。采用Kruskal-WallisH检验多组间比较食管癌患者的临床病理特征。P<0.05为差异有统计学意义。
2 结果
2.1 两组外周血中RDW、NLR、LMR、SII水平比较 食管癌组患者的RDW、NLR、SII水平均明显高于健康人群,LMR水平明显低于健康人群,差异有统计学意义(P<0.05)。见表1。
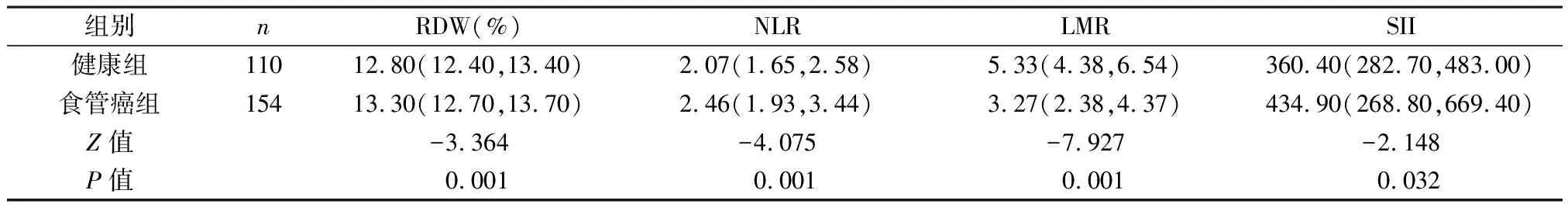
表1 两组外周血中RDW、NLR、LMR、SII水平比较
2.2 食管癌组患者术前外周血中RDW、NLR、LMR、SII临界值确定 根据ROC曲线分析,计算RDW、NLR、LMR、SII的约登指数(敏感性+特异性-1)最大点对应的临界值,选定RDW、NLR、LMR、SII的最佳截断值分别为13.25、2.895、4.130、563.8,对应的AUC分别为0.621、0. 647、0.817、0.578(P均<0.05),差异具有统计学意义。见表2及图1。

图1 食管癌组RDW、NLR、LMR、SII 临界值的 ROC 曲线
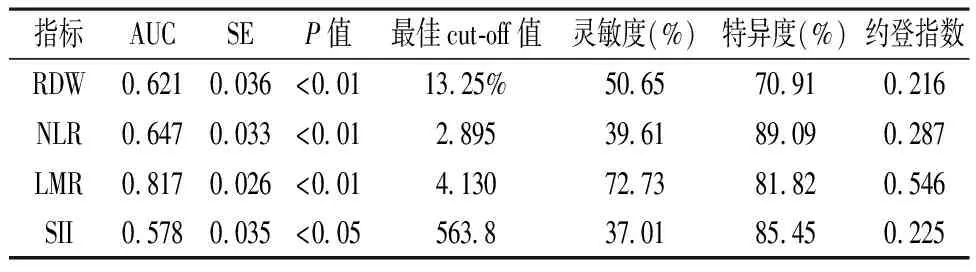
表2 食管癌组RDW、NLR、LMR、SII临界值的 ROC分析
2.3 食管癌组外周血中RDW、NLR、LMR、SII与临床病理特征的关系 根据食管癌患者外周血中RDW、NLR、LMR、SII的最佳临界值,四个指标分别分为高水平组和低水平组。RDW高水平组(≤13.25%,n=78)较低水平组(>13.25%,n=76)患者的年龄更大,病理分化程度更低。而在NLR高水平组(≤2.895,n=61)和低水平组(>2.895,n=93)的比较中,NLR较低的患者分化程度越高,TNM分期越早。LMR高水平组(≤4.13,n=42)和低水平组(>4.13,n=112)的比较中,低水平组的患者男性较多,肿瘤部位多在中和下段,N分期及TNM分期较晚。SII高水平组(≤563.8,n=97)较低水平组(>563.8,n=57)病理分化程度更低,N分期及TNM分期较晚。见表3。
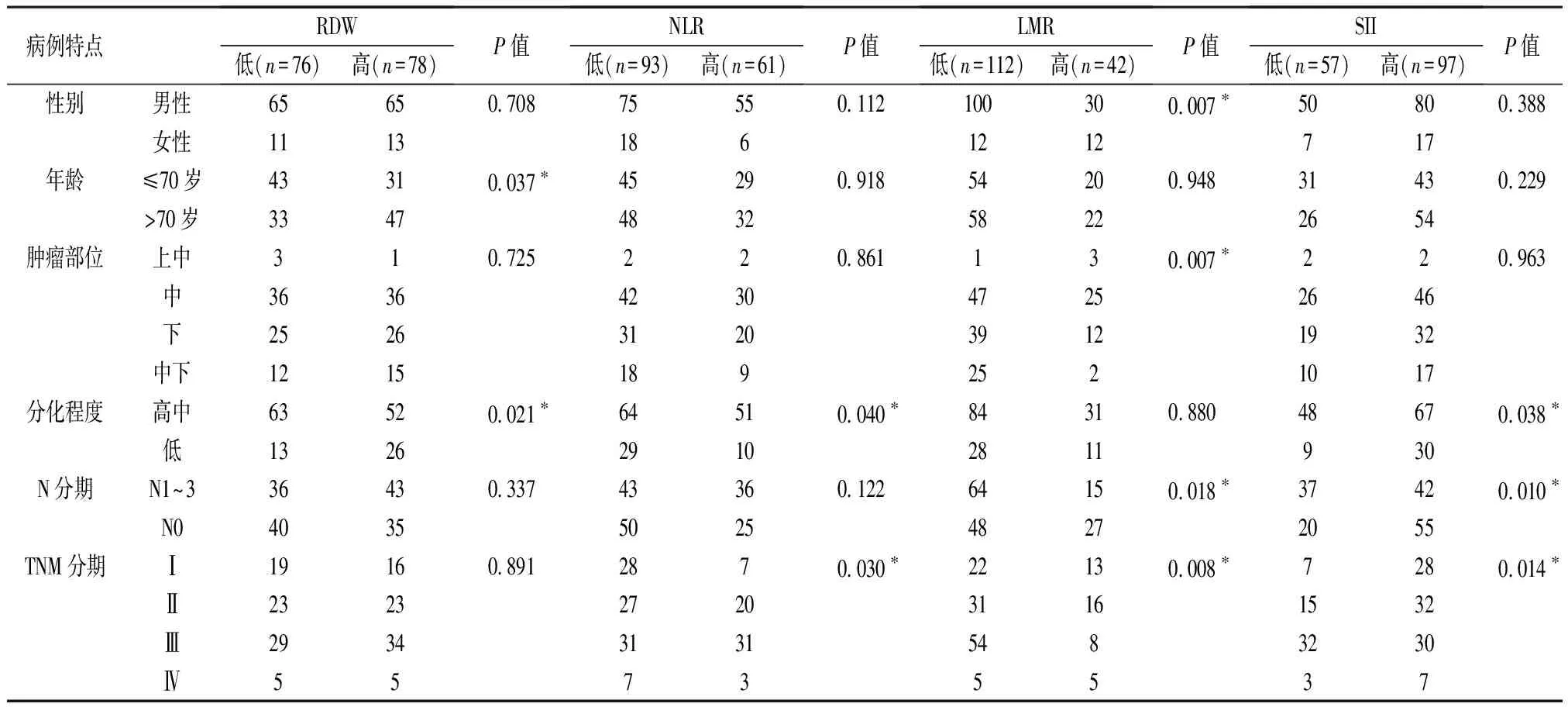
表3 食管癌组外周血中RDW、NLR、LMR、SII与临床病理特征的关系
3 讨论
食管癌是世界范围内高发病率、高致死率的一种恶性肿瘤,是世界第七大常见癌症,每年导致约45万人死亡,主要由食管鳞状细胞癌和腺癌组成,在我国主要以鳞癌为主[8],本次研究中食管癌病例的病理组织学也均为鳞状细胞癌。
1828年,让·尼古拉斯·马约林观察到鳞状细胞癌在创伤后疤痕组织周围发展,这表明慢性炎症参与了癌症的发展[9]。1863年,鲁道夫·维尔乔在肿瘤组织中观察到白细胞,这促使研究人员将炎症与癌症联系起来[10]。此后,越来越多的证据表明炎症在包括食管癌在内的许多癌症中的发生和进展中发挥重要作用。癌症是由化学致癌物、感染和慢性炎症等因素诱发的。大量的流行病学研究表明,慢性炎症是肿瘤形成的易感因素,包括炎症性肠病引起的结直肠癌、幽门螺杆菌感染引起的胃癌以及与胃—食道反流病相关的食管癌,超过25%的人类癌症可能与炎症条件有关。慢性炎症可通过多种机制促进癌症的发生和发展[11]。全身炎症对癌症影响的累积证据表明,全身炎症的特征是促进癌症的免疫反应,并且可预测患者预后。在癌症患者中,几种全身炎症标志物,如NLR、LMR、SII都很容易被检测,现已被证明全身炎症反应与各种癌症,包括结直肠癌、肺癌和食管癌的发展和进展密切相关[12]。
在本研究中发现,食管癌患者的RDW、NLR及SII值均高于健康人群,LMR水平明显低于健康人群,且差异具有统计学意义(P<0.05),说明食管癌患者的各炎性指标明显高于正常人。RDW是外周血常规检测的常见参数之一,常被用来反映红细胞体积大小异质性的指标,数值越大,表明红细胞体积的差异性也越大,传统上RDW多应用于缺铁性贫血等血液性疾病的鉴别和诊断以及铁动员中氧化应激增加和紊乱的早期指标[13]。Albayrak等人的研究证明,RDW及炎性指标的升高和患前列腺癌风险增加显著相关[14],这使得RDW参数成为癌症的相关标记物。RDW反映了患者的生理储备,这是癌症和慢性炎症患者生存和疾病结局的驱动因素[15]。在食管癌的众多发病因素中慢性炎症是其中之一[16],炎症干扰了铁的正常代谢,抑制红细胞生成素的产生,降低红细胞存活率,影响了红细胞寿命[17],并且由于食管癌疾病状态及不能正常进食等原因,使得患者中存在营养状况不良、红细胞数目减少等贫血状态,进而引发患者RDW的升高[18],本研究也验证了这一点。Qian Song等人的研究也表明了食管鳞癌患者术前血小板分布宽度升高预示术后预后不良,患者的术后住院时间更长、肿瘤深度更深、淋巴结转移率更高、病理分期更晚[19]。
NLR和LMR是反映炎症系统激活并参与炎症反应的敏感指标[20],SII是在NLR的基础上纳入了血小板计数,因此更能体现恶性肿瘤患者的免疫—炎症状态,也是一项重要的反映恶性肿瘤病情及预后的生物标志物[21],SII升高提示机体血小板数量的增多、中性粒细胞的增多和淋巴细胞的减少。全身炎症反应在肿瘤发展的各个阶段都发挥着重要作用,包括促进肿瘤细胞增殖、血管生成及转移等,炎症反应会改变肿瘤患者的血液参数,两者相互影响、相互作用,肿瘤相关性炎症反应会形成“雪球”效应进一步刺激肿瘤的生长[17]。首先,中性粒细胞的升高促进了肿瘤的增殖、迁移和血管生成,还可以激活内皮细胞和实质细胞,以增强肿瘤细胞的黏附作用,促进肿瘤细胞远处转移[22]。其次,淋巴细胞是炎症的另一个重要因子,淋巴细胞可以促进毒性细胞的激活和细胞因子的产生,从而抑制肿瘤的增殖和迁移,故淋巴细胞水平的降低会破坏抗肿瘤免疫反应,导致较差的预后[23]。中性粒细胞重塑细胞外基质以促进肿瘤生长和侵袭,并抑制淋巴细胞对恶性肿瘤细胞的杀伤[24]。所以NLR反映了促肿瘤炎症反应和抗肿瘤免疫反应之间的平衡。现在还有研究发现循环的单核细胞会促进肿瘤生长,帮助肿瘤细胞逃避免疫监视[25]。单核细胞桥接先天性和适应性免疫反应,可以通过诱导免疫耐受、血管生成和肿瘤细胞增殖转移的各种机制影响肿瘤微环境[26]。
血小板在肿瘤的发生、发展和转移中也起着至关重要的作用。血小板参与血管生成的不同步骤,包括增殖、迁移、细胞外基质降解和内皮细胞的黏附。活化的血小板通过释放炎症信息,并与中性粒细胞和单核细胞相互作用,参与癌症相关的血栓形成[19]。血小板还可以分泌肿瘤生长因子如血管内皮生长因子、血小板相关生长因子等,在肿瘤的生长和扩散中有重要作用[27]。在Feng等人的研究中表明,淋巴细胞减少的患者T分期和N分期越晚,并且5年生存率显著缩短,可作为判断食管癌患者预后的独立指标[28]。在他们的另一项研究中发现,高水平NLR和SII的患者肿瘤长度越长、TNM分期越晚,SII对于可切除的食管鳞癌患者是一个有用的独立预后指标[29]。说明高NLR和SII与肿瘤血管生成、侵入和转移相关,从而导致患者较差的预后。
在本研究中发现,RDW水平越高的食管癌患者年龄越大,病理分化程度越低。高水平的NLR及SII食管癌患者和低水平LMR的食管癌患者病理分化程度越低,N分期及TNM分期较晚。本结果与上述表述研究结果均相似,这就表明RDW、中性粒细胞、淋巴细胞、单核细胞及血小板都直接或间接地参与影响着肿瘤的演变。
综上所述,食管癌患者的RDW、NLR、LMR及SII值与食管癌的临床病理特征有相关性,可为临床预判提供一种新的依据。由于血常规检测简单、经济,因此可在临床推广。但本研究样本量较小,仍需进一步扩大样本量进行多维度分析。

