暹罗芽孢杆菌Y-54 对番茄叶霉病的生防作用
曾婉宁,王彦譞,王繁珍,陈招荣,刘慧芹,,姜永成,艾则麦提·图尔洪,李宝通,
(1.天津农学院 园艺园林学院,天津 300384;2.天津农学院 计算机与信息工程学院,天津 300384;3.和田职业技术学院,新疆 和田 848000;4.天津农学院 工程技术学院,天津 300384)
番茄叶霉病是由黄褐孢霉菌(Cladosporium fulvumCooke)引发的番茄上一种极为严重的叶部病害。叶霉病一旦发生,会迅速扩展,流行性极强,其防治往往是在加强栽培管理的基础上,依靠化学药剂防治控制病情[1]。但是化学药剂防治病害造成的病原菌抗药性增强、环境污染、农产品安全等问题日益严重。生物防治以其安全、健康、绿色的理念受到广泛关注[2-5]。目前的研究表明,芽孢杆菌因其种类繁多、存在广泛、功能丰富、适应性强,已成为植物病害生物防治中重要的菌种资源[6-10]。因此,深入开展芽孢杆菌对番茄叶霉病的生物防治研究,对进一步探明芽孢杆菌的生防机制及开展番茄叶霉病的绿色综合防控具有重要意义。近年来,众多学者在番茄叶部病害生物防治方面开展了生防菌挖掘筛选、生防效果和作用机制等的深入研究。WANG 等[11]研究表明,枯草芽孢杆菌WXCDD105 对番茄叶霉病的防效可达72.07%,对番茄种子萌发和幼苗生长均有促进作用。GAO 等[12]筛选了28 株拮抗细菌,其中贝莱斯芽孢杆菌ZSY-1 对番茄多种叶部病害有突出防效,且该菌可产生脂肽类抗菌物质伊枯草菌素A。SONG 等[13]的研究表明,高地芽孢杆菌B1-15 可产生挥发性有机物和较高水平的蛋白酶,有效促进番茄幼苗生长,减轻果实采后病害,延长贮藏期。此外,芽孢杆菌的微生物菌剂、微生物菌肥、微生物农药等生防产品的研发应用都取得了巨大进展[14]。目前,我国建立了较为完善的有害生物生防体系,形成了农用微生物菌剂和微生物肥料的标准体系,对引导和规范行业发展发挥着重要作用[15-16]。暹罗芽孢杆菌(Bacillus siamensis)是芽孢杆菌属近10 a 研究发现的新种[17],因其广谱抗菌性及具有其他生物活性成为极具有开发潜力的新型芽孢杆菌[18]。暹罗芽孢杆菌Y-54 是从健康红掌分离出的一株内生拮抗菌,对多种植物病原真菌有较强的抑制作用[19]。该菌株及其应用已于2021 年获国家发明专利(专利号:20202010730157.5)。目前,虽然对番茄叶部病害生物防治的研究较为深入,但能够有效抑制番茄叶霉病菌并对该病害有突出防效的拮抗菌株还较少,涉及生防菌定殖情况和促生表现等的研究不够全面深入。因此,需要深入挖掘生防资源并就其功能和机制开展研究。为深入挖掘菌株Y-54 的生防潜力和扩宽应用范围,研究该菌株对番茄叶霉病菌的抑制作用及其定殖变化和促生作用,并分析其在盆栽试验中的防治效果,以期为番茄叶部病害的绿色防控提供理论依据。
1 材料和方法
1.1 材料
供试菌种:暹罗芽孢杆菌(B.siamese)Y-54、番茄叶霉病菌(C.fulvumCooke),由天津农学院植物病理学实验室提供;番茄品种:春野、精品L400,由辽宁绿野农业科技有限公司提供;培养基:LB 固体及液体培养基、PDA 培养基;药剂:10%苯醚甲环唑WDG(山东百农思达生物科技有限公司)、50%多菌灵WP(浙江一帆化工有限公司)。
1.2 方法
1.2.1 菌株活化、发酵液及孢子悬浮液的制备 菌株活化:挑取菌株Y-54 单菌落在LB 培养基中划线,于28 ℃培养箱培养48 h。使用打孔器打取直径5 mm 番茄叶霉病菌菌饼,接种于PDA 培养基,于25 ℃恒温培养3~5 d。
菌株Y-54 发酵液制备:挑取菌株Y-54 单菌落至装有250 mL LB 液体培养基的三角瓶中,28 ℃、180 r/min 振荡培养24~36 h,形成菌液,调节菌液浓度至1.0×108cfu/mL,再依次稀释为10×、20×、50×、100×发酵液。
番茄叶霉病菌孢子悬浮液制备:活化好的叶霉菌产孢后,用无菌水洗脱孢子,过滤菌丝,10 000 r/min 离心1 min,弃上清液,收集孢子,再用无菌水冲洗孢子,用血球计数板调节孢子浓度为1.0×107cfu/mL。
1.2.2 拮抗菌株Y-54 对番茄叶霉病菌的抑制作用测定 菌株对峙:将病原菌接种至PDA 平板中间位置,距病原菌四周1.5 cm 处划线接种拮抗菌;发酵液抑制:采用四点对峙培养的方法,将病原真菌接种在PDA 培养基的正中央,距病原菌四周1.5 cm 处放置4 个滤纸片,然后分别在滤纸片上滴10 μL 拮抗菌发酵液;无菌滤液抑制:拮抗菌发酵液经12 000 r/min 离心20 min,取上清液经0.22 μm 一次性微孔滤膜过滤后得到无菌滤液。将其与PDA 培养基(1∶9)充分混合,制成平板后将病原菌菌块接至培养基中央。以空白PDA 培养基为CK,均放入28 ℃培养7 d,重复3次,测定抑菌率。
菌丝生长抑制:挑取适量病原菌菌丝于无菌离心管中,分别加入1 mL 菌株Y-54 无菌滤液、1 000×苯醚甲环唑、500×多菌灵,充分浸泡24 h 后在显微镜下观察菌丝的形态变化,以加入无菌水为CK[20]。
1.2.3 拮抗菌株Y-54 抗利福平筛选及其定殖能力测定 参照刘慧芹等[21]及高振峰等[22]的利褔平(Rif)标记法对菌株Y-54进行不同浓度梯度的抗性标记,使其抗生素抗性达到100 μg/L。将抗性菌株的菌液浓度调至约1.0×108cfu/mL,取100 mL 菌液浇灌在番茄幼苗基部,以浇灌无菌水为对照。每3 d 在番茄苗根、茎、叶等不同部位取样,每部位随机取样5 次,共3.0 g。样品经超声波清洗并用75%乙醇消毒,研磨后加100 mL 无菌水稀释,在含有50 μg/L Rif 的LB 平板上涂布100 μL,于28 ℃培养72 h后计算菌落数。每个处理重复3次。
1.2.4 拮抗菌株Y-54 对番茄种子萌发的影响试验 番茄种子用0.1%高锰酸钾液浸泡5 min,无菌水冲洗后,分别在0×(原液)、10×、20×、50×、100×菌株Y-54发酵液中浸泡24 h,以无菌水为CK,无菌培养皿中放30 粒种子,25 ℃黑暗培养,每日定时补添无菌水保持种子湿润,设3 次重复,7 d 后测定发芽率。
1.2.5 拮抗菌株Y-54 对番茄幼苗生长的影响试验 选取有2~3 片真叶时的盆栽番茄幼苗,分别用0×(即原液)、10×、20×、50×、100×发酵液进行灌根,每株10 mL,10 d 补施1 次,以无菌水为CK,室温培养,播种30 d 后测量株高、鲜质量、叶长、叶宽及根长。采用YT-YD 便携式叶绿素测定仪测定叶片的SPAD值,均设3次重复。
1.2.6 拮抗菌株Y-54 对番茄叶霉病的防治效果测定 于盆栽番茄幼苗长至3~4 片真叶期时,使用0×(原液)、50× Y-54 发酵液浇灌番茄幼苗,每株10 mL,以无菌水为对照,14 d后再补灌第2次菌液。第1 次浇灌Y-54 菌液7 d 后,利用针刺接种叶霉病菌,保湿24 h,室温20~32 ℃,待其发病。针刺接种约14 d 后发病,一部分对照分别喷施50%多菌灵WP 500 倍液和10%苯醚甲环唑WDG 1 000 倍液,另一部分对照作空白。发病后7 d 和14 d 调查病情指数及防效。病情分级标准参考陈乐乐等[23]的方法。每个处理10 株,3 次重复。病情指数=∑(各级病株数×该病级值)/(调查总株数×最高级值)×100;防治效果=[1-(对照区药前病情指数×施药区药后病情指数)/(对照区药后病情指数×施药区药前病情指数)]×100%。
1.3 数据统计与分析
试验数据采用SPSS 16.0 和Excel 2007 软件进行统计分析,应用Duncan氏新复极差法进行处理间差异显著性检验。
2 结果与分析
2.1 拮抗菌株Y-54对番茄叶霉病菌的抑制作用
菌株Y-54 对番茄叶霉病菌的抑制作用如图1所示。菌株对峙培养、发酵液和无菌滤液均对番茄叶霉病菌有较强的抑制作用,抑制率分别达到78.42%、86.42%和91.26%。由此可见,菌株经过发酵后抑制效果更佳。
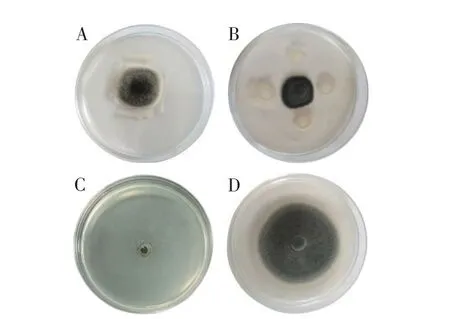
图1 菌株Y-54对番茄叶霉病菌的抑制作用Fig.1 The inhibition effect of strain Y-54 on C.fulvum
菌株Y-54 对叶霉病菌菌丝生长的影响如图2所示。CK(图2A)菌丝粗细均匀,形态饱满,结构完整。无菌滤液和1 000×苯醚甲环唑、500×多菌灵处理后会严重影响其生长发育,菌丝生长变形弯曲,菌丝体前端膨胀呈圆球状,中段萎缩形成拐点或节点(图2B、C);菌丝内物质外渗(图2D),菌丝出现中空断裂等现象(图2B)。

图2 菌株Y-54对番茄叶霉病菌菌丝生长的影响Fig.2 Effect of strain Y-54 on mycelium of C.fulvum
2.2 拮抗菌株Y-54在番茄中的定殖情况
抗性菌株Y-54 在番茄幼苗中的定殖情况如图3 所示。在30 d 内,菌株Y-54 均可在番茄的根、茎、叶中定殖,但不同时间及不同部位的定殖量不同,整体上定殖量为根>叶>茎。在根部和叶部,18 d时定殖量达到最大,分别为8.37×105cfu/mL 和3.29×105cfu/mL,而在茎部则表现为15 d 时定殖量最大,为2.24×105cfu/mL。在茎、叶部,定殖的菌量变化趋势较为一致,进入高峰期后,回落较平稳;而在根部定殖的菌量则表现为升降较明显。可见,该菌株可以在番茄不同部位定殖,且更易在根部存活。
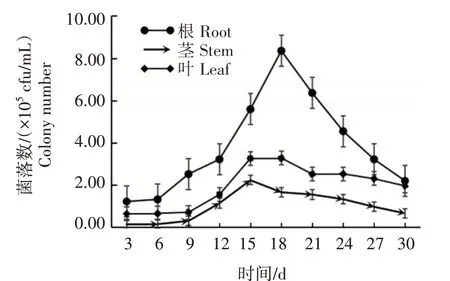
图3 菌株Y-54在番茄幼苗中的定殖情况Fig.3 Colonization of strain Y-54 in tomato seedlings
2.3 拮抗菌株Y-54对番茄种子萌发的影响
菌株Y-54对番茄种子萌发的影响如表1所示。5 个稀释倍数的发酵液均对种子萌发有促进作用。其中发酵原液(0×)对番茄种子萌发的促进作用最明显,发芽率达93.33%;其次是10×与20×发酵液处理,番茄种子发芽率虽然显著低于发酵原液处理,但也达86%以上,显著高于50×和100×发酵液处理(P<0.05);50×和100×处理发芽率有所下降,但仍保持在76%以上,显著高于CK(P<0.05)。整体上看,随着稀释倍数的增加,番茄种子发芽率降低,即浓度越高,发芽率越高。
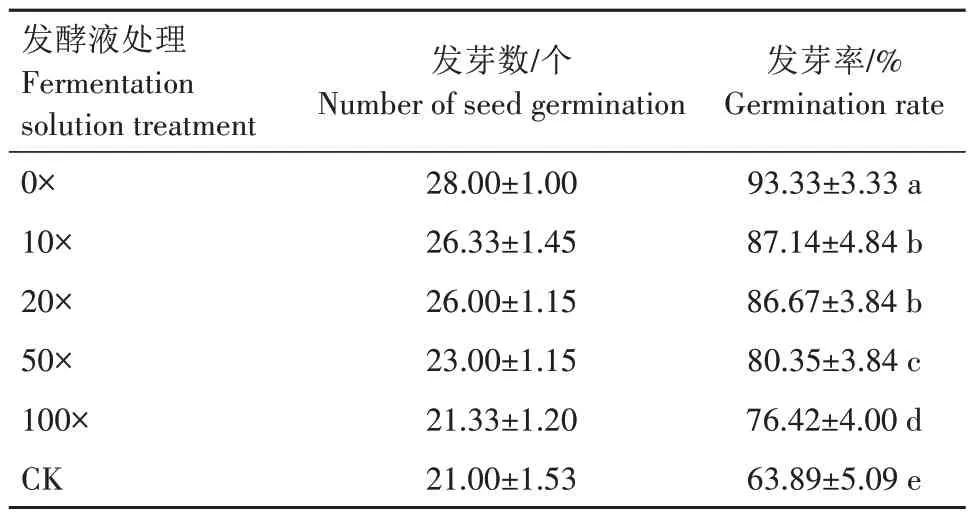
表1 菌株Y-54对番茄种子萌发的影响Tab.1 Effects of strain Y-54 on tomato seed germination
2.4 拮抗菌株Y-54对番茄幼苗生长的影响
采用不同稀释倍数的菌株Y-54 发酵液对番茄幼苗灌根处理后,幼苗的生长状况如表2 所示。根长、株高、茎粗、叶长、叶宽、鲜质量、叶绿素含量(SPAD 值)的变化较为一致,即随着稀释倍数增加,其各指标递减。原液(0×)处理后幼苗各指标的表现最佳。0×、10×、20×发酵液处理对幼苗的影响均明显,对各指标的促生作用影响均显著高于CK(P<0.05)。
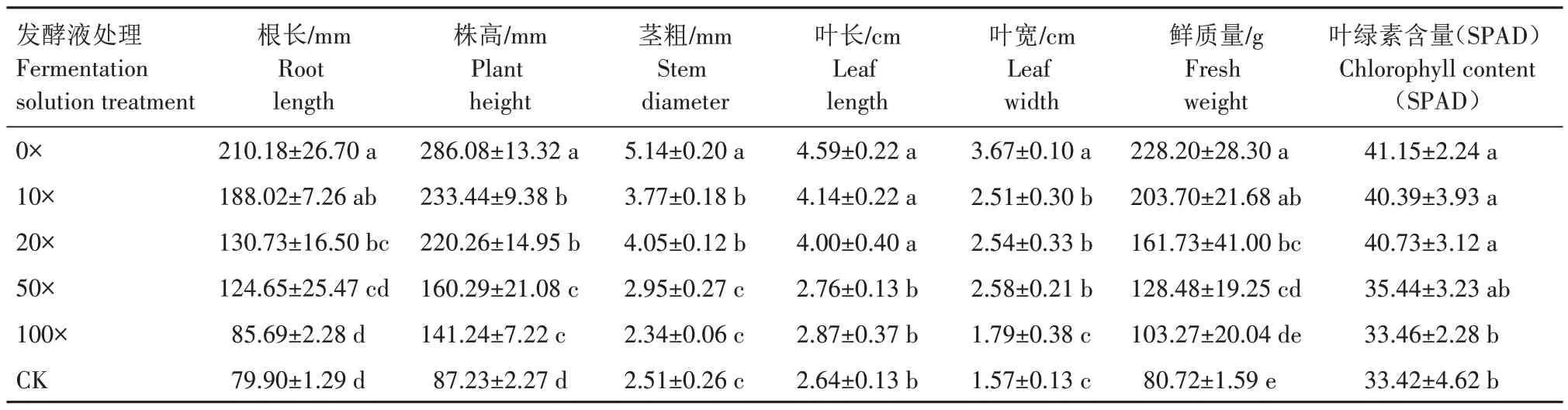
表2 菌株Y-54对番茄幼苗生长的影响Tab.2 Effects of strain Y-54 on tomato seedlings growth
2.5 拮抗菌株Y-54对番茄叶霉病的防治效果
菌株Y-54 对番茄叶霉病的防治效果如表3 所示。苯醚甲环唑对番茄叶霉病的防效最好,7 d 和14 d 的防效均在70%以上;其次是原液(0×)处理,7 d 时其防效略低于苯醚甲环唑处理,为68.04%,但二者之间并无显著差异(P>0.05),14 d 时则显著低于苯醚甲环唑处理,但2 次的防效均显著高于多菌灵处理(P<0.05);50× Y-54 发酵液处理的防效较差,均显著低于其他处理(P<0.05)。
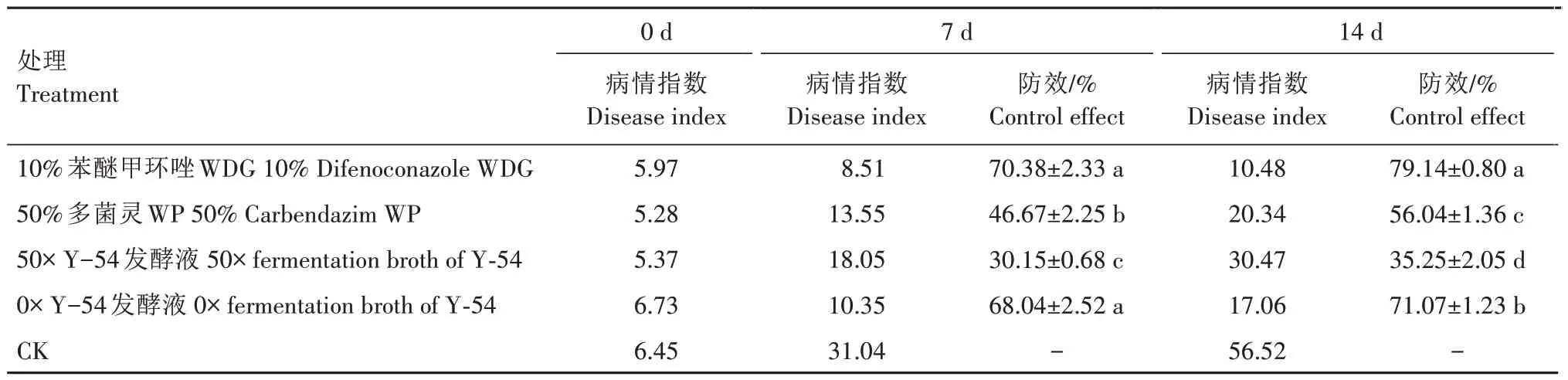
表3 菌株Y-54对番茄叶霉病的防效Tab.3 Control effect of strain Y-54 on tomato leaf mold
3 结论与讨论
每个植物都是一个独立的微生态个体,其体内的微生物体系在其适应环境、调节自身生长发育等方面发挥着重要作用[24],但外来的有益菌或致病菌往往会打破植物体内原有的微生态平衡,干扰植物的生长和生理变化。前期研究发现,菌株Y-54 可广泛地生存在多种植物中[19],在本研究中,菌株Y-54可以定殖在番茄中,并与其他众多芽孢杆菌具有相同的定殖特性[25-26],即更容易从根部经茎部到达叶部,且在根中的定殖量多高于其他部位,定殖菌量随着接种时间延长呈先上升后下降的变化趋势。在植物体内的生防菌能否成功控制病害,取决于其在植物、土壤等环境中的定殖能力和存活能力[27],该菌株具有定殖能力强、定殖范围广、在植物体内容易转运的特点,表明其具备防控病害的优质潜力。
本试验采用菌株对峙、发酵液以及无菌滤液3种方式均验证了菌株Y-54 对番茄叶霉病菌有较强的抑制作用,尤其是发酵液及无菌滤液的抑菌效果较好,分别达到86.42%和91.26%,接近于WANG等[11]筛选的枯草芽孢杆菌WXCDD105 对该病菌的抑制率(94.44%)。芽孢杆菌可抑制病菌菌丝的正常生长发育,其抑菌机制表现在多个方面,如莫哈韦芽孢杆菌[28]和蜡蚧芽孢杆菌[29]可产生多种挥发性有机化合物;贝莱斯芽孢杆菌[30]可产生活性二肽等,引起菌丝变形、膨胀、萎缩、断裂等现象。暹罗芽孢杆菌Y-54 同以上芽孢杆菌一样,严重导致叶霉病菌菌丝变形,因此,推测菌株Y-54 也可能会产生类似的抑制物质,或通过诱导作用对病菌直接产生作用。
通过提前浇灌和后期补灌的方式,菌株Y-54对番茄叶霉病的防效比较突出,尤其是发酵原液在接种发病后7 d 和14 d 的防效达到70%左右,接近苯醚甲环唑处理,明显好于多菌灵处理。可见,该菌株对番茄叶霉病有较理想的防治效果。该菌株对番茄的促生作用也较为明显,其中原液作用最明显,使种子发芽率达到93.33%;在幼苗生长过程中,各浓度发酵液均能促进番茄幼苗根长、株高、茎粗、鲜质量、叶绿素含量等指标增长,且发酵原液(0×)和10×、20×发酵液可显著提高幼苗的各项生长指标。这与杨晓云等[27]研究的解淀粉芽孢杆菌B1619、陈秀香等[31]研究的枯草芽孢杆菌FC21 的作用效果一致。
生防微生物防治病害的机制是多方面的,包括对靶标菌的抑制作用、与病原物竞争作用位点,以及能够产生蛋白质、多肽类、植物激素等物质,诱导植物产生多样抗病性[25]。本研究仅测定了菌株Y-54抑菌、定殖、促生、防治作用,鉴于菌株Y-54具有较好的潜力,在后续研究中将就其抗病机制和生产应用开展深入的探索。
综上,菌株Y-54 对番茄叶霉病菌有着较强的抑制作用,可导致病菌菌丝变形、膨胀、萎缩、断裂等。菌株Y-54 可在番茄的根、茎、叶部位进行定殖,定殖菌量在30 d 内的变化趋势呈先上升后下降,且在15~18 d 时达到最大。菌株Y-54 可以有效促进番茄种子的萌发,特别是发酵原液浸泡的种子发芽率最高,达93.33%;并且能有效促进幼苗根长、株高、鲜质量、叶绿素含量等各项指标的增长,以发酵原液(0×)和10×、20×发酵液的促生作用较好,显著高于对照。菌株Y-54 的发酵原液(0×)对番茄叶霉病发病后7 d 和14 d 内的防效接近于苯醚甲环唑处理,达到70%左右,显著高于多菌灵的防效。

